ÁREA
Química de Alimentos
Autores
Schaffel, I.F. (UNIVERSIDADE FEDERAL DO ESPÍRITO SANTO) ; Soares, L.P. (UNIVERSIDADE FEDERAL RURAL DO SEMI-ÁRIDO) ; Ferreira, R.Q. (UNIVERSIDADE FEDERAL DO ESPÍRITO SANTO) ; Tôrres, W.L. (UNIVERSIDADE FEDERAL RURAL DO SEMI-ÁRIDO) ; Santos, G.F.S. (UNIVERSIDADE FEDERAL DO ESPÍRITO SANTO) ; Leite, R.H.L. (UNIVERSIDADE FEDERAL RURAL DO SEMI-ÁRIDO) ; Aroucha, E.M.M. (UNIVERSIDADE FEDERAL RURAL DO SEMI-ÁRIDO)
RESUMO
Mel da abelha Apis mellifera L. é um produto que gera renda e notando seu consumo crescente devido a presença de antioxidantes naturais. O objetivo deste trabalho foi determinar a coloração e capacidade antioxidante de dois méis da região semiárida brasileira. Para isto, avaliou-se méis de Apis, florada multifloral, denominada florada cabeça de velho(Euphorbia- leucocephala) e silvestre, predominância da florada de velame(Croton heliotropiifolius), com predomínio da florada de velame coletados no município de Umarizal-RN. Observou-se que o mel silvestre com predomínio da florada de velame, apresentou coloração mais escura que o mel da florada multifloral. Porém, o mel multifloral mostrou maior capacidade antioxidante, o que pode estar associado a compostos específicos da florada.
Palavras Chaves
capacidade antioxidante; coloração; origem botânica
Introdução
O mel é um alimento que sempre foi apreciado e utilizado pelos seres humanos devido seu sabor adocicado característico e valor nutricional agregado. Sua produção parte do processo de alimentação das abelhas que recolhem plantas de diversas espécies e de várias regiões (CASTRO FILHO et al., 2017). As propriedades físicas e químicas são regulamentadas pela Instrução Normativa nº 11, de 20 de outubro de 2000 do Ministério da Agricultura, Pecuária e Abastecimento, para garantir a qualidade do mel que seja ao consumidor (BRASIL, 2000). De acordo com dados descritos pela Pesquisa da Pecuária Municipal – PPM no ano de 2020, divulgado pelo Instituto Brasileiro de Geografia e Estatística – IBGE, a produção de mel no Rio Grande do Norte teve um aumento 25% em relação a 2019, apresentando-se como a 4° maior produção do Nordeste. No referido ano, das 598 toneladas produzidas, Apodi destaca-se entre as demais cidades potiguares tendo como produção 151 toneladas de mel (IBGE, 2021). O mel é composto majoritariamente por açúcares (glicose e frutose), contudo possui diversos outros compostos que torna o mel uma matriz complexa. Além disso, a composição do mel depende de diversos fatores como: espécie da abelha, da origem botânica e geográfica, condições climáticas e estado de maturação (MENEZES et al., 2018; ESCUDERO et al., 2019; ALVES et al, p. 18609, 2020). Dentre os compostos presentes no mel podemos destacar os compostos antioxidantes, que contribuem de forma positiva para os seres humanos a fim de reduzir radicais livres, atuando com uma ampla ação benéfica, tais como: ação antimicrobiana, antiviral, antiparasitária, anti-inflamatória, antineoplásica, antiúlcera, antitumoral, imunossupressora e controle de doenças cardiovasculares (JIBRIL; HILMI; MANIVANNAN, 2019). A quantidade de antioxidantes presentes no mel varia principalmente de acordo com a florada majoritária. Além disso, esse fator está associado com o sabor (doce, amargo ou ácido), com a cor (âmbar claro até escuro) de forma que geralmente, os méis mais escuros tendem apresentar maiores teores de antioxidantes do que os mais claros (WIESE, 2000; JIBRIL; HILMI; MANIVANNAN, 2019). Dentre as metodologias especificas para análise desses compostos antioxidantes existem os ensaios para determinação da capacidade antioxidante total. Dessa maneira, alguns estudos têm sido desenvolvidos, para determinação da capacidade antioxidante em méis, como o método DPPH (2,2-difenil-1-picrilahidrazila), ABTS (ácido 2,2'-azinobis-3-etilbenzotiazolina-6-sulfónico), ORAC (do inglês, Oxygen Radical Absorbance Capacity) e FRAP (do inglês, Ferric Reducing Antioxidant Capacity) (GÜL; PEHLIVAN; SAUDI, 2018; KULKARNI et al., 2021; KUŚ et al., 2014; LARSEN; AHMED, 2022; OLATE-OLAVE et al., 2021; SMETANSKA; ALHARTHI; SELIM, 2021). Nessa perspectiva, o presente estudo teve como objetivo, determinar a capacidade antioxidante pelo método FRAP correlacionando com a coloração de dois méis de Abelhas africanizadas (Apis mellifera) de diferentes floradas, sendo um multifloral (cabeça de velho e velame) e outro monofloral (velame) produzidos no semi-arido brasileiro.
Material e métodos
As amostras utilizadas no experimento foram coletadas no município de Apodi e Umarizal no estado do Rio Grande do Norte. As análises de cor foram realizadas no laboratório de pós-colheita do Centro de Engenharia na Universidade Federal Rural do Semi-Árido (UFERSA), localizado em Mossoró/RN. Já as análises de capacidade antioxidante ocorreram no laboratório de águas da Universidade Federal do Espírito Santo (UFES), localizado em Vitória/ES. As duas amostras de méis identificadas pelos produtores como amostra 1, florada silvestre ou multifloral, com predominância de cabeça de velho (Euphorbia- leucocephala) e amostra 2, mel multifloral ou silvestre com predominância de velame (Croton heliotropiifolius) coletados no município de Umarizal, no estado do Rio Grande do Norte. 2.1 Análises 2.1.1 Cor A cor das amostras de mel foi determinada pelas análises de faixas de cores que relacionam o espectro de infravermelho e ultravioleta, a partir de um colorímetro (Konica Minolta CR-10). O colorímetro foi calibrado em uma superfície de porcelana branca iluminada. 2.1.2 Capacidade antioxidante total: ensaio FRAP O reagente FRAP foi preparado no momento da análise conforme a metodologia descrita por Benzie e Strain (1996). Posteriormente a solução de reagente FRAP foi aquecida a 37 °C para a formação do complexo FeIII-TPTZ. A solução de FeSO4.7H2O foi preparada na concentração de 1,0 × 10−3 mol L−1. A partir desta solução foi realizada a diluição para mais cinco concentrações diferentes (0,20; 0,40; 0,60; 0,80 e 1,0 × 10−3 mol L−1). Para construção da curva de calibração foi adicionada uma alíquota de 60 µL para cada concentração, juntamente com 1800 µL do reagente FRAP e 180 µL de água ultrapura. Em seguida, foi coletada a absorbância de cada ponto em 595 nm. Para a reação com a amostra foram acrescentados 60 µL das soluções de mel (0,20 g mL−1 em H2SO4 0,50 mol L−1) de diferentes floradas, 1800 µL do reagente FRAP e 180 µL de água ultrapura, totalizando uma diluição de 1:34 reagindo por 4 minutos a 37 °C. A intensidade da mudança de coloração foi medida a partir da absorbância em 595 nm, contra um branco contendo apenas a solução de H2SO4 0,50 mol L−1, reagente FRAP e água ultrapura. Os resultados da capacidade antioxidante nas amostras de mel foram expressos em mol FeII kg−1 de mel usando a curva de calibração.
Resultado e discussão
3.1 Cor
Avaliando a coloração dos méis, pelo instrumento Minolta, verifica-se que o mel
multifloral de cabeça de velho e o silvestre (predominio de velame) apresentaram
os seguintes valores médios de coloração: luminosidade (L) = 45,56;
cromaticidade (c*) = 36,33 e ângulo hue (̊ h) = 79,80; a = +6,33 e b = +35,7. Já
para o mel silvestre (predominio de velame) as leituras foram as seguintes: L =
45,06; c = 39,96; °h = 75,96; a = +9,66 e b = +38,76.
Observa-se pela luminosidade, que o mel silvestre, com predominio de velame,
apresentou valores menores indicando ser mais escura, já o mel multifloral
apresentou maior luminosidade sendo mais claro. Além disso, o mel monofloral
ainda apresentou valores de parâmetros c e ângulo hue, que revelam maior
presença de pigmentação.
3.2 Capacidade antioxidante total: ensaio FRAP
A capacidade antioxidante total dos méis resultaram nos valores de 0,880 e 0,809
mmol Fe2+ kg-1 mel para os méis multifloral e silvestre, respectivamente.
Em alguns estudos a coloração e a capacidade antioxidante total se correlacionam
de forma positiva, de forma que méis escuros possuem uma maior capacidade
antioxitante total, contudo, ao analisar os dados detalhadamente é possível
notar que há exceções de méis que não seguem essa relação, isso se deve a
composição complexa dos méis, chegando a mais de 180 compostos já identificados
(GHELDOF; WANG; ENGESETH, 2002).
Além disso, alguns autores mostram que essa relação não é exata, como por
exemplo, no estudo de Arenhart e Fogaça (2015), foi identificado que os vinhos
mais escuros apresentavam baixa CAT. Portanto, essa relação para o vinho se
assemelha muito a do mel, uma vez que a sua cor sempre é vinculada a presença de
compostos antioxidantes.
O mel silvestre apresentou uma coloração mais escura, porém uma capacidade
antioxidante total menor não apresentando uma correlação positiva. Isso pode ter
sido resultado da interferência da florada de cabeça de velho que contribui com
compostos antioxidantes que provavelmente não possuem coloração característica
como compostos fenólicos e sim outros compostos que contribuem para antividade
antiradicalar como: enzimas, aminoácidos, proteínas, vitaminas e ácidos
orgânicos. (NASCIMENTO, 2013; SALGUEIRO, 2012). Em específico na planta de
cabeça de velho já foram identificados alguns flavonóides por exemplo,
baicaleína 6-glicosídeo e crisina 7-glicosídeo
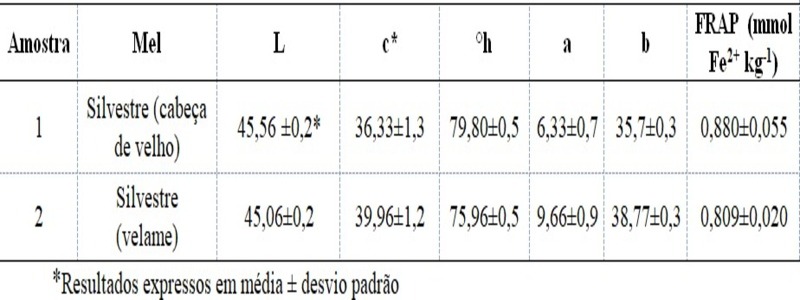
Tabela 1. Resultado obtido referente as análises de \r\ncoloração e capacidade antioxidante total para os \r\nméis.
Conclusões
Os aspectos de cor e capacidade antioxidante total dos méis de abelha de Apis multifloral e silvestre, tendo uma florada em comum apresentaram variações. Pela análise de cor a florada silvestre (predominio de velame) resultou em uma amostra um pouco mais escuro e com maior presença de pigmentos, quando comparada com a amostra multifloral em estudo. Os resultados de capacidade antioxidante total pelo método FRAP demonstraram que a florada de cabeça de velho presente no mel multifloral pode ser a responsável por um maior valor, devido a compostos específicos presentes nesta origem botânica. Em contra partida, esses compostos que foram cruciais para uma maior contribuição anti-radicalar possivelmente não possuem coloração característica, resultando em uma amostra com maior capacidade antioxidante total, contudo de cor clara.
Agradecimentos
A UFERSA e ao CNPQ pelo incentivo e financiamento à pesquisa.
Referências
ALVES, T. C. L. et al. Análise físico-química e microbiológica do mel de abelhas africanizadas (apis mellifera). Brazilian Journal of Development. Curitiba, v. 6, n. 4, p. 18607-18620, abril. 2020.
ARENHART, M.; FOGAÇA, A. de O. Influência da cor e dos compostos fenólicos sobre a capacidade antioxidante de vinhos tintos Gaúchos. Disciplinarum Scientia, Santa Maria, v. 16, n. 1, p. 113–123, 2015.
BENZIE, I. F. F.; STRAIN, J. J. The Ferric Reducing Ability of Plasma (FRAP) as a Measure of “Antioxidant Power”: The FRAP Assay. Analytical Biochemistry, v. 239, n. 1, p. 70–76, 1996.
BRASIL, Ministério da Agricultura, Pecuária e Abastecimento. Instrução Normativa 11, de 20 de outubro de 2000. Regulamento técnico de identidade e qualidade do mel.
CASTRO FILHO, M. N. de et al. Avaliação da qualidade de méis de abelha produzidos e comercializados em Vitória da Conquista, Bahia. Revista Verde de Agroecologia e Desenvolvimento Sustentável, [S.L.], v. 12, n. 4, p. 783-790, 1 out. 2017.
ESCUREDO, O. et al. Contribution to the Chromatic Characterization of Unifloral Honeys from Galicia (NW Spain). Foods, v. 8, n. 7, p. 233-249, 29 jun. 2019.
GHELDOF, N.; WANG, X. H.; ENGESETH, N. J. Identification and quantification of antioxidant components of honeys from various floral sources. Journal of Agricultural and Food Chemistry, v. 50, n. 21, p. 5870–5877, 2002.
GÜL, A.; PEHLIVAN, T. Antioxidant activities of some monofloral honey types produced across Turkey. Saudi Journal of Biological Sciences, v. 25, n. 6, p. 1056–1065, 2018.
IBGE – INSTITUTO BRASILEIRO DE GEOGRAFIA E ESTATÍSTICA. Pesquisa da Pecuária Municipal (PPM). Produção de origem animal, por tipo, 2020. Rio Grande do Norte: IBGE, 2021.
JIBRIL, F. I.; HILMI, A. B. M.; MANIVANNAN, L. Isolation and characterization of polyphenols in natural honey for the treatment of human diseases. Bulletin of the National Research Centre, v. 43, n. 4, p. 1–9, 2019.
KULKARNI, S. S.; MISHRA, S.; PATIL, S. B.; NAMBIAR, J.; MATH, A. Unifloral ajwain honey ameliorates differential inhibition of matrix metalloproteinases 2 and 9 protein, cytotoxicity, and antioxidant potential. Journal of Ayurveda and Integrative Medicine, v. 12, n. 4, p. 633–639, 2021.
KUŚ, P. M.; CONGIU, F.; TEPER, D.; SROKA, Z.; JERKOVIĆ, I.; TUBEROSO, C. I. G. Antioxidant activity, color characteristics, total phenol content and general HPLC fingerprints of six Polish unifloral honey types. LWT - Food Science and Technology, v. 55, n. 1, p. 124–130, 2014.
LARSEN, P.; AHMED, M. Evaluation of antioxidant potential of honey drops and honey lozenges. Food Chemistry Advances, v. 1, p. 100013, 2022.
MENEZES, B. A. D; MATTIETTO, R. A; LOURENÇO, L. F. H. Avaliação da Qualidade de Méis de Abelhas Africanizadas e Sem Ferrão Nativas do Nordeste do Estado do Pará. Ciência Animal Brasileira, [S.L.], v. 19, n. 0, p. 1-13, 3 set. 2018.
NASCIMENTO, D. M. D. Parâmetros de avaliação da qualidade do mel e percepção do risco pelo consumidor. (Dissertação Mestrado) – FCUP/ FCNAUP, 2013.
NUNES, E. M. L; SILVA, P. S. G. Reforma agrária, regimes alimentares e desenvolvimento rural: evidências a partir dos territórios rurais do Rio Grande do Norte. Revista de economia e sociologia rural. Brasília-DF, v. 61, n. 1. 2021.
OLATE-OLAVE, V. R.; GUZMÁN, L.; LÓPEZ-CORTÉS, X. A.; CORNEJO, R.; NACHTIGALL, F. M.; DOORN, M.; SANTOS, L. S.; BEJARANO, A. Comparison of Chilean honeys through MALDI-TOF-MS profiling and evaluation of their antioxidant and antibacterial potential. Annals of Agricultural Sciences, v. 66, n. 2, p. 152–161, 2021.
QIN, L.; DIXON, R. A.; MABRY, T. J. Additional flavonoids from elicitor-treated cell cultures of Cephalocereus senilis. Phytochemistry, v. 34, n. 1, p. 167–170, 1993.
SALGUEIRO, F. B. Caracterização de méis brasileiros: físico-química, perfil de substâncias polares, atividade antioxidante e quimiometria. 2012. - Universidade federal rural do Rio de Janeiro - Instituto de ciências exatas, Seropédica, Rio de Janeiro, 2012.
SMETANSKA, I.; ALHARTHI, S. S.; SELIM, K. A. Physicochemical, antioxidant capacity and color analysis of six honeys from different origin. Journal of King Saud University, v. 33, n. 5, p. 101447, 2021.
WIESE, H. Apicultura: Novos Tempos. 1. ed. Guaíba-RS:Editora Agropecuária LTDA.: [S.N], 2000.
















