ÁREA
Química Orgânica
Autores
Bigui, W.C.C. (UFES) ; Silva, A.F.B. (UFES) ; Peccini, L.R. (UFES) ; Oliveira, M.B. (UFES) ; Chaves, K.F. (UFES) ; Costa, A.V. (UFES) ; Tebaldi, V.T. (UFES)
RESUMO
Apesar de apresentarem ampla bioatividade, a baixa dispersibilidade em água de 1,2,3-triazóis pode limitar sua eficácia. Assim, objetivou-se avaliar a solubilidade do 1,2,3-triazol derivado do glicerol (T1) em água deionizada (AD), álcool etílico (AE) e acetonitrila (ACN), além do efeito do AE e da ACN no espectro de absorção. O T1 é insolúvel em AD e solúvel em AE e ACN. Os espectros de UV mostram uma banda de absorção em 221 nm e 220 nm para o AE e ACN respectivamente, indicando maior absorção do T1 em AE. As curvas de calibração indicaram que o AE possui uma maior absortividade molar e sensibilidade em análises espectrofotométricas. Espera-se que os resultados obtidos possam contribuir para o desenvolvimento de trabalhos futuros visando a melhoria da dispersibilidade do T1 em água.
Palavras Chaves
Espectroscopia no UV-Vis; N-heterocíclico; Click Chemistry
Introdução
Os triazóis são substâncias orgânicas -heterocíclicas, que contém três átomos de nitrogênio e dois átomos de carbono em sua estrutura (ZHANG, 2019). Os 1,2,3- triazóis são de origem sintética e podem ser preparados pela reação Click Chemistry proposta por Sharpless em 2002 (FREITAS et al., 2011; SHUANG et al., 2020). Os triazóis representam uma classe de substâncias químicas de grande interesse para as indústrias química e farmacêutica em função de apresentarem estabilidade térmica e diversificada atividade biológica (CAO et al., 2023). Entre as atividades, destacam-se o controle de fungos, bactérias e vírus que apresentam relevância para a agricultura e para a saúde humana (XU; ZHAO; LIU, 2019). Apesar das vantagens mencionadas, os compostos contendo anel triazólico possuem baixa dispersibilidade em água podendo comprometer a sua eficácia biológica (CARVALHO et al., 2023; LI; ZHANG, 2022). Uma forma de contornar essas limitações consiste no preparo e caracterização de complexos de inclusão (CIs) a partir do 1-((2,2-dimetil-1,3-dioxolan-4- il)metil)-4-octil-1H-1,2,3-triazol (T1). Alguns testes de caracterização realizados durante o desenvolvimento de CIs utilizam a técnica de espectroscopia no ultravioleta-visível (UV-Vis), entre eles, estudo de solubilidade de fase e determinação da estequiometria pelo método de Job Plot (SZABÓ et al., 2017; BARMAN; BARMAN; ROY, 2018). Sendo assim, objetivou-se com o presente trabalho avaliar a solubilidade do T1 em água deionizada, álcool etílico (AE) e acetonitrila (ACN) e o espectro de absorção do T1 em AE e ACN.
Material e métodos
Materiais: 1-((2,2-dimetil-1,3-dioxolan-4-il)metil)-4-octil-1H-1,2,3-triazol (T1) foi sintetizado por pesquisadores do Grupo de Estudos Aplicado em Produtos Naturais e Síntese Orgânica (GEAPS-UFES-CNPq) (MM = 295,42 g mol-1) (COSTA et al., 2020). O álcool etílico (AE) e acetonitrila (ACN) foram adquiridos comercialmente pela Sigma-Aldrich (lote 230552 e 226824, respectivamente). A água deionizada foi obtida no laboratório de Química 1 (UFES- Alegre). Teste de solubilidade: Uma quantidade fixa do T1 (1 mg) foi transferida para frascos flaconetes (15mL) contendo volumes conhecidos de água deionizada, AE ou ACN. Os frascos contendo T1 na presença dos diferentes solventes foram agitados em vórtex (5 min.) a temperatura ambiente (25±2 °C) e deixados em repouso (5 min.). Os frascos foram avaliados macroscópicamente, sendo o T1 considerado insolúvel no solvente em que se observou a presença de turbidez ou corpo de fundo nos frascos. Espectroscopia no ultravioleta-visível (UV-Vis): Os espectros de absorção e as curvas de calibração do T1 foram obtidas na região do UV (190 a 700 nm) utilizando espectrofotômetro (modelo Cary 50 Probe, marca Varian) a partir de soluções estoques preparadas em AE e ACN.
Resultado e discussão
O 1-((2,2-dimetil-1,3-dioxolan-4-il)metil)-4-octil-1H-1,2,3-triazol (T1) (Figura
1a) se mostrou insolúvel em água deionizada e solúvel em álcool etílico (AE)
(Figura 1b) e acetonitrila (ACN) (Figura 1c). Este comportamento pode estar
relacionado à característica apolar do T1 devido a presença do grupo 4-octil em
sua estrutura. Os espectros UV para o T1 em AE e ACN são mostrados na Figura 2A.
Os espectros exibem uma banda larga, com máximo de absorção em 221 nm e 220 nm
para o T1 dissolvido em AE e ACN, respectivamente. Os 1,2,3-triazol podem
apresentar dois tipos de transições eletrônicas na região do UV, n → π* (pares
de elétrons livres dos átomos de N e O) e π → π* (elétrons participantes da
ligação π). Segundo King et al. (2010) a presença de banda com máximo de
absorção, entre 190 e 240 nm, no espectro de absorção para derivados triazólicos
na região UV é referente à transição eletrônica do tipo π → π*.
Na Figura 2A observa-se a maior absorção do T1 em AE, evidenciando a sua maior
sensibilidade neste solvente quando comparado com a ACN. O T1 apresentou valor
de absortividade molar (????) de 3661,5 e 2418,5 L mol-1 cm-1 em AE e ACN,
respectivamente. Este comportamento foi descrito por ELSHERIF et al. (2014) que
observaram a influência do solvente nos valores de absorção máxima e,
consequentemente, a influência destes em valores de ???? para composto
heterocíclico.
Esses resultados também foram observados a partir da análise dos parâmetros
relacionados às curvas de calibração (Figura 2B). Na Figura 2B, a equação é
representada por: Abs = a.[T1] + b, onde Abs é a absorbância da solução e [T1] a
concentração (????M) do T1. O valor do coeficiente angular da equação referente
ao T1 em AE (a = 0,004) representa o dobro do valor deste em ACN (a = 0,002).
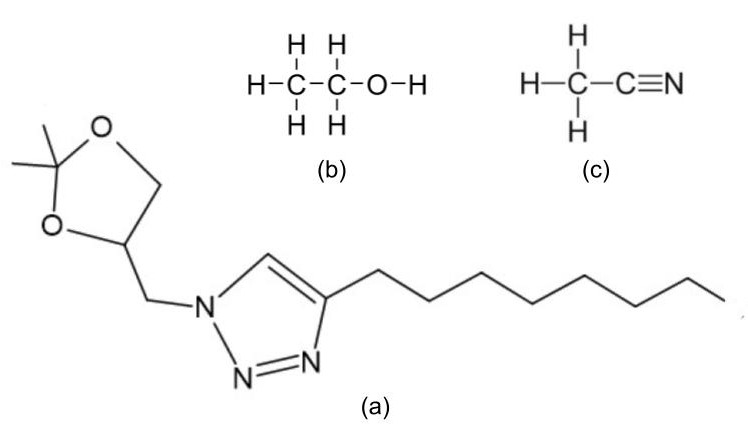
Fórmula estrutural do 1-((2,2-dimetil-1,3-dioxolan-\r\n4-il)metil)-4-octil-1H-1,2,3-triazol (T1) (a), \r\nálcool etílico (AE) (b) e acetonitrila (ACN) (c).
Espectros de absorção (A) e as curvas de calibração \r\n(B) na região do UV na presença do AE e da ACN do \r\nT1.
Conclusões
Os testes de solubilidade indicaram que o T1 é insolúvel em água deionizada e solúvel em AE e ACN. O espectro de absorção mostrou maior absorção do T1 em AE (221 nm) comparado com em ACN (220 nm). As curvas de calibração revelam que o T1 apresenta maior coeficiente angular para o AE em comparação com o ACN. Indicando que em AE, o T1 apresenta maior absortividade molar (????) e sensibilidade em análises espectrofotométricas. Espera-se que os resultados orientem futuras pesquisas na melhora da dispersibilidade do T1 em água e em testes que se faz necessário a utilização dos solventes, AE e ACN.
Agradecimentos
Os autores agradecem à FAPES e à CAPES, por todo apoio financeiro fornecido. Os autores agradecem também aos pesquisadores do PPGAQ e do GEAPS-UFES-CNPq pela orientação recebida.
Referências
BARMAN, S.; BARMAN, B. K.; ROY, M. N. Preparation, characterization and binding behaviors 35 of host-guest inclusion complexes of metoclopramide hydrochloride with α- and β-cyclodextrin molecules. Journal of Molecular Structure, v. 1155, n. 1, p. 503-512, 2018.
CAO, Y. et al. Synthesis and characterization of azido-functionalized 1,2,3-triazole and fused 1,2,3-triazole. The Journal of Organic Chemistry, v. 88, n. 1, p. 4301-4308, 2023.
CARVALHO, L. B. et al. Heterocyclic agrochemical hosted by cyclodextrin and hybrid cyclodextrin-silica materials: Characterization, release behavior, and mobility in soil. Colloids and Surfaces A: Physicochemical and Engineering Aspects, v. 656, n. 2, p. 1-11, 2023.
COSTA, A. V. et al. Synthesis of glycerol-derived 4-alkyl-substituted 1,2,3-triazoles and evaluation of their fungicidal, phytotoxic, and antiproliferative activities. Journal of the Brazilian Chemical Society, v. 31, n. 1, p. 821-832, 2020.
ELSHERIF, K. M. et al. Absorption spectral studies on naphthyl pyridyl pyrazole (NPP) in mixed solvent systems. Chemical Science Transaction, v. 3, n. 3, p. 1221-1227, 2014.
FREITAS, L. B. O. et al. A reação "click" na síntese de 1,2,3-triazóis: Aspectos químicos e aplicações. Química Nova, v. 34, n. 1, p. 1791-1804, 2011.
KING, G. A. et al. Exploring the mechanisms of H atom loss in simple azoles: Ultraviolet photolysis of pyrazole and triazole. The Journal of Chemical Physics, v. 132, n. 2, p. 1-14, 2010.
LI, J.; ZHANG, J. The antibacterial activity of 1,2,3-triazole- and 1,2,4-triazole-containing hybrids against staphylococcus aureus: An updated review (2020- Present). Current Topics in Medicinal Chemistry, v. 22, n. 1, p. 41-63, 2022.
SHUANG, Y. et al. Preparation and evaluation of a triazole‐bridgedbis(β‐cyclodextrin)–bonded chiral stationary phase for HPLC. Chirality, v. 32, n. 2, p. 168-184, 2020.
SZABÓ, Z. et al. Cyclodextrin complexation improves aqueous solubility of the antiepileptic drug, rufinamide: solution and solid state characterization of compound-cyclodextrin binary systems. Journal of Inclusion Phenomena and Macrocyclic Chemistry, v. 88, n. 1, p. 43-52, 2017.
XU, Z.; ZHAO, S.; LIU, Y. 1,2,3-Triazole-containing hybrids as potential anticancer agents: Current developments, action mechanisms and structure-activity relationships. European Journal of Medicinal Chemistry, v. 183, n. 1, p. 1-37, 2019.
ZHANG, B. Comprehensive review on the anti-bacterial activity of 1,2,3-triazole hybrids. European Journal of Medicinal Chemistry, v. 168, n. 2, p. 357-372, 2019.