ÁREA
Química Orgânica
Autores
Freitas Filho, J.R. (UFRPE) ; Frfitas, J.J.R. (UFRPE) ; Souza Neto, P.R. (UFRPE) ; da Silva, A.R.F. (UFRPE) ; Oliveira, R.N. (UFRPE)
RESUMO
A síntese de (R e S)-1-[3-(aril)-1,2,4-oxadiazol-5-il]-etil-2,3- didesoxi-α-D-eritro-hex-2-enopiranosídeos foi realizada a partir do 3,4,6- tri-O-acetil-D-glical e diferentes (R e S)-1-[3-aril- 1,2,4-oxadiazol-5-il]-etanol. Essa reação forneceu uma mistura diastereoisomérica das substâncias 5a–e e 6a–e. A hidrólise básica de 5a–e e 6a–e forneceu as substâncias 7a–e e 8a–e, que foram separados cuidadosamente em uma coluna de sílica gel produzindo todos os diastereoisômeros na forma pura. A determinação da configuração absoluta das substâncias 7a–e e 8a–e foi estabelecida comparando os dados de Rf e valores da rotação específica com as substâncias padrões enantiomericamentes puras.
Palavras Chaves
1,2,4-oxadiazol; Glicosídeos; Configuração absoluta
Introdução
Os carboidratos, um grupo de biomoléculas proeminentes de recursos renováveis que possuem grande diversidade estrutural, são componentes cruciais na interface da química e da biologia (Lepenies,Yin e Seeberger, p. 404, 2010).Por outro lado, os derivados de 1,2,4-oxadiazol manifestam uma ampla gama de atividades farmacológicas (Biernacki et al., p. 111, 2020; Salahuddin et al., 1805, 2017) incluindo propriedade anti-inflamatória (Gita, 1536, 2018). Vários 4,5-di-hidro- 1,2,4-oxadiazóis (Δ2-1,2,4-oxadiazolinas) demonstraram possuir atividade anti- HIV (Kushwah et al., p. 116612, 2022). Essas duas áreas principais atraíram grande interesse dos químicos sintéticos pela possibilidade de obtenção de substâncias biologicamente ativos. Uma área de pesquisa em química de carboidratos tem sido centrada na necessidade de induzir a formação de ligações glicosídicas para os mimetizadores de glicoconjugados (Wang et al., p.756724, 2021). Uma diversidade de estruturas de carboidratos é conjugada com porções heterocíclicas, por exemplo, através da parte aglicona que promove a formação de pequenas moléculas que mostram alguma atividade biológica. Para atividade citotóxica, a literatura descreve alguns exemplos baseados em carboidratos (Silva et al., p. 251, 2020). Atualmente, existem poucos artigos na literatura que mostram unidades de 1,2,4-oxadiazol ligadas por meio de uma ligação O-glicosídica a um carboidrato. Em 2021, foi relatado que há um aumento na solubilidade do 1,2,4-oxadiazol quando ele está ligado a uma porção de carboidrato, portanto, a droga agirá de forma mais eficaz (de Oliveira et al.,p. 113472, 2021). Portanto, no presente estudo, realizou-se a síntese, separação e determinação da configuração de (S)-1-[3-(aril)-1,2,4-oxadiazol-5-il]- etil-2,3-didesoxi-α-D-eritro-hex-2-enopiranosídeos com base no fator de retenção e rotação específica.
Material e métodos
Nas reações utilizamos reagentes e solventes na sua forma comercial, P.A. O acompanhamento das reações foi feito através de cromatografia em camada delgada (ccd), em um sistema CH2Cl2/AcOEt (9:1). Para visualização das substâncias usamos lâmpada de ultravioleta e/ou cuba contendo vapores de iodo. Para cromatografia em coluna utilizamos sílica-gel 60 (Merck, 70–230 mesh). Os espectros de RMN 1H e 13C foram obtidos em espectrofotômero VARIAN modelo Unity Plus (300 MHz e 75 MHz respectivamente), usando CDCl3 como solvente e tetrametilsilano como padrão interno. Espectros de infravermelho (IV) foram obtidos em espectrofotômetro de IV com Transformada de Fourier no instrumento BRUKER Modelo IFS 66. Inicialmente realizou-se a preparação dos álcoois 3-aril-5-(1-hidroxietil)-1,2,4-oxadiazóis,a partir do lactato de metila e diferentes arilamidoximas (Ar= fenil, m toluil e p-cloro) segundo metodologia descrita na literatura (Srivastava et al., p. 6195, 2007). Em seguida, realizou-se a reação de glicosidação e posteriormente a hidrólise básica utilizando um sistema MeOH:H2O:Et3N na proporção de 9:6:1.
Resultado e discussão
Inicialmente preparou-se os 1,2,4-oxadiazóis, como material de partida, de
acordo com a literatura (Srivastava et al., p. 6195, 2007). Conforme mostrado na
Figura 1, (R,S) e (S)-1-[3-aril-1,2, 4-oxadiazol-5-il]-etanol (3a-
e) foram preparados através da reação de arilamidoximas e (R,S) e
(S) lactato de etila na presença de carbonato de potássio. Com relação
aos espectros de RMN 1H, um dupleto foi observado em cerca de 1,69
ppm com constante de acoplamento J2'1'= 6,9 Hz, relacionado ao
terminal de sinal de metil (H-2') da cadeia lateral envolvendo H-1'. O
hidrogênio em H-1' aparece como um quarteto da região de 5,09 a 5,16 ppm com
constante de acoplamento J1'2' = 6,9 Hz. A síntese das substâncias
(R,S) ou (S)-1-[3-(aril)-1,2,4-oxadiazol-5-il]-etil-2,3-didesoxi-
α-D-eritro-hex-2-enopiranosídeos é descrito na Figura 2. A reação da
mistura racêmica 3a-e com tri-O-acetil-D-
glical na presença de montmorilonita K-10 (Toshima et al., p.306, 1995) forneceu
uma mistura de diastereoisômeros mostrando uma mancha na placa de TLC com valor
de Rf de 0,78 correspondente a 5a-e, e a outra com valor de Rf de 0,52 e
portanto correspondente a 6a-e. A separação das substâncias acetiladas 5a–e e
6a–e não foi possível devido ao Rf muito próximo. Logo foi realizada uma reação
de desacetilação de 1,2,4-oxadiazolil 4,6-O-acetil-2,3-didesoxi-α-
D-eritro-hex-2-
enopiranosídeos (5a–e e 6a-e) usando metanol–água–trietilamina (9:6:1) (Ferrier
e Prasad, 1969; Santos et al., p. 192, 2017), que forneceu as substâncias 7a-e e
8a-e em bons rendimentos (Figura 2). Com manuseio cuidadoso, essas duas
substâncias foram separados e suas rotações específicas e dados espectroscópicos
foram obtidos. Por outro lado, a reação de 4a-e opticamente puro com tri-O
-acetil-D-glical na presença de montmorilonita K-10
deu uma única substância 6a-e com rendimento variando de 75-78% e alta
estereoseletividade em favor do anômero α. Em seguida, as substâncias 6a-e foram
submetidos a uma reação de desacetilação para fornecer os dióis 8a-e com a
configuração S, Rf variando de 0,12-0,15 em TLC em um sistema 8 : 2
diclorometano-EtOAc. A determinação da configuração das substâncias foi
estabelecida comparando-se os dados de Rf e rotação específicas dos
diasterisosômeros isolados com o Rf e rotação específicas das substâncias
enantiomericamente puro (S)-1-[3-(aril)-1,2,4-oxadiazol-5- il]-etil-2,3-
didesoxi-α-D-eritro-hex-2-enopiranosídeos obtidos pela reação do tri-
O-acetil-D-glical com álcoois (S)-1-[3-aril-1,2,4-
oxadiazol-5-il]-etanol. A Tabela 1 resume os dados do ponto de fusão, rotações
específicas e Rf das substâncias 7a-c e 8a-c.
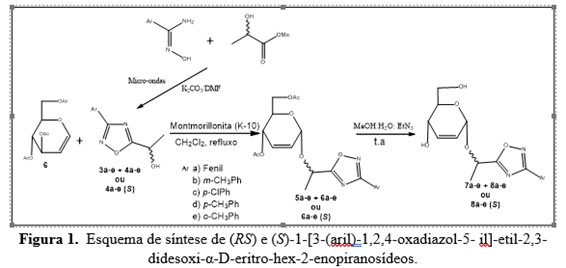
Esquema de síntese de (RS) e (S)-1-[3-(aril)-1,2,4-\r\noxadiazol-5- il]-etil-2,3-didesoxi-α-D-eritro-hex-2-\r\nenopiranosídeos.
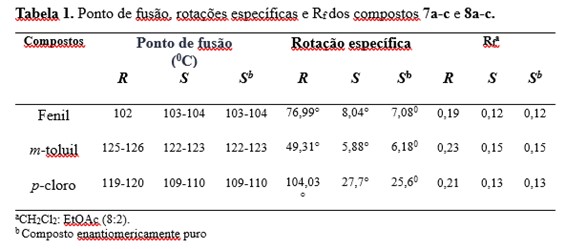
Tabela 1. Ponto de fusão, rotações específicas e Rf \r\ndos compostos 7a-c e 8a-c.
Conclusões
Os O-glicosídeos 2,3-insaturados foram sintetizados, através do rearranjo de Ferrier do tri-O-acetil-D-glical com diferentes 1,2,4-ozaxiazóis o [(R,S)-3-aril-5-(1-hidroxietil)-1,2,4-oxadiazóis (3a-e) e o (S)-3 aril-5-(1-hidroxi-etil)-1,2,4-oxadiazóis (4a-e)]. Os glicosídeos 2,3-insaturados foram obtidos em bons rendimentos (86-91%), submetidos posteriormente a uma reação de hidrólise básica para obtenção dos diastereisômeros 7a-e e 8a-e, os quais foram separados por cromatografia. A configuração absoluta de 7a-c e 8a-c foi estabelecida quando comparada a rotação específica e o fator de retenção de (R,S)-1-[3-(aril)-1,2,4-oxadiazol-5-il]-etil 2,3-didesoxi-a-D eritro-hex-2-enopiranosídeo com os isômeros puros (S)-1-[3-(aril)-1,2,4- oxadiazol-5-il]-etil 2,3-didesoxi-a-D-eritro-hex-2-enopiranosídeo 8a-c.
Agradecimentos
Os autores do trabalho agradecem ao FACEPE, CAPES E CNPQ, pelo apoio financeiro.
Referências
1. Lepenies, B., Yin, J., Seeberger, P.H., Applications of synthetic carbohydrates to chemical biology, Current Opinion in Chemical Biology,14, 3, 404-411, 2010.
2. Biernacki K, Daśko M, Ciupak O, Kubiński K, Rachon J, Demkowicz S. Novel 1,2,4-Oxadiazole Derivatives in Drug Discovery. Pharmaceuticals (Basel). 29;13(6):111, 2020.
3. Salahuddin, Mazumder A., Yar M.S., Mazumder R., Chakraborthy G.S., Ahsan M.J., Rahman M.U. Updates on synthesis and biological activities of 1,3,4-oxadiazole: A review. Synth. Commun. 47:1805–1847, 2017.
4. Gita, C. 1,2,4-Oxadiazole as a Privileged Scaffold for Anti-inflammatory and Analgesic Activities: A Review, Mini-Reviews in Medicinal Chemistry. 18(18), 1536-1547, 2018.
5. Kushwaha, P. K, Srivastava K S., Kumari, N., Kumar, R., Mitra, D, Sharon, A. Synthesis and anti-HIV activity of a new isoxazole containing disubstituted 1,2,4-oxadiazoles analogs. Bioorg Med Chem. 15;56:116612, 2022..
6. Wang, J., Zhang, Y., Lu, Q., Xing, D., Zhang, R. Exploring Carbohydrates for Therapeutics: A Review on Future Directions. Front. Pharmacol. 12:756724, 2021.
7. Silva, E. E da, Barbosa, M. V. de S, Freitas, J. R., Freitas Filho, J. R. de., Freitas, J. J. R. de. Synthesis, characterization, and evaluation of toxicity against saline artemia of 2,3-unsaturated glycosides. Periodico Tche Quimica (Online), 17(36), 251-262, 2020.
8. de Oliveira, V. N. M., Moura, C. F. A., Peixoto, A. S., Ferreira, V. P. G., Araújo, H. A., Pimentel, L. M. L. M., Pessoa, C. C., Nicolete, R., dos Anjos, J. V.; Sharma, S. P., Rathi, B., Pena, L. P., Rollin, P., Tatibouët, A., de Oliveira, R. N. Synthesis of alkynylated 1,2,4-oxadiazole/1,2,3-1H-triazole glycoconjugates: Discovering new compounds for use in chemotherapy against lung carcinoma and Mycobacterium tuberculosis, European Journal of Medicinal Chemistry, 220, 113472, 2021.
9. Freitas, J. J. R.; Freitas, J. C. R.; De Freitas, L. P. S.; Freitas Filho, J. R.; Kimura, G. Y. V. E Srivastava, R. M. Microwave-induced one-pot synthesis of 4-[3- (aryl)-1,2,4-oxadiazol-5-yl]-butan-2-ones under solvent free conditions, Tetrahedron Lett., 48, 6195–6198, 2007.
10. Toshima, K.; Ishizuka, T.; Matsuo, G.; Nakata, M. Practical Glycosidation Method of Glycals Using Montmorillonite K-10 as an Environmentally Acceptable and Inexpensive Industrial Catalyst. Synlett., 4, 306, 1995.
11. Ferrier, R. J.; Prasad, N. Synthesis of 2,3-Dideoxy-α-D-Erythro-Hex-2-Enopyranosides from Tri-O-Acetyl-D-Glucal. J. Chem. Soc. C-Org. 570, 1969.
12. Santos, J. A. M., Santos, C. S., Almeida, C. L. A., Silva, T. D. S., Freitas Filho, J. R., Militão, G. C. G., da Silva, T. G., da Cruz, C. H. B., Freitas, J. C. R., Menezes, P. H. Structure-based design, synthesis and antitumoral evaluation of enulosides. European Journal of Medicinal Chemistry, 128, 192-201, 2017.
















