Autores
de Freitas Gomes, N. (UFSCAR) ; Lopes Junior, M.L. (UFPA) ; Cantanhede Filho, A.J. (IFMA) ; Silva Santos, L. (UFPA) ; Nascimento Silva, L.C. (UNICEUMA) ; Rodrigues-filho, E. (UFSCAR)
Resumo
Os extratos do fungo endofítico Glomerella cingulata cultivados em arroz
parboilizado foram fracionados por procedimentos cromatográficos clássicos e
HPLC
em escala preparativa. Os extratos brutos, as frações e as substâncias isoladas
foram testadas contra diversas bactérias. As substâncias isoladas foram
elucidadas
estruturalmente por meio de análise espectroscópica, principalmente 1H e 13C
NMR e
HRMS, permitindo identificar a pestalotina-1 (1) e duas ftalidas (3R*,8S*)-5,7-
dihidroxi-3-(1-hidroxietil)-ftalida (2) e (3R*,8R*)- 5,7-di-hidroxi-3-(1-
hidroxietil)-ftalida (3). A lactona 2 apresentou alguma atividade contra
linhagens
de E. coli e Enterococcus faecalis enquanto 3 e pestalotina-1 foram inativos.
Palavras chaves
Fundo Endofítico; Extrato Etanólico; Atividade Antibacteriana
Introdução
Os microrganismos endofíticos geralmente produzem substâncias com diversas
atividades biológicas e funcionalidades farmacológicas (LANDAU, ACHILLADELIS,
SCRIABINE, 2013; PALANICAMY et al, 2018; KHARWAR et al. 2011). A busca por
essas substâncias é de particular interesse em espécies fúngicas, pois são
fontes férteis de produtos bioativos naturais (USHA et al. 2018; IBRAR et al.
2020; CHÁVEZ et al. 2015). Pertencente à classe Ascomycetes, o gênero
Glomerella possui diversas espécies de fungos, como G. acutata, G. salicis e G.
cingulata. Em seu estágio assexuado, esses fungos são conhecidos como
Colletotrichum. Eles causam antracnose em plantas (CANNON et al. 2012; ROGERIO
et al. 2017) e podem atuar como agentes de controle biológico (MANAMGODA et al.
2013; JAYAWARDENA et al. 2016; ASKEW et al. 2011). Além disso, essas espécies
de fungos apresentam uma fase endofítica caracterizada por uma associação
mutualística com plantas. Em geral, os microrganismos endofíticos apresentam
aplicações biotecnológicas e medicinais promissoras (FIRÁKOVÁ, ŠTURDÍKOVÁ,
MÚČKOVÁ, 2007; STROBEL, 2003). Na literatura, há relatos mostrando diferentes
metabólitos produzidos por G. cingulata, como os terpenóides (MIYAZAWA et al.
2020), em particular os sesquiterpenos glomeremofílicos (A-D), usados para
controlar doenças neurológicas, como Alzheimer e Parkinson (LIU et al. 2017).
Apesar da quantidade relativamente grande de conhecimento sobre a química de G.
cingulata, não é totalmente compreendida a ligação entre suas diferentes
classes de metabólitos secundários com as atividades biológicas. Estudos
realizados por um grupo indiano mostraram que extratos de uma cepa de G.
cingulata não apresentavam atividade antibacteriana contra bactérias gram
positivas e gram negativas em qualquer concentração (K. HARA KISHORE et al.
2007), embora apresentassem boas atividades antifúngicas. Neste manuscrito
relatamos a produção, isolamento e identificação estrutural da -lactona
pestalotina (1) e um par de -lactonas diastereoisoméricas (2 e 3) de extratos
de G. cingulata cultivados em arroz e a verificação de da sua atividade
antibacteriana.
Material e métodos
O fungo foi cultivado em meio sólido utilizando 3 kg de arroz parboilizado,
dividido em trinta erlenmeyers (500 mL) contendo 85 mL de água destilada. Este
meio foi autoclavado duas vezes por 15 minutos a 121°C e 1 atm com intervalo de
24 horas. O inóculo foi realizado adicionando três fatias circulares de 5 mm de
diâmetro de BDA contendo micélio. A biomassa foi extraída após trinta dias de
cultivo com 150 mL de álcool etílico 99,5% e levada ao banho de ultrassom. A
solução foi filtrada e depois evaporada sob pressão reduzida, originando o
extrato etanólico (70 g). Este extrato foi cromatografado em sílica gel sob
vácuo, utilizando fases móveis compostas por hexano (Hex), acetato de etila
(AcoEt) e metanol (MeOH) em modo gradiente de polaridade, para obter frações de
FHA-A (Hex:EtOAc - 90:10, 10, 3 mg ), FHA-B (Hex:EtOAc - 70:30, 2,01 g) e FA-C
(EtOAc - 100%, 751,3 mg); e acetato de etila com metanol (MeOH) para obter FAM-
D
(EtOAc: MeOH - 90:10, 412,5 mg), FAM-E (EtOAc: MeOH - 70:30, 3,6 g) e FM-F
(100%
MeOH, 9,18g). A fração FA-C foi cromatografada e eluída com um sistema eluente
composto por Hex:EtOAc em modo gradiente, a partir do qual foi possível obter a
subfração FA-C-3 (Hex:EtOAc - 1:1, 140,2 mg). Esta amostra foi purificada por
HPLC preparativo usando uma coluna de fase reversa (Fenilhexil, 10µm, 250 x
21,20mm) e detector de arranjo de diodos (DAD). A fase móvel composta por água
deionizada (A) e acetonitrila (B) foi utilizada na eluição em gradiente,
variando de 20 a 80% B em 45 min, permanecendo constante em 100% B por 25 min.
Os compostos foram detectados a 210 e 271 nm.
A atividade antibacteriana foi avaliada pela determinação das concentrações
inibitórias mínimas (CIM) por meio do ensaio de microdiluição contra cepas de
Listeria monocytogenes, Salmonella enterica, Enterococcus faecalis, Klebsiella
pneumoniae, Staphylococcus aureus e Escherichia coli. As frações e compostos 1,
2 e 3 foram dissolvidos em dimetilsulfóxido (DMSO) para atingir uma
concentração
de 10.000 g.mL-1. Cada solução foi diluída em série em uma placa de 96 poços
contendo meio Mueller-Hinton (MH) para obter um gradiente de concentrações
variando de 2500 g.mL-1 a 4,98 g.mL-1. A suspensão de ciprofloxacina (50
g.mL-1) foi usada como controle positivo. O inóculo bacteriano foi preparado
em
tubos de vidro autoclavados com tampa de rosca contendo 3 mL de solução salina
tamponada com fosfato (PBS) estéril, a 1,5 × 108 UFC.mL-1, com turbidez
equivalente a 0,5 no McFarland. Posteriormente, os poços receberam 10 L de uma
suspensão microbiana. Após 24h de incubação a 37ºC, o crescimento bacteriano
foi
verificado com 30 μL de solução de resazurina sódica a 0,03%. A CIM foi
definida
como a menor concentração capaz de inibir o crescimento bacteriano, observada
pela mudança de cor de azul para rosa.
Resultado e discussão
Da fração FA-C-3, foi possível isolar 35 mg de 1. Outras frações da eluição de
acetato de etila 100% também foram submetidas à separação por HPLC em escala
preparativa em condição semelhante à descrita acima para 1, levando ao
isolamento
das substâncias 2 (12,0 mg) e 3 (70,0 mg).
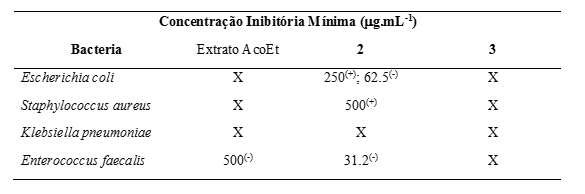
Os resultados de atividade antibacteriana mostraram que as frações FHA-A, FHA-B
e
FA-C apresentaram a menor concentração inibitória correspondendo ao valor 625,0
μg.mL-1. As soluções de FHA-A e FHA-B inibiram a E. coli, enquanto FA-C foi
ativa
contra S. aureus. As demais frações testadas apresentaram alta CIM (1250 μg.mL-
1 e
2500 μg.mL-1) para todas as bactérias testadas. O extrato de acetato de etila,
em
especial a solução com 500,0 μg.mL-1, apresentou atividade bacteriostática
contra
a cepa de E. faecalis. O composto 2 apresentou atividade bactericida contra E.
coli (250,0 μg.mL-1) e S. aureus (500,0 μg.mL-1), bem como atividade
bacteriostática contra E. coli (62,5 μg.mL-1) e E. faecalis (31,2 μg.mL-1). O
composto 3 não apresentou atividade inibitória sobre os patógenos testados. Em
contraste com os resultados descritos pelo grupo K. Harakishore [16], onde
nenhuma
atividade antibacteriana foi demonstrada por qualquer concentração de extrato
bruto de G. cingulata, observamos uma atividade antibacteriana não desprezível
apresentada pelos extratos de biomassa fúngica da G. cingulata quando cultivada
em
arroz.

Conclusões
Os resultados obtidos permitiram identificar três substâncias, denotadas por 1, 2
e 3, que não são usualmente encontradas no fungo endofítico G. cingulata. Essas
substâncias são classificadas como pentacetídeos e apresentam uma pequena
diferença em seus esqueletos estruturais. Em relação à atividade antibacteriana,
as frações do extrato etanólico FHA-A, FHA-B e FA-C apresentaram a menor
concentração inibitória correspondente a 625,0 g.mL-1. Por outro lado, o extrato
de acetato de etila apresentou atividade bacteriostática contra a cepa de E.
faecalis. Em particular, a substância 2 apresentou tanto atividade bactericida
(contra E. coli e S. aureus) quanto bacteriostática (contra E. coli e E.
faecalis). Estes resultados que mais estudos são necessários para aprofundar o
conhecimento sobre as substâncias produzidas por G. cingulata e seus diferentes
mecanismos de ação, que podem ajudar como uma alternativa para o controle de
patógenos.
Agradecimentos
FAPEMA, CNPq, CAPES, IFMA, UFSCar, UFPA, UNICEUMA, LaBioMMi.
Referências
ASKEW, S. E., SHAMOUN, S. F., VAN DER KAMP, B. J. Assessment of Colletotrichum gloeosporioides as a biological control agent for management of hemlock dwarf mistletoe (Arceuthobium tsugense). Forest Pathology, v. 41, p. 444–452, 2011
CANNON, P. F., DAMM, U., JOHNSTON, P. R., WEIR, B.S. Colletotrichum current status and future directions. Studies in Mycology v. 73, p. 181–213, 2012
CHÁVEZ, R., FIERRO, F., GARCÍA-RICO, R. O., VACA, I. Filamentous fungi from extreme environments as a promising source of novel bioactive secondary metabolites. Frontiers in Microbiology, vol. 6, 2015
FIRÁKOVÁ, S., ŠTURDÍKOVÁ, M., MÚČKOVÁ, M. Bioactive secondary metabolites produced by microorganisms associated with plants. p. 251-257, 2007
IBRAR, M., ULLAH, M. W., MANAN, S., FAROOQ, U., RAFIQ, M., HASAN, F. Fungi from the extremes of life: an untapped treasure for bioactive compounds. Applied Microbiology and Biotechnology v. 104, p. 2777–2801, 2020
JAYAWARDENA, R. S., LI, X. H., LIU, M., ZHANG, W., YAN, J. Y. Mycosphere Essay 16: Colletotrichum: Biological control, bio-catalyst, secondary metabolites and toxins. Mycosphere, p. 1164 – 1176, 2016
KHARWAR, R. V., MISHRA, A., GOND, S. K., STIERLE, A., STIERLE, D. Anticancer compounds derived from fungal endophytes: their importance and future challenges. Nature Product Reports. v. 28, p. 1208-1228, 2011
K. HARA KISHORE, SUNIL MISRA, D. RAMESH CHANDRA, K.V.V. R. PRAKASH; U. SURYANARAYANA MURTY. Antimicrobial efficacy of secondary metabolites from Glomerella cingulata. Brazilian Journal of Microbiology, v. 38, p.150-152, 2007
LANDAU, R., ACHILLADELIS, B., SCRIABINE, A. Pharmaceutical innovation: revolutionizing human health - Discovery and development of major drugs currently in use. Biochimica em Biophysica Acta (BBA) – General Subjects. v. 1830, p. 3670-3695, 2013.
LIU, Y.; LI, Y.; LIU, Z.; LI, L.; QU, J.; MA, S.; CHEN, R.; DAI, J.; YU, S. Sesquiterpenos from the endophyte Glomerella cingulata. Journal Natural Products, v. 80, p. 2609-2614, 2017
MANAMGODA, D. S, UDAYANGA, D., CAI, L., CHUKEATIROTE, E., HYDE, K. D. Endophytic Colletotrichum from tropical grasses with a new species C. endophytica. Fungal Diversity v. 61, p. 107–115, 2013
MIYAZAWA, M.; KIMURA, M.; YABE, Y.; TSUKAMOTO, D.; SAKAMOTO, M.; HORIBE, I.; OKUNO, Y. Use of solid phase microextraction (SPME) for Proling the Volatile Metabolites Produced by Glomerella cingulata. Journal of Oleo Science, 57, 585 – 590, 2020
PALANICAMY, P.; KRISHNAMOORTHY, G.; KANNAN, S.; MARUDHAMUTHU, M. Bioactive potential of secondary metabolites derived from medicinal plant endophytes. Egyptian Journal of Basic and Applied Sciences, vol. 5, p. 303-312, 2018
ROGÉRIO, F.; CIAMPI-GUILLARDI, M.; BARBIERI, M. C. G.; BRAGANÇA, C. A. D.; SEIXAS, C. D. S.; ALMEIDA, A. M. R.; MASSOLA, N. S. Phylogeny and variability of Colletotrichum truncatum associated with soybean anthracnose in Brazil. Journal of Applied Microbiology, v. 122, n. 2, p. 402-415, 2017
STROBEL, G. A. Endophytes as sources of bioactive products. Microbes and Infection, vol 5, p. 535-544, 2003
USHA, S. N., SUDHA, S., V. ANUSHA, V. J., MANISHA, S. Isolation, identification and extraction of antimicrobial compounds produced by Streptomyces sps from terrestrial soil. Biocatalysis and Agricultural Biotechnology, vol. 15, p. 317-321, 2018.
















