Autores
Conrado, N. (UNIT) ; Farrapeira, R. (INCT) ; Loreiro, A. (ITP/UNIT) ; Krause, L. (UNIT) ; Caramão, E. (UNIT)
Resumo
Nos últimos anos, houve um crescimento notável no consumo do açaí, fruto
brasileiro, e rico em compostos bioativos. Seu processamento industrial gera um
grande volume de resíduos (sementes). O objetivo foi utilizar técnica avançada
(EDGE) para extrações de compostos bioativos na semente do açaí e caracterizar
seus compostos por HPLC-DAD. Nas extrações EDGE foi utilizado um Delineamento
Composto Central (CCD) 2³ (temperatura, tempo de extração e % de etanol no
solvente) com a variável resposta concentração de polifenóis totais. Como
resultados, obteve um extrato na melhor condição (105°C, 4 min e etanol 75% (20
mL)) e rico em procianidina B1 e B2, catequina e epicatequina identificadas e
quantificadas por HPLC-DAD. Por fim, foi considerado um subproduto com potencial
benéfico a saúde.
Palavras chaves
Açai; EDGE; polifenóis
Introdução
A Euterpe oleracea M. (açaizeiro) é uma palmeira nativa da floresta Amazônica
que produz o fruto conhecido como açaí. O mercado do açaizeiro engloba,
principalmente, o setor alimentício, com a fabricação da polpa da fruta e do
palmito, retirado do interior da palmeira. Diversos estudos têm demonstrado que
o consumo do açaí proporciona benefícios a saúde, devido aos seus valores
nutricionais e terapêuticos, o que a levou a ser classificada como uma
“superfruta”, devido a concentração dos compostos bioativos presentes,
principalmente compostos fenólicos e ácidos graxos (CHANG et al., p.02, 2018;
BAPTISTA et al., p. 1377, 2021).
O fruto do açaí possuí importância social, alimentar, cultural e econômica para
pequenos grupos familiares de produtores, principalmente populações ribeirinhas
do Norte do Brasil (TAVARES et al., p. 02, 2020). A cadeia produtiva do açaí
envolve extrativistas, produtores, intermediários, batedores artesanais e
indústrias de beneficiamento. Seu processamento gera grande volume de resíduos
orgânicos, principalmente sementes, as quais correspondem a 80% do peso total do
fruto. Uma pequena parcela do volume de resíduos é convertida em adubo orgânico
ou artesanato, enquanto o restante, é descartado no meio ambiente (SOUZA, p.18,
2019; DE SOUSA MARTINS et al., p.04, 2020).
Diante da inevitável geração de resíduos, a prospecção de compostos de alto
valor agregado nos resíduos da indústria de processamento de frutas tem recebido
atenção. Estudos acerca do tema tem demonstrado a presença de compostos com alto
valor nutricional e farmacológico (CLERICI et al., p. 1659, 2011; ADADI et al.,
p. 709, 2019). Com a semente de açaí, não foi diferente. Estudos in vitro e in
vivo demonstram importantes atividades biológicas associadas aos extratos
obtidos por meio de metodologias convencionais de extração.
Dentre as atividades observadas, podemos citar a antioxidante (CHOI, p. 243,
1998; BARROS et al., p. 318, 2015; MELO et al., p. 440, 2016; MARTINEZ et al.,
p. 04, 2018), anti-inflamatória (DE MOURA, p. 2012; SUDO et al., p. 08, 2015;
MACHADO et al., 2016; CORDEIRO et al., p.8017, 2018;), cardioprotetora (ZAPATA-
SUDO et al., p. 02, 2014; DE BEM, p. 1328, 2014), citotóxica (SILVA et al., p.
02, 2014; FREITAS et al., p. 714, 2017), antinociceptiva (SUDO et al., p. 08,
2015), antilipêmica (DE OLIVEIRA et al., p. 02, 2015; DA SILVA et al, p. 408,
2018; TRINDADE et al., 2019) e renoprotetora (CORDEIRO et al., p. 06, 2018; DA
COSTA, et al., p. 1002, 2017).
Com relação a composição química dos extratos das sementes de açaí, os métodos
de extração convencionais foram os mais utilizados no preparo das amostras
(RODRIGUES, p. 4263, 2006; MARTINS et al., 02, 2020; MELO et al., p. 02, 2021),
além da Extração Acelerada por Solvente (WYCOFF et al., p. 183, 2015), Extração
Assistida por Ultrassom (MELO et al., p. 441, 2016) e Extração por Líquido
Pressurizado (VIGANO et al., p. 02, 2022), sendo os compostos fenólicos, entre
eles a catequina, epicatequina e procianidinas identificados. Na Figura 1
observa-se a estrutura química de alguns compostos identificados na semente do
açaí e um esquema representando a atividade antioxidante, uma das principais
atividades apregoadas a estes compostos.
Nos últimos anos, novas técnicas foram desenvolvidas para a extração de
compostos bioativos de fontes naturais. Essas tecnologias “verdes” possuem o
consumo reduzido de solventes orgânicos, menores tempos de operação e melhor
rendimento e qualidade do extrato (JHA & SIT, p. 579, 2022), principalmente
quando associadas ao delineamento estatístico. Entre essas técnicas, o sistema
de Extração por Energia Dispersiva Guiada (EDGE), foi desenvolvido para combinar
a extração dispersiva em fase sólida com o sistema ASE (KINROSS et al, p.01
2020). Uma representação do equipamento pode ser observada na Figura 1.
O EDGE usa uma célula extrativa aberta de duas peças denominada “Q-Cup” para
armazenar a amostra. Durante a extração, o solvente é adicionado à amostra no Q-
Cup, e a amostra e o solvente são pressurizados e aquecidas à temperatura e
tempo selecionados. Quando a extração é finalizada, o extrato passa pelo fundo
através do filtro, onde passa por uma serpentina de resfriamento e dispensado no
frasco de coleta. O extrato final está à temperatura ambiente, filtrado e pronto
para análise (CEM, 2022). A literatura sobre este sistema ainda é escassa,
Tasfiyati et al., (p. 02, 2022) demonstraram o uso do sistema EDGE para a
obtenção de escopoletina a partir de frutos de Morinda citrifolia L. (Noni),
enquanto Hoff et al., (p. 01, 2022) demonstraram a capacidade do EDGE para
extrair drogas veterinárias e contaminantes de rações para animais.
Desta forma, o objetivo do presente estudo foi desenvolver uma metodologia de
extração dos compostos polifenólicos das sementes do açaí utilizando EDGE, além
de avaliar a composição química do extrato gerado.
Material e métodos
-Obtenção e processamento do material: As sementes de açaí foram cedidas pala
empresa ISA FOODS EIRELI, localizada na Bahia. Elas foram trituradas, peneiradas
(8-16 mesh) e secas em estufa a 40 °C por 24h. O teor de umidade da amostra in
natura e durante as 24h de secagem foi monitorado no equipamento por secagem
infravermelha (1 g, 140 ° C, em triplicata).
-Reagentes, solventes e padrões: Os solventes e reagentes foram obtidos da Merck
e água ultrapura de um sistema de purificação Marte Científica. Os padrões:
catequina, epicatequina, galato de epigalocatequina, procianidina A2,
procianidina B1, procianidina B2, quercetina 3-glicosídeo, kaempferol 3-
glicosídeo, ácido gálico, ácido siríngico, ácido cafetárico, ácido clorogênico,
trans-resveratrol foram adquiridos da Sigma Aldrich.
-Extração dos compostos fenólicos por EDGE: As extrações por EDGE® (CEM
Corporation, USA) seguiram um planejamento fatorial (2^3) com 1,0g de amostra e
20mL do volume de solvente extrator fixo. Variáveis independentes: tempo de
extração (x1), temperatura (x2) e % de etanol no solvente extrator (x3), e
variável dependente: polifenóis totais (PT) nos extratos gerados. Os níveis das
variáveis codificáveis foram: -1 (baixo), 0 (ponto central) e +1 (alto).
Estimativas dos erros para o planejamento foram obtidas com a inclusão de
experimentos no ponto central (3 repetições). Os resultados foram submetidos à
ANOVA, utilizando o software MATLAB ® para verificar quais variáveis
independentes têm influência significativa no processo de extração de PT.
-Análise dos Polifenóis Totais: Utilizou-se a metodologia Folin-Ciocalteu com
modificações (SINGLETON et al., p. 152, 1999). Uma alíquota (0,5 mL) de cada
extrato foi misturada com 9 mL de água destilada, 0,5 mL de reagente Folin-
Ciocalteu e 5 mL de solução de Na2CO3 a 7%. Após 2,5 horas de incubação a 25ºC,
a absorbância foi medida em 760 nm. Uma curva padrão foi preparada usando
soluções nas concentrações entre 60 e 150 mg/L de ácido gálico. O resultado foi
expresso como mg de equivalentes de ácido gálico por 1 g de material seco (mg
GAE/g).
-Análise por HPLC-DAD: A análise seguiu a metodologia desenvolvida por (DUTRA et
al, p. 650, 2018). Os cromatogramas foram processados em 220 nm - catequina,
epicatequina, epigalocatequina galato, procianidina A2, procianidina B1,
procianidina B2, 280 nm – ácidos gálico e siríngico, 320 nm - ácidos caftárico e
clorogênico, e trans-reveratrol, 360 nm - quercetina 3-glicosídeo, kaempferol 3-
glicosídeo. A identificação dos compostos foi baseada na comparação com o tempo
de retenção e espectro de UV-vis com padrões analíticos nas mesmas condições de
análise. Os valores dos coeficientes de correlação (R2) para todos os padrões
foram >0,998. Os limites de detecção e quantificação foram <0,17 mg/L e <1,41
mg/L, respectivamente, para todos os compostos. A quantificação foi feita pela
injeção de curvas de calibração externas. Os resultados foram expressos em
termos de mg/g de amostra seca.
Resultado e discussão
A avaliação das variáveis significativas no processo extrativo usando EDGE foi
realizada por um planejamento fatorial completo 2^3 com ponto central, com as
variáveis independentes (x1) tempo de extração, (x2) temperatura e (x3) % de
etanol no solvente extrator. A variável dependente (y) foi o teor de polifenóis
totais (em mg Eq AG/g), nos extratos gerados em cada experimento. O volume de
solvente extrator foi mantido fixo em 20 mL. Os dados foram submetidos a análise
de variância (ANOVA), que avaliou a significância das variáveis independentes,
ou seja, quais variáveis afetaram o processo de extração. Os resultados da ANOVA
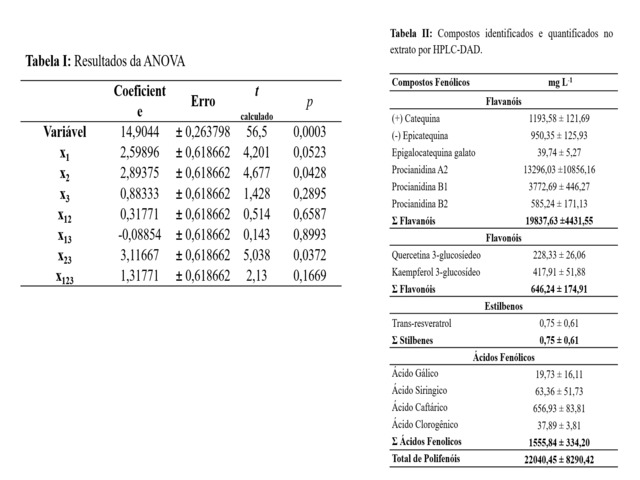
estão apresentados na Tabela I.
Toda variável independente cujo p-valor foi menor que o nível de significância
α=0,05, foi considerada significativa para o processo de extração. Por
consequência, a variável de primeira ordem temperatura de extração (x2) e a
interação de segunda ordem temperatura de extração versus % de etanol no
solvente extrator (x2 x3), foram consideradas significativas para a recuperação
de polifenóis no experimento. As demais variáveis e interações foram
consideradas não significativas.
Com relação a variável temperatura, a elevação da temperatura no experimento
gerou um aumento no rendimento de polifenóis totais, visto que este coeficiente
é positivo. No entanto, alguns compostos bioativos presentes nos extratos são
termossensíveis, e se degradam em temperaturas altas (PATRAS et al., p. 03,
2010). Sendo assim, o nível mais alto (+1), ou seja, 105 ºC para esta variável,
foi definido para o trabalho, e não foram testadas temperaturas mais elevadas.
Com relação a variável de segunda ordem temperatura de extração versus % de
etanol no solvente extrator, o comportamento foi semelhante à da variável
temperatura, uma vez que o coeficiente também se mostrou positivo. Assim, os
níveis mais altos (+1) para estas variáveis foram definidos para o trabalho, ou
seja, 105 ºC e 75% de etanol no solvente extrator. A variável não significativa
tempo de extração foi mantida no seu nível mais baixo (-1): 4 minutos, a fim de
economizar energia e tempo de trabalho. Os parâmetros definidos para o melhor
rendimento de extração equivalem aos do experimento 8 do planejamento.
Desta forma, as condições para a extração das sementes de açaí utilizando EDGE,
a fim de obter o maior rendimento em termos de concentração de polifenóis totais
foram: volume de solvente = 20 mL, tempo de extração = 4 minutos, temperatura =
105 ºC e 75 % de etanol no solvente extrator. O rendimento em polifenóis
calculado para esta condição foi 20,42 mg Eq. AG g-1, enquanto o resultado
experimental, 20,63 (±0,73) mg Eq. AG/g, ou seja, o resultado experimental não
difere significativamente do valor predito, a um nível de confiança de 95%,
resultado que validou o modelo preditivo.
Os solventes orgânicos de maior polaridade são mais eficientes do que solventes
não polares na extração dos polifenóis de matrizes vegetais. Nos processos
extrativos utilizando líquido pressurizado, o aumento da temperatura gera
aumento da difusão dos compostos no solvente extrator devido a dois fatores
principais: (1) o solvente penetra na matriz de forma mais eficiente sob
pressões aumentadas, e (2) temperaturas elevadas reduzem a viscosidade e tensão
superficial dos solventes. Ambos os fatores facilitam a extração dos compostos
localizados nos poros internos da matriz. Embora temperaturas elevadas auxiliem
a liberação de maiores quantidades de compostos fenólicos, a temperatura deve
ser limitada devido à instabilidade térmica dos compostos. O uso de altas
temperaturas e pressões estão associadas à degradação de compostos fenólicos
(OSORIO-TOBÓN, p. 4302, 2020).
Os compostos fenólicos pertencem a uma classe de substância bioativa de origem
vegetal definida como fitoquímicos (ABUAJAH et al., p. 2522, 2015). A
recuperação dos compostos fenólicos obtidos por EDGE (20,63 mg Eq. AG/g) foi
inferior às relatadas anteriormente para a extração convencional (decocção)
(370,8 mg Eq GAE g-1) (MARTINEZ et al., p.04, 2018), PLE (84 mg Eq AG/g) (VIGANO
et al., p. 07, 2022) e UAE (64,58 mg Eq AG/g) (MELO et al., p. 06, 2021),
utilizando a mesma solução hidroetanólica.
Alguns fatores, como a natureza do solvente extrator, temperatura e tempo de
extração, aumentam a difusividade e a solubilidade no processo de extração.
Estudos tem demostrado melhora na recuperação dos compostos fenólicos por
misturas binárias água-etanol, uma vez que elas atuam de diferentes maneiras.
Uma alta concentração de água melhora a extração dos solutos da matriz vegetal
devido à polaridade do solvente, no entanto, isso implica na maior viscosidade
do solvente, o que dificulta sua penetração na matriz. Por outro lado, a alta
concentração de etanol proporciona a desnaturação das proteínas, o que interfere
na solubilidade dos compostos fenólicos no solvente (D’ALESSANDRO et al, p.42,
2012).
Em suma, diferentes técnicas de extração, além das características
edafoclimáticas, influenciam a quantidade de compostos fenólicos nas sementes de
açaí. No entanto, apesar das diferenças quantitativas, os resultados mostraram
que os polifenóis podem ser facilmente recuperados da matriz. Curiosamente,
Silva et al., p. 03, 2014 encontraram maior concentração de polifenóis em
sementes (28,3%) do que frutos (25,5%) e cascas (15,7%) de açaí, o que destaca o
potencial desse resíduo como fonte de compostos de alto valor agregado.
A técnica de HPLC-DAD foi utilizada para a identificação e quantificação dos
compostos no extrato hidroetanólico obtido por EDGE. Para tanto, foi utilizado o
método da padronização externa. A Tabela II apresenta os resultados obtidos e a
Figura 2 mostra os perfis cromatográficos da amostra processada em 280, 220, 320
e 360 nm.
Ao todo, 13 compostos foram identificados e quantificados no extrato de semente
de açaí. Os flavanóis foram a classe de compostos com maior concentração (19837
mg/L), destacando-se as procianidinas A2 e B1, a catequina e a epicatequina.
Quatro ácidos fenólicos foram identificados, destacando-se, quanto a
concentração o ácido cafetárico e, quanto a importância biológica, o ácido
clorogênico. A quercetina 3-glucosíedeo e o kaempferol 3-glucosídeo, importantes
flavonoides, também foram identificados em quantidades significativas no
extrato.
Estudos acerca da composição química dos extratos da semente de açaí (RODRIGUES
et al., p; 4166, 2006; BARROS et al., p. 321, 2015; MARTINS et al., p. 109830,
2020) identificaram positivamente catequina e epicatequina, e tentativamente
oligômeros de procianidina como constituintes.
Soares et al., (p. 110, 2017) quantificaram sete compostos no extrato de semente
de açaí: catequina (419,30 mg /100 g), epicatequina (473,96 mg/100 g), ácido
gálico (2,39 mg/100 g), ácido siríngico (76.18 ± 1.66 mg 100 g), ácido
protocatecuico (3,41 ± 0,23 mg/100 g), epigalocatequina galato (58.07 mg 100 g),
quercetina 3-glucosíedeo (10,83 mg/100 g). Já os oligômeros procianidinas B1
(16,08 mg/g) e B2 (1,49 mg/g), assim como, catequina (15,66 mg/g), epicatequina
(5,32 mg/g) foram quantificados (MELO et al., p. 07, 2021) recentemente.
Desta forma, o presente estudo representa uma contribuição para o conhecimento
detalhado dos metabólitos secundários presentes na semente do açaí.

Figuras 1 e 2: estão as figura 1 (introdução) e Figura 2 (resultados e discussão)
Nas Tabelas estão a Tabela I (resultados da ANOVA) e Tabela II (compostos identificados e quantificados pelo HPLC-DAD).
Conclusões
A partir da análise dos resultados do planejamento de experimentos, foi possível
avaliar a correlação entre as variáveis do processo de extração por EDGE e
verificar como as mudanças nos níveis destas variáveis afetavam a extração dos
polifenóis da semente do açaí. Em um primeiro momento, foi possível concluir que a
variável de primeira ordem temperatura de extração e a interação de segunda ordem
temperatura de extração versus % de etanol no solvente extrator foram
significativas. A partir da análise dos resultados do planejamento, foi possível
gerar extratos ricos em polifenóis. A análise do extrato por HPLC-DAD apresentou
13 compostos identificados e quantificados, com destaque para os flavanóis
(procianidinas A2 e B1, (+) catequina e (-) epicatequina), o que representa um
avanço na compreensão da composição química desta importante matriz vegetal.
Agradecimentos
FAPITEC, UNIVERSIDADE TIRADENTES (UNIT), INSTITUTO TECNOLOGIA DE PESQUISA (ITP),
LABORATÓRIDO DE CROMATOGRAGIA (LABCROM)
Referências
ABUAJAH, C. I.; OGBONNA, A. C.; OSUJI, C. M. Functional components and medicinal properties of food: a review. Journal of food science and technology, v. 52, n. 5, p. 2522-2529, 2015.
ADADI, P.; BARAKOVA, N. V.; MURAVYOV, K. Y.; KRIVOSHAPKINA, E. F. Designing selenium functional foods and beverages: A review. Food Research International, v. 120, p. 708-725, 2019.
D’ALESSANDRO, L. G.; KRIAA, K., NIKOV, I.; DIMITROV, K. Ultrasound assisted extraction of polyphenols from black chokeberry. Separation and purification technology, v. 93, p. 42-47, 2012.
BAPTISTA. S. DE L.; COPETTI, C. L. K.; CARDOSO A. L.; DI PIETRO, P. F.; Biological activities of açaí (Euterpe oleracea Mart.) and juçara (Euterpe edulis Mart.) intake in humans: an integrative review of clinical trials. Nutrition Reviews, v. 79 n.12, p. 1375-1391 2021
BARROS, L.; CALHELHA, R. C.; QUEIROZ, M. J. R.; SANTOS-BUELGA FERREIRA, I. C. The powerful in vitro bioactivity of Euterpe oleracea Mart. seeds and related phenolic compounds. Industrial Crops and Products, v. 76, p. 318-322, 2015
DE BEM, G. F.; DA COSTA, C. A.; DE OLIVEIRA, P. R. B.; CORDEIRO, V. S. C.; SANTOS, I. B.; DE CARVALHO, L. C. R. M.; SOUZA, M. G. V. S.; OGNIBENE, D. T.; DALEPRANE, J. B.; SOUSA, P. J. C.; RESENDE, A. C.; DE MOURA, R. S. Protective effect of Euterpe oleracea Mart (açaí) extract on programmed changes in the adult rat offspring caused by maternal protein restriction during pregnancy. Journal of Pharmacy and Pharmacology, v. 66, n. 9, p. 1328-1338, 2014.
BRASIL. Secretária de Estado de Desenvolvimento Agropecuário e da Pesca. Governo do Estado do Pará – SEDAP/PA. Açaí, 2020. Disponível em: < AÇAÍ | SEDAP> Acesso em 17 de agosto de 2022.
CHAI, J.; JIANG, P.; WANG, P.; JIANG Y.; LI, D.; BAO, W.; LIU, B.; LIU, B.; ZHAO, L.; NORDE, W.; YUAN, Q.; REN, F.; LI, Y. The intelligent delivery systems for bioactive compounds in foods: Physicochemical and physiological conditions, absorption mechanisms, obstacles and responsive strategies. Trends in Food Science and Technology, v. 78, p. 144–154, 2018.
CHANG, S. K.; ALASALVAR, C.; SHAHIDI, F. Superfruits: Phytochemicals, antioxidant efficacies, and health effects – A comprehensive review. Critical Reviews in Food Science and Nutrition, v. 8398, p. 1–25, 2018.
CHOI, Y. J.; CHOI, Y. J.; KIM, N.; NAM, R. H.; LEE, S.; LEE, H. S.; LEE, H-N.; SURH, Y-J.; LIM, N.; NAM, R. H.; LEE, D. H. Açaí Berries Inhibit Colon Tumorigenesis in Azoxymethane/Dextran Sulfate Sodium-Treated Mice. Gut and Liver, v. 11, n. 2, p. 243–252, 2017.
CLERICI, M. T. P. S.; CARVALHO-SILVA, L. B. Nutritional bioactive compounds and technological aspects of minor fruits grown in Brazil. Food Research International, v. 44, n. 7, p. 1658–1670, 2011.
CEM. Manual de Operações do sistema Edge, 2019. Disponível em http://cem.com/edge, acessado em 17 de agosto de 2022.
COSTA, C. A.; OGNIBENE, D. T.; CORDEIRO, V. S. C.; DE BEM, G. F.; SANTOS, I. B.; SOARES, R. A.; CUNHA, L. L DE M.; CARVALHO, C. R. M.; DE MOURA, R. S.; RESENDE, A. C. Effect of Euterpe oleracea Mart. Seeds Extract on Chronic Ischemic Renal Injury in Renovascular Hypertensive Rats. Journal of Medicinal Food, v. 20, n. 10, p. 1002-1010, 2017.
CORDEIRO, V.S.C.; CARVALHO, L.C.R.M.; DE BEM, G.F.; COSTA, C.A.; SOUZA, M.A.V.; SOUSA, P.J.C.; ROCHA, V.N.; CARVALHO, J.J.; MOURA, R.S.; RESENDE, A.C. Euterpe oleracea Mart extract prevents vascular remodeling and endothelial dysfunction in spontaneously hypertensive rats. International Journal of Applied Research in Natural Products, v. 8, n. 3, p. 6-16, 2015.
CORDEIRO, V.S.C.; BEM, G.F.; COSTA, C.A.; SANTOS, I.B.; CARVALHO, L.C.R.M.; OGNIBENE, D.T.; ROCHA, A.M.; CARVALHO, J.J.; MOURA, R.S.; RESENDE, A.C. Euterpe oleracea Mart. seed extract protects against renal injury in diabetic and spontaneously hypertensive rats: Role of inflammation and oxidative stress. European Journal Of Nutrition, v. 57, p. 817–832, 2016.
DUTRA, R. L. T.; DANTAS, A. M.; DE ARAÚJO MARQUES, D.; BATISTA, J. D. F.; DE ALBUQUERQUE MEIRELES, B. R. L.; DE MAGALHÃES CORDEIRO, Â. M. T.; BORGES, G. D. S. C. Bioaccessibility and antioxidant activity of phenolic compounds in frozen pulps of Brazilian exotic fruits exposed to simulated gastrointestinal conditions. Food Research International, v. 100, p. 650-657, 2017.
FREITAS, D.D.S.; MORGADO-DÍAZ, J.A.; GEHREN, A.S.; VIDAL, F.C.B.; FERNANDES, R.M.T.; ROMÃO, W.; TOSE, L.V.; FRAZÃO, F.N.S.; COSTA, M.C.P.; SILVA, D.F.; NASCIMENTO, M. D. D. S. Cytotoxic analysis and chemical characterization of fractions of the hydroalcoholic extract of the Euterpe oleracea Mart. seed in the MCF-7 cell line. Journal of Pharmacy and Pharmacology, v. 69, n. 6, p. 714-721, 2017.
HOFF, R. B.; MOLOGNONI, L.; DEOLINDO, C. T. P.; VARGAS, M. O.; KLEEMANN, C. R.; DAGUER, H. Determination of 62 veterinary drugs in feedingstuffs by novel pressurized liquid extraction methods and LC-MS/MS. Journal of Chromatography B, v. 1152, p. 122232, 2020.
JHA, A. K. & SIT, N. Extraction of bioactive compounds from plant materials using combination of various novel methods: A review.Trends in Food Science & Technology. v. 119, p. 579-591, 2022.
KINROSS, A. D; HAGEMAN, K. J.; DOUCETTE, W. J.; FOSTER, A. L. Comparison of Accelerated Solvent Extraction (ASE) and Energized Dispersive Guided Extraction (EDGE) for the analysis of pesticides in leaves. Journal of Chromatography A, v. 1627, p. 461414, 2020.
MACHADO, D.E.; RODRIGUES-BAPTISTA, K.C.; ALESSANDRA-PERINI, J.; SOARES DE MOURA, R.; SANTOS, T.A.D.; PEREIRA, K.G.; DA SILVA, Y.M.; SOUZA, P.J.C.; NASCIUTTI, L.E.; PERINI, J.A. Euterpe oleracea extract (açaí) is a promising novel pharmacological therapeutic treatment for experimental endometriosis. PLoS One, v. 11, n. 11, p. e0166059, 2016.
MARTINEZ, R. M.; GUIMARÃES, D. D. A. B.; BERNIZ, C. R..; ABREU, J. P. D; ROCHA, A. P. M. D.; MOURA, R. S. D.; RESENDE, A. C. TEODORO, A. J. Açai (Euterpe oleracea Mart.) seed extract induces cell cycle arrest and apoptosis in human lung carcinoma cells. Foods, v. 7, n. 11, p. 178, 2018.
MARTINS, G. R.; DO AMARAL; F. R. L.; BRUM, F. L.; MOHANA-BORGES, R.; DE MOURA, S. S.; FERREIRA, F. A.; SANGENITO, L. S.; SANTOS, A. L. S.; FIGUEIREDO, N. G.; DA SILVA, A. S. A. Chemical characterization, antioxidant and antimicrobial activities of açaí seed (Euterpe oleracea Mart.) extracts containing A-and B-type procyanidins. LWT, v. 132, p. 109830, 2020.
MELO, P. S.; ARRIVETTI, L. D. O. R.; DE ALENCAR, S. M.; SKIBSTED, L. H. Antioxidative and prooxidative effects in food lipids and synergism with α-tocopherol of açaí seed extracts and grape rachis extracts. Food chemistry, v. 213, p. 440-449, 2016.
MELO, P. S., SELANI, M. M., GONÇALVES, R. H., DE OLIVEIRA PAULINO, J., MASSARIOLI, A. P., & DE ALENCAR, S. M. Açaí seeds: An unexplored agro-industrial residue as a potential source of lipids, fibers, and antioxidant phenolic compounds. Industrial Crops and Products, v. 161, p. 113204, 2021.
DE MOURA, R. S.; PIRES, K. M. P.; FERREIRA, T. S.; LOPES, A. A.; NESI, R. T., RESENDE, A. C.; SOUSA, P. J. C.; DA SILVA, A. J. R.; PORTO, L. C.; VALENCA, S. S. Addition of açaí (Euterpe oleracea) to cigarettes has a protective effect against emphysema in mice. Food and Chemical Toxicology, v. 49, n. 4, p. 855–863, 2011.
DE MOURA, R.S.; FERREIRA, T.S.; LOPES, A.A.; PIRES, K.M.P.; NESI, R.T.; RESENDE, A.C.; SOUZA, P.J.C.; DA SILVA, A.J.R.; BORGES, R.M.; PORTO, L.C.; VALENCA, S. S. Effects of Euterpe oleracea Mart. (açaí) extract in acute lung inflammation induced by cigarette smoke in the mouse. Phytomedicine, v. 19, n. 3-4, p. 262-269, 2012.
NASCIMENTO, V. H. N. D.; LIMA, C. D. S.; PAIXÃO, J. T. C.; FREITAS, J. J. D. S.; KIETZER, K. S. Antioxidant effects of açaí seed (Euterpe oleracea) in anorexia-cachexia syndrome induced by Walker-256 tumor1. Acta Cirurgica Brasileira, v. 31, p. 597-601, 2016.
DE OLIVEIRA, P. R. B.; DA COSTA, C. A.; DE BEM, G. F.; CORDEIRO, V. C. C.; SANTOS, I. B.; CARVALHO, L. C. R. M. DE.; CONCEIÇÃO, E P. S. DA, LISBOA, P. C.; OGNIBENE, D. T.; SOUSA, P. J.; MARTINS, G. R.; SILVA, A. J. R. DE.; MOURA, R. S. DE; RESENDE, A. C. Euterpe oleracea Mart.-derived polyphenols protect mice from diet-induced obesity and fatty liver by regulating hepatic lipogenesis and cholesterol excretion. PLOS ONE, v. 10, n. 12, p. 1-16, 2015.
OSORIO-TOBÓN, J. F. Recent advances and comparisons of conventional and alternative extraction techniques of phenolic compounds. Journal of Food Science and Technology, v. 57, p. 4299-4315, 2020.
PATRAS, A.; BRUNTON, N. P.; O'DONNELL, C.; TIWARI, B. K. Effect of thermal processing on anthocyanin stability in foods; mechanisms and kinetics of degradation. Trends in Food Science & Technology, v. 21, n. 1, p. 3-11, 2010.
ROCHA, A.P.M.; CARVALHO, L.C.R.M.; SOUSA, M.A.V.; MADEIRA, S.V.F.; SOUSA, P.J.C.; TANO, T.; MOURA, R.S.D. Endothelium-dependent vasodilator effect of Euterpe oleracea Mart. (açai) extracts in mesenteric vascular bed of the rat. Vascul Pharmacol, v. 46, p. 97-104, 2007.
RODRIGUES, R. B.; LICHTENTHÄLER, R.; ZIMMERMANN, B. F.; PAPAGIANNOPOULOS, M.; FABRICIUS, H.; MARX, F.; MAIA J. G. S.; ALMEIDA, O. Total oxidant scavenging capacity of Euterpe oleracea Mart. (açaí) seeds and identification of their polyphenolic compounds. Journal of Agricultural and Food Chemistry, v. 54, n. 12, p. 4162-4167, 2006.
SILVA, D. F.; VIDAL, F. C. B.; SANTOS, D.; COSTA, M. C. P.; MORGADO-DÍAZ, J. A.; NASCIMENTO, M. D. D. S. B.; DE MOURA, R. S. Cytotoxic effects of Euterpe oleracea Mart. in malignant cell lines. BMC Complementary and Alternative Medicine, v. 14, p. 1–9, 2014.
SILVA, R. C.; BATISTA, A.; COSTA, D. D.; DA MOURA-NUNES, N.; KOURY, J. C.; COSTA, C. A.; RESENDE, A. C.; DALEPRANE, J. B. Açaí (Euterpe oleracea Mart.) seed flour prevents obesityinduced hepatic steatosis regulating lipid metabolism by increasing cholesterol excretion in high-fat diet-fed mice. Food Research International, v. 111, n. 13, p. 408-415, 2018.
SINGLETON, L.V.; ORTHOFER, R.; LAMUELA-RAVENTÓS, R. M. Analysis of total phenols and other oxidation substrates and antioxidants by means of folin-ciocalteu reagente. Methods in Enzymology, p. 152-178, 1999.
SOARES, E. R.; MONTEIRO, E. B.; GRAZIELE, F.; INADA, K. O.; TORRES, A. G.; PERRONE, D.; SOULAGE, C. O.; MONTEIRO, M. C.; RESENDE, A. C.; NUNES, N. M.; COSTA, C. A.; DALEPRANE, J. B. Up-regulation of Nrf2-antioxidant signaling by Açaí (Euterpe oleracea Mart.) extract prevents oxidative stress in human endothelial cells. Journal of functional foods, v. 37, p. 107-115, 2017.
SUDO, R.T.; NETO, M.L.; MONTEIRO, C.E.S.; AMARAL, R.V.; RESENDE, Â.C.; SOUZA, P.J.C.; ZAPATA-SUDO, G.; MOURA, R.S. Antinociceptive effects of hydroalcoholic extract from Euterpe oleracea Mart. (açaí) in a rodent model of acute and neuropathic pain. BMC Complementary and Alternative Medicine, v. 15, n. 1, p. 1-8, 2015.
SOUZA, M. S. D. Produção e caracterização de carvões ativados de caroços de açaí e sua aplicação no tratamento de água de manancial superficial Dissertação De Mestrado Instituto de Tecnologia Programa de Pós-Graduação em Engenharia Civil – Belém, Pará, 102p., 2019.
DE SOUSA MARTINS, M. M.; DA SILVA, J. E. V. C.; FUJIYAMA, B. S.; DE SOUZA, M. Açaí Waste As Innovation, Economy And Sustainable. V Congresso Internacional de Ciências Agrárias - Cointer PDVAGRO - Edição 100% virtual - 02 a 05 de dezembro de 2020.
TAVARES, G.; HOMMA, A.; MENEZES, A.; PALHETA, M. Análise da produção e comercialização de açaí no estado do Pará, Brasil. International Journal of Development Research, v. 10, n. 04, p. 35215-35221, 2020.
TASFIYATI, A. N.; ANTIKA, L. D.; DEWI, R. T.; SEPTAMA, A. W.; SABARUDIN, A.; ERNAWATI, T. An experimental design approach for the optimization of scopoletin extraction from Morinda citrifolia L. using accelerated solvent extraction. Talanta, v. 238 n. 1, p. 123010, 2022.
TRINDADE, P.; SOARES, E.; MONTEIRO, E.; MOURA-NUNES, N.; COSTA, D.; DALEPRANE, J. Antiadipogenic effects of açai polyphenols on high fat diet-fed mice and 3T3-L1 adipocytes: A potential mechanism of action (OR34-04-19). Current Developments in Nutrition, v. 3, n. Supplement_1, p. nzz031. OR34-04-19, 2019.
VIGANÓ, J., DE AGUIAR, A. C., VEGGI, P. C., SANCHES, V. L., ROSTAGNO, M. A., & MARTÍNEZ, J. Techno-economic evaluation for recovering phenolic compounds from acai (Euterpe oleracea) by-product by pressurized liquid extraction.The Journal of Supercritical Fluids v. 179 p. 105413, 2022
WYCOFF, W.; LUO, R.; SCHAUSS, A. G.; NEAL-KABABICK, J.; SABAA-SRUR, A. U.; MAIA, J. G. S.; TRAN, K.; RICHARDS, K. M.; SMITH, R. E. Chemical and nutritional analysis of seeds from purple and white açaí (Euterpe oleracea Mart.). Journal of Food Composition and Analysis, n 41 p. 181–187, 2015.
ZAPATA-SUDO, G.; DA SILVA, J. S.; PEREIRA, S. L.; SOUZA, P. J.; DE MOURA, R. S.; SUDO, R. T. Oral treatment with Euterpe oleracea Mart. (açaí) extract improves cardiac dysfunction and exercise intolerance in rats subjected to myocardial infarction. BMC Complementary and Alternative Medicine, v. 14, p. 2–7, 2014.
















