Autores
Torres-castañeda, H. (UNIVERSIDAD NACIONAL DE COLOMBIA SEDE PALMIRA) ; Soto-alvarez, A.K. (UNIVERSIDAD SANTIAGO DE CALI) ; López-parra, L.L. (UNIVERSIDAD DEL VALLE)
Resumo
Con el propósito de evaluar la influencia de algunos factores en la extracción
eco-amigable de antocianinas a partir de frutos de milpesillos (Oenocarpus
mapora), se realizaron ensayos para la obtención de extractos bajo diferentes
condiciones empleando la extracción asistida por micromaceración y utilizando la
mezcla cloruro de colina-ácido láctico como solvente eutéctico natural (NaDES).
Los resultados mostraron que con un NaDES formado por cloruro de colina-ácido
láctico en relación molar (1:2) conteniendo 60% de agua combinado con un tiempo de
extracción de 20 minutos y una relación muestra solvente de 90 mg/mL, sería un
solvente adecuado para maximar el rendimiento en cuanto a extracción de
antocianinas.
Palavras chaves
Oenocarpus mapora; Antocianinas; NaDES
Introdução
A partir de la urgencia de encontrar formas más ecológicas para la extracción de
compuestos bioactivos a partir de fuentes naturales, surgen los solventes
eutécticos naturales [en terminología inglesa Natural Deep Eutectic Solvents
(NaDES)]. Los NaDES son mezclas eutécticas formadas de metabolitos primarios
unidos entre sí por fuertes interacciones intermoleculares especialmente el
enlace de hidrógeno (ZANNOU & KOCA, 2020).
El milpesillos (Oenocarpus mapora H. Karst.) es un fruto perteneciente a la
familia de las palmas (Arecaceae) y utilizado en la Región Pacífica colombiana
para la elaboración de refrescos como chicha, postres y helados (BEST et al.,
2021; SMITH, 2015; PEREIRA et al., 2019). Se ha reportado que especies
pertenecientes al género Oenocarpus son fuentes de compuestos bioactivos
principalmente antocianinas (CUNHA et al., 2019). Las antocianinas son el
principal grupo de pigmentos hidrosolubles tipo flavonoides, responsables de los
colores rojo a violeta en flores y frutos y reconocidas como sustancias
bioactivas gracias a su amplio espectro de actividades biológicas (TENA et al.,
2020; PALUNGWACHIRA et al., 2019; YING-YU CUI et al., 2017), entre otras.
En este trabajo se evaluó la influencia de cuatro factores sobre el rendimiento
en la extracción de antocianinas a partir de frutos de como empleando la
extracción asistida por micro maceración (EAMM) y utilizando la mezcla cloruro
de colina-ácido láctico como NaDES.
Material e métodos
Material Vegetal: Los frutos milpesillos fueron recolectados en la localidad de
El Paraíso, Carretera Simón Bolívar, municipio de Buenaventura, Valle del Cauca,
Colombia. Una vez colectados, se seleccionaron los frutos maduros (frutos con
color negrovioláceo), se lavaron y luego se desinfectaron, posteriormente, los
frutos fueron sumergidos en agua tibia (50 °C) para separar la semilla de la
parte comestible (endocarpio y mesocarpio). El material desengrasado se utilizó
como materia prima para los procesos de extracción.
Preparación del NaDES: El NaDES basado en cloruro de colina y ácido láctico se
preparó de acuerdo con el procedimiento reportado por DAI et al., (2013).
Análisis de parámetros de extracción: Se investigaron las contribuciones de
cuatro parámetros sobre el proceso de extracción de antocianinas a partir del
milpesillos mediante experimentos de un solo factor: razón muestra/solvente (30-
210 mg/mL), tiempo (10-120 min), contenido de agua en el NaDES (10-70%) y razón
molar AEH: DEH (1:1; 1:2; 1:3; 1:4). Las extracciones se realizaron mediante
EAMM en la cual se agregan los componentes en un microtubo junto con cinco
balines de acero inoxidable de 2 mm de diámetro, luego el sistema se somete a
agitación en un vortex. Una vez finalizada la extracción, los microtubos se
sometieron a centrifugación en mini centrifuga a 7500 RPM durante 15 minutos.
Por último, se recolectaron los sobrenadantes y se guardaron en ultracongelación
hasta su análisis.
Análisis espectrofotométrico: Todos los análisis se realizaron por triplicado y
se utilizó un lector de microplacas (Biotek Lx800, USA). El contenido de
antocianinas monoméricas (CAM) se utilizó como variable de respuesta y se
determinó mediante el método de pH diferencial (MÓNICA GIUSTI & WROLSTAD, 2005).
Resultado e discussão
La eficiencia de extracción de antocianinas monoméricas aumentó con el
incremento de la cantidad de la muestra desde 30 a 90 mg/mL (Figura 1a) debido
al aumento del gradiente de concentración y la cantidad de soluto que pudo
entrar en contacto con el disolvente (IBARZ & BARBOSA-CÁNOVAS, 2005); sin
embargo, al pasar los 90 mg/mL el contenido de antocianinas extraídas disminuye.
Como se puede observar en la Figura 1b, la cantidad máxima de antocianinas
monoméricas se obtiene en el rango de 10 - 40 min. Esto se debe, a que para
este tiempo contemplado se logra alcanzar un equilibrio entre la fase sólida y
la fase líquida (KHOO et al., 2017). Una vez aumentó el tiempo de extracción, la
eficiencia de antocianinas disminuyó probablemente como una consecuencia de la
degradación de las antocianinas.
En cuanto al contenido de agua en el NaDES, se puede observar que el máximo
rendimiento se obtiene en el rango de 50 y 70% de agua (Figura 1c). Esto es
debido a que las antocianinas son solubles en agua debido a su parte
glicosilada. Sin embargo, al incrementar la cantidad de agua, la eficiencia de
extracción de antocianinas monoméricas disminuyó, ya que un gran exceso de agua
puede romper los enlaces de hidrogeno entre los componentes del NaDES y perdería
toda propiedad eutéctica de los solventes, como fue observado por (MIGLIORATI et
al., 2019).
También investigamos la contribución del NaDES con diferente razón cloruro de
colina-ácido láctico (Figura 1d). La cantidad de antocianinas se incrementó con
una reducción cercana al 20% en el contenido de cloruro de colina. No obstante,
al aumentar la cantidad del ácido láctico, la eficiencia de extracción para las
antocianinas decrece significativamente.
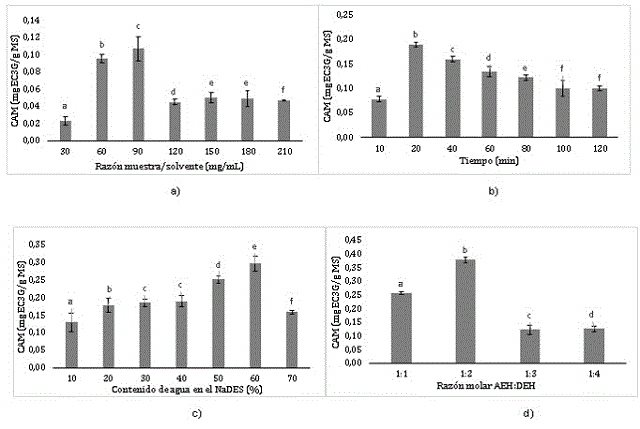
Efecto de factores sobre la extracción de antocianinas a partir de frutos maduros de milpesillos (o. mapora)
Conclusões
Los factores seleccionados en este estudio muestran una fuerte influencia en
cuanto al rendimiento de antocianinas. Los valores más altos obtenidos en cada uno
de los factores investigados, pueden ser utilizados para maximizar el rendimiento
de antocianinas e incluso para optimizar el proceso mediante aplicación de diseños
experimentales.
Agradecimentos
Los autores agradecen a la Universidad Santiago de Cali y a la Universidad del
Valle por su participación. Además, se agradece a la Universidad Nacional de
Colombia Sede Palmira por su partipación mediante el proyecto Hermes 49205
Referências
BEST, I., RENGIFO, H., VELARDE, E., LOJA, J. F., PORTUGAL, A., RENGIFO, P., AGUILAR, L., RAMOS-ESCUDERO, F., & MUÑOZ, A. M. (2021). Phenology of oenocarpus mapora h. Karst in low-terrace and high-terrace forests of the madre de dios region, Peru. Forests, 12(10). https://doi.org/10.3390/f12101424
CUNHA, V. M. B., SILVA, M. P. Da, SOUSA, S. H. B. De, BEZERRA, P. Do N., MENEZES, E. G. O., SILVA, N. J. N. Da, BANNA, D. A. D. Da S., ARAÚJO, M. E., & CARVALHO JUNIOR, R. N. de. (2019). Bacaba-de-leque (Oenocarpus distichus Mart.) oil extraction using supercritical CO2 and bioactive compounds determination in the residual pulp. Journal of Supercritical Fluids, 144, 81–90. https://doi.org/10.1016/j.supflu.2018.10.010
DAI, Y., WITKAMP, G.-J., VERPOORTE, R., & CHOI, Y. H. (2013). Natural Deep Eutectic Solvents as a New Extraction Media for Phenolic Metabolites in Carthamus tinctorius L. Analytical Chemistry, 85(13), 6272–6278. https://doi.org/10.1021/ac400432p
IBARZ, A., & BARBOSA-CÁNOVAS, G. (2005). Operaciones Unitarias en la Ingeniería de Alimentos. Ediciones Mundi-Prensa.
KHOO, H. E., AZLAN, A., TANG, S. T., & LIM, S. M. (2017). Anthocyanidins and anthocyanins: colored pigments as food, pharmaceutical ingredients, and the potential health benefits. Food & Nutrition Research, 61. https://doi.org/10.1080/16546628.2017.1361779
MIGLIORATI, V., SESSA, F., & D´ANGELO, P. (2019). Deep eutectic solvents: A structural point of view on the role of the cation. Chemical Physics Letters, 737, 100001.
MÓNICA GIUSTI, M., & WROLSTAD, R. E. (2005). Characterization and Measurement of Anthocyanins by UV-visible Spectroscopy. Handbook of Food Analytical Chemistry, 2–2, 19–31. https://doi.org/10.1002/0471709085.ch18
PALUNGWACHIRA, P., TANCHAROEN, S., PHRUKSANIYOM, C., KLUNGSAENG, S., SRICHAN, R., KIKUCHI, K., & NARARATWANCHAI, T. (2019). Antioxidant and Anti-Inflammatory Properties of Anthocyanins Extracted from Oryza sativa L. in Primary Dermal Fibroblasts. https://doi.org/10.1155/2019/2089817
PEREIRA, E., FERREIRA, M. C., SAMPAIO, K. A., GRIMALDI, R., MEIRELLES, A. J. De A., & MAXIMO, G. J. (2019). Physical properties of Amazonian fats and oils and their blends. Food Chemistry, 278, 208–215. https://doi.org/10.1016/j.foodchem.2018.11.016
SMITH, N. (2015). Oenocarpus mapora. In N. Smith (Ed.), Palms and People in the Amazon (pp. 421–428). Springer International Publishing.
TENA, N., MARTÍN, J., & ASUERO, A. G. (2020). State of the Art of Anthocyanins: Antioxidant Activity, Sources, Bioavailability and Therapeutic effect in Human Health. Antioxidants, 9(5), 451. https://www.mdpi.com/2076-3921/9/5/451
YING-YU CUI, C., LIN, B.-W., GONG, C.-C., SONG, H.-F., & CUI, Y.-Y. (2017). Effects of anthocyanins on the prevention and treatment of cancer LINKED ARTICLES. British Journal of Pharmacology, 174, 1226. https://doi.org/10.1111/bph.v174.11/issuetoc
ZANNOU, O., & KOCA, I. (2020). Optimization and stabilization of the antioxidant properties from Alkanet (Alkanna tinctoria) with natural deep eutectic solvents. Arabian Journal of Chemistry, 13(8), 6437–6450. https://doi.org/10.1016/j.arabjc.2020.06.002
















