Autores
Narcizo, J.P. (UNIVERSIDADE DE SÃO PAULO) ; Zani, A. (UNIVERSIDADE DE SÃO PAULO) ; Castro, A.S. (UNIVERSIDADE DE SÃO PAULO) ; Andrade, A.R. (UNIVERSIDADE DE SÃO PAULO) ; Reginatto, V. (UNIVERSIDADE DE SÃO PAULO)
Resumo
O glicerol, um subproduto da geração de biodiesel, pode ser utilizado por alguns
microrganismos como fonte de carbono com a formação de produtos de valor agregado,
tais como ácidos orgânicos 1,3-PDO. Neste trabalho o glicerol foi empregado como
substrato em BESs do tipo CCM para a geração de energia e a produção de
bioprodutos. Cepas de Pseudomonas aeruginosa produtoras de pigmento verde, EL6 e
EL14, foram empregadas como biocatalisadores em ânodos constituídos por tecido de
carbono. Ambas as cepas foram cultivadas em meio de cultura contendo 1 g L-1 de
glicerol e nutrientes. O compartimento do ânodo da CCM foi separado do cátodo por
uma membrana de troca de prótons.
Palavras chaves
pioverdina; 1,3-propanodiol; célula a combustível micr
Introdução
Nas últimas décadas tem se buscado alternativas à matriz energética baseada em
matérias-primas não renováveis, para geração de energia, combustíveis e produtos
a partir de recursos renováveis (CALEGARE et al, p. 40, 2011). A indústria do
biodiesel surgiu neste sentido, pois o produto é gerado pela transesterificação
de ácidos graxos e álcoois, ambos obtidos de recursos renováveis. Entretanto, o
crescimento da indústria do biodiesel tem gerado grande oferta de seu
subproduto, o glicerol (10% m/m). A utilização desse subproduto como fonte de
carbono por microorganismos capazes de metabolizá-lo, pode ser explorada em
processos biotecnológicos como por exemplo, na obtenção do 1,3-propanodiol (1,3-
PDO). Reagindo com ácido tereftálico, o 1,3-PDO fornece a valiosa fibra de
poliéster politrimetileno tereftalato (PTT). Descrita como o “novo nylon” esta
fibra oferece inúmeras vantagens adicionais sobre as fibras de nylon e poliéster
convencional, pois possui resistência química, estabilidade à luz, resistência
UV, recuperação elástica, toque mais macio e tingibilidade (PAGLIARO, p. 39,
2017)
O produto 1,3-PDO é altamente específico para fermentação do glicerol por alguns
microrganismos e não pode ser obtido a partir de qualquer outra conversão
anaeróbia (HOMANN et al, p. 121, 1990). Recentemente, espécies do gênero
Pseudomonas também foram relatadas por apresentarem metabolismo micro e
anaeróbio para bioprodução de 1,3-PDO a partir de glicerol (POBLETE-CASTRO et
al, p. 42, 2019).
Visando a produção sustentável de produtos químicos e combustíveis, sistemas
bioeletroquímicos que empregam a técnica conhecida como eletrossíntese
microbiana ou eletrofermentação tem sido alvo de pesquisas nas últimas décadas
(KRACKE e KROMER, p. 1, 2014). Um sistema bioeletroquímico (bioelectrochemical
system, BES), é um tipo de biorreator no qual processos biológicos e
eletroquímicos podem ocorrer para gerar eletricidade, hidrogênio e/ou outros
produtos de interesse. Inicialmente, a pesquisa com BES se concentrou na
produção de eletricidade em Células a Combustível Microbianas (CCMs) (MOSCOVIZ
et al, p. 856, 2016), mas recentemente tais sistemas têm sido vistos como uma
oportunidade de recuperar não somente energia, mas também produtos de valor
agregado (HALFELD et al, p.21251, 2022).
Em uma CCM os microorganismos presentes no compartimento anódico oxidam o
substrato e produzem elétrons, prótons e dióxido de carbono. Os elétrons são
recebidos pelo ânodo e transportados até o cátodo através de uma resistência
externa. Os prótons são transferidos para a câmara catódica através de uma
membrana trocadora de prótons, onde se combinam com oxigênio para formar água
(LOGAN et al, p. 5181, 2006). A proposta deste projeto é empregar duas cepas de
Pseudomonas aeruginosa isoladas de biofilmes eletrogênicos para metabolizar o
glicerol a 1,3-PDO em BES. Dessa forma, esta investigação visa contribuir como
uma estratégia para conversão de um subproduto da indústria do biodiesel em um
produto químico emergente, através dos princípios de eletrofermentação.
Material e métodos
Como biocatalizadores foram empregadas duas cepas de P. aeruginosa: EL6 e EL14
isoladas em nosso laboratório a partir de biofilmes em ânodos eletrogênicos de
CCM alimentada com glicerol (HALFELD et al, 2021).
Os sistemas bioeletroquímicos foram construídos em configuração do tipo L. Tais
sistemas são compostos por duas câmaras, onde uma possui capacidade para 40 mL e
a outra é aberta para o meio ambiente para a realização das trocas gasosas. O
eletrodo de trabalho onde foi crescido o biofilme eletroativo, consiste de um
tecido de carbono (3 x 3 cm) suspenso por um fio de platina. O contra-eletrodo é
um tecido de carbono de 16 cm2, do tipo camada difusora (Cloth GDE – 0,3mg/cm2
PtC 40%) presado junto a membrana trocadora de prótons (MTP) Náfion® 117
(Dupont). Um eletrodo de referência (Ag/AgCl, Cl- (sat)) foi colocado no sistema
bioeletroquímico para realização das análises eletroquímicas. Durante a operação
do sistema bioeletroquímico a diferença de potencial foi registrada a cada 15
minutos por uma placa micro controladora Arduino® Mega 2560, acoplada a um
computador e os dados são coletados em uma planilha de Excel.
Após a montagem do BES foi adicionado o meio de cultura descrito por Lovley e
Philips (1988) com 1 g L-1 de glicerol, seguido da adição do inóculo
correspondente a 10% (v/v) do volume do meio com a cultura de P. aeruginosa. No
decorrer do ensaio foram coletadas amostras do meio no compartimento anódico.
A concentração celular foi determinada pela leitura da densidade ótica das
amostras, em um espectrofotômetro a 600 nm e pela contagem de células viáveis
como Unidades Formadoras de Colônias (UFC). O glicerol, 1,3-PDO, ácido butírico
e ácido acético foram quantificados por cromatografia gasosa (CG) com detector
de ionização de chama (FID) e utilizando N2 como gás de arraste.
Análises de voltametria cíclica e curvas de polarização, com
potenciostato/galvanostato AUTOLAB PGSTAT 30.
Resultado e discussão
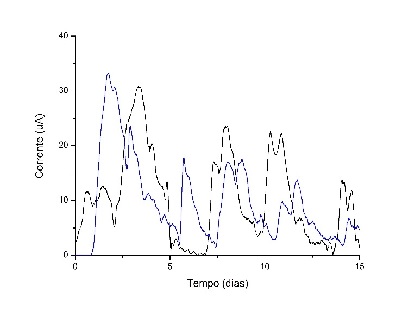
Ambas as cepas de P. aeruginosa geraram corrente elétrica quando empregadas como
biocatalisadores em CCMs (figura 1). Os ciclos de aumento e diminuição das
correntes são decorrentes de alimentação e consumo do glicerol. As correntes
máximas obtidas para as cepas EL6 e EL14 são 33 e 31 µA, respectivamente. Estes
resultados concordam com o relatado por Arkatkar et al, (p. 215, 2021) que
obtiveram corrente máxima de 36 µA com P. aeruginosa BR e glicose como principal
fonte de carbono.
As análises eletroquímicas de voltametria cíclica validaram a atividade
eletroquímica das cepas (figura 2). A presença das bactérias eletrogênicas
alterou o padrão dos voltamogramas abióticos, e foram obtidos picos de oxidação
e redução em aproximadamente 2,9 e – 3,0 V (EL6) e 3,1 e 0,0 V (EL14) nos
voltamogramas bióticos. Atribuir assinatura molecular para estes picos estava
fora do escopo desta investigação, mas podemos inferir que os sinais obtidos nos
voltamogramas indicam a transferência de elétrons mediada por moléculas redox-
ativas, provavelmente fenazinas, produzidas naturalmente por P. aeruginosa. A
faixa de oxi-redução destas moléculas encontra-se aproximadamente entre 0 e -
3,0 V (KRACKE et al, p. 11, 2015). No caso das cepas empregadas neste estudo
acredita-se que o mediador produzido seja da pioverdina, os espectros de
varredura apresentaram absorbância máxima na região de 400 nm (BARBHAIYA et al,
p. 234, 1985). A outra possível forma de transferência de elétrons refere-se à
transferência direta de curto alcance através dos citocromos A, que apresentam o
potencial de oxidação e redução em aproxidamente 3,0V (KRACKE et al, p. 11,
2015).
Depois que as CCMs com a cepa EL6 e com a EL14 apresentaram corrente elétrica
constante, a eficiência Coulômbica (EC) foi de 0,33% e 0,37%, respectivamente. A
oxidação do glicerol nas CCMs foi incompleta provavelmente devido à alta
resistência externa aplicada. Isto fez com que produtos de fermentação, ou seja,
o ácido acético e o 1,3-PDO fossem formados nas concentrações de 0,43 g L-1 e
1,1 g L-1 com EL6, e 0,27 g L-1 e 0,69 g L-1 com a EL14, respectivamente. Os
valores de EC são inferiores aos dados da literatura que relatam que a
eficiência média para CCMs varia entre 30 e 35% (HALFELD et al., 2022).
Entretanto, no citado trabalho foi empregado um consórcio microbiano, ao
contrário das culturas puras empregadas neste estudo. A Eficiência Coulômbica é
diminuída pela utilização de aceptores alternativos de elétrons pelas bactérias,
como alguns íons presentes no meio e o oxigênio. Outros fatores que reduzem a EC
são processos competitivos, crescimento bacteriano e o uso do substrato para a
fermentação (LOGAN et al, p. 5189, 2006).

Conclusões
As cepas EL6 e EL14 apresentam potencial como biocatalisadores em CCMs para
geração de corrente elétrica, e para metabolizar o glicerol a 1,3-PDO e ácido
acético no compartimento anódico de sistemas bioeletroquímicos, atribuindo um
perfil fermentativo não usual para P. aeruginosa. Trabalhos futuros contribuirão
para indagação dos BESs como eletrobiorreatores.
Agradecimentos
Agradecemos à FAPESP (Processos: 2014/50945-4, 2019/24916-0, 2021/010134-7,
2022/04024-0), à CAPES (88887136426/2017/00 ) e ao CNPq (INCT 465571/2014-0)
Referências
ARKATKAR, A.; MUNGRAY, A. K.; SHARMA, P. Study of electrochemical activity zone of Pseudomonas aeruginosa in microbial fuel cell. Process Biochemistry, v. 101, p. 213-217, 2021.
BARBHAIYA, H. B.; RAO, K. K. Production of pyoverdine, the fluorescent pigment of Pseudomonas aeruginosa PAO1. FEMS microbiology letters, v. 27, n. 2, p. 233-235, 1985.
CALEGARE, M. G. A., SILVA J., N. (2011). Progresso, Desenvolvimento Sustentável e abordagens diversas de desenvolvimento: uma sucinta revisão de literatura. Desenvolvimento e Meio Ambiente, 24. https://doi.org/10.5380/dma.v24i0.21528
HALFELD, G.G.; ALMEIDA, E. J. R.; REGINATTO, V.; ANDRADE A.R. Acclimatization of a microbial consortium into a stable biofilm to produce energy and 1,3-propanediol. International Journal of Hydrogen Energy, v. 47, n. 49, p. 21241-21252, 8 jun. 2022.
HOMANN T, TAG C, BIEBL H, DECKWER WD, SCHINK B. Fermentation of glycerol to 1,3- propanediol by Klebsiella and Citrobacter strains. Appl Microbiol Biotech 1990; 33:121–6.
KRACKE, F., KROMER, J. O. Identifying target processes for microbial electrosynthesis by elementary mode analysis. BMC Bioinformatics 15, 410 (2014).
KRACKE F., VASSILEV I., KROMER J. O. Microbial electron transport and energy conservation – the foundation for optimizing bioelectrochemical systems. Frontiers in Microbiology, v. 6, p. 1 – 18, 2015.
LOGAN B; HAMELERS, B. ROZENDAL, R.; SCHRODER, U; KELLER, J. FERGUIA, S.; AELTERMAN, P.; VERSTRAETE, W.; RABAEY, K. Microbial Fuel Cells: Methodology and Technology. ENVIRONMENTAL SCIENCE & TECHNOLOGY, v. 40, n. 17, p. 5181-5192, 2006.
PAGLIARO, M. Properties, Applications, History, and Market. In: GLYCEROL: The Renewable Platform Chemical. Palermo: Elsevier, 2017. cap. 1, p. 1-21. ISBN 9780128122051
POBLETE-CASTRO, IGNACIO, WITTMANN, CHRISTOPH, NIKEL, PABLO I. Biochemistry, genetics and biotechnology of glycerol utilization in Pseudomonas species. Microbial Biotechnology 2020; 1751-1915.
















