Autores
Castro, H.G.C. (SEEC-RN) ; Moura, M.F.V.M. (UFRN) ; Neto, M.H.L. (UFCG) ; Dantas, T.N.C. (UFRN)
Resumo
Este estudo trata da determinação da Concentração Micelar Crítica (CMC) em
soluções de dois tensioativos o cloreto de hexadecildimetilamônio (CTACl) e o
dodecilsufato de sódio (SDS). Foi utilizado como técnica analítica de
condutometria para obtenção das medidas de condutividade das soluções dos
tensiostivos individualmente, a partir das quais se construiu os gráficos em que
foram calculadas as respectivas CMCs. Como resultados obteve-se que a CMC para o
cloreto de hexadecidimetilamôonio (CTACl) foi 1,0 x 10-6 mM e para o
dodecilsulfato de sódio (SDS) foi de 1,4 x 10-6 mM.
Palavras chaves
CONCENTRAÇÃO MICELAR CRÍT; DODECIL SULFATO DE SÓDIO; CLORETO DE HEXADECILDIMET
Introdução
Os tensioativos são moléculas chamadas de anfifílicas, ou seja, que apresentam
característica de possuir uma região hidrofílica e uma região hidrofóbica. Além
disso, podem se associar espontaneamente em solução aquosa a partir de uma
determinada concentração micelar crítica (CMC). Acima da CMC, as moléculas do
tensioativo podem formar grandes agregados moleculares de dimensões coloidais,
os quais chamamos de micelas. Abaixo dessa concentração, o tensioativo é formado
predominante de monômeros. A CMC depende da estrutura do tensoativo, ou seja, do
tamanho da cadeia do hidrocarboneto e das condições do meio, como por exemplo:
concentração iônica, contra-íons, temperatura etc. As micelas podem ser
consideradas termodinamicamente estáveis e com maior potencial de se
multiplicar. A CMC pode ser determinada medindo-se a condutância de várias
soluções do tensioativo desde solução muito diluída para as mais concentradas,
medindo-se a variação do potencial elétrico. Pode-se também utilizar medidas de
outras propriedades físicas, como tensão superficial, espalhamento da luz,
dentre outras.
A CMC é uma propriedade que caracteriza um determinado tensioativo num meio
determinado. Mudanças estruturais, como no tamanho da cadeia hidrocarbônica e na
extremidade polar da molécula, assim como na natureza do contraíon e no conteúdo
iônico do meio, alteram o valor da CMC.
Material e métodos
Utilizou-se como tensioativos o CTACl e o SDS. A seguir é descrita síntese de um
dos tensioativos utilizados. Os cloretos e anidridos de ácidos são os reagentes
a que mais recorrem-se nas sínteses orgânicas. Os cloretos de sulfonila têm
importância como intermediários para a preparação de derivados funcionais tais
como as sulfonamidas, pois não se podem preparar diretamente a partir dos ácidos
sulfônicos. Os cloretos de sulfonila preparam-se pela ação do pentacloreto de
fósforo (PCl5) ou do cloreto de tionila (SOCl2) sobre ácidos sulfônicos ou
respectivos sais. A Figura 01 apresenta as reações para a síntese do SDS.
Num balão de três bocas, ajustadas conforme a Figura 02, foram misturados 14,5 g
de ácido canforsulfônico (MERCK) e 13,0 g de pentacloreto de fósforo (REAGEN). A
mistura foi mantida sob agitação suave e constante até quando não houvesse mais
aglomerados. Após decorrido o tempo reacional, o sistema foi mantido sob
agitação até que o pentacloreto de fósforo tivesse se dissolvido completamente.
A mistura foi conservada em repouso por quatro horas.
Numa série de béqueres contendo gelo picado entornou-se a mistura reacional no
primeiro, depois no segundo e, imediatamente no terceiro, procedeu-se à imediata
centrifugação de todos antes que a temperatura se elevasse em 10 oC. Quando
livre de toda a água, o produto obtido (sólido, brando, fino) foi levado a
refluxo com 10,0 g de dodecilamina e benzeno por uma hora, em seguida,
concentrado em rotavapor até que todo o solvente fosse eliminado. A purificação
do produto foi feita através de recristalização utilizando-se a mistura metanol-
água na proporção 28-22 mL, respectivamente. O produto final foi identificado
através da espectrofotometria do IV. Para obter a solução a 0,5 mol L-1 de SDS,
pesou-se 1,4409 g (MM do SDS = 288,18 g mol-1), dissolveu-se em água deionizada
e o volume foi completado para 0,010L. A partir desta solução procedeu-se às
diluições necessárias para a execução do trabalho a fim de obter-se 25,0 mL de
soluções nas concentrações de 0,005; 0,01; 0,02 e 0,04 mol L-1, para quais
partiu-se dos volumes respectivos de 0,25; 0,5; 1,0 e 2,0 mL da solução de SDS a
0,5 mol L-1. Este mesmo procedimento foi executado para obter-se as soluções de
CTACl, sendo que para a solução a 0,5 mol L-1 utilizou-se uma massa de 1,5975 g
(MM do CTACl = 319,5 g mol-1). Para todas as diluições utilizou-se água
deionizada. A solução de NaCl foi obtida pela dissolução de 35,1 g (MM do NaCl =
58,5 g mol-1), em água deionizada e completou-se o volume para 0,10 L para
obter-se a solução a 6,0 mol L-1. A partir desta solução procedeu-se à diluição
com água deionizada para obter 25,0 mL de uma solução a 1,0 mol L-1, para a qual
utilizou-se 4,2 mL da solução de partida. A solução de HCl foi preparada a
partir da solução P.A. (T = 37% e d = 1,19 g cm-3), desta solução utilizou-se 42
mL para obter-se 0,1 L de solução a 5 mol L-1. Utilizou-se 2,5 mL da solução a 5
mol L-1 e dilui-se com água deionizada.
Resultado e discussão
A Tabela 01 apresenta as faixas de números de onda onde as absorções ocorreram nos
espectros obtidos na região do infravermelho.
Para a determinação da CMC construiu-se gráficos de condutância versus
concentração para as medidas de condutâncias obtidas para as soluções de SDS e
CTACl. Para a obtenção das medidas de condutância utilizou-se um condutivímetro da
marca Metrohm 912, a partir da adição dos volumes descritos na Tabela 02, com
soluções obtidas por diluição em água deionizada (0,18 μS cm-1) com um volume
final de 30,0 mL, descontando-se a condutância da água e partindo-se de solução do
tensioativo a 0,50 mM. Nas Tabelas 02 e 03 apresentam-se, respectivamente, os
resultados de condutâncias medidos para as soluções de SDS e de CTACl a diversos
valores de concentração.
As Figuras 03 e 04 apresentam, respectivamente, a determinação da concentração
micelar crítica para o SDS e para o CTACl, essa representação gráfica foi obtida
por uso dos dados apresentados, respectivamente, nas Tabela 02 e 03.
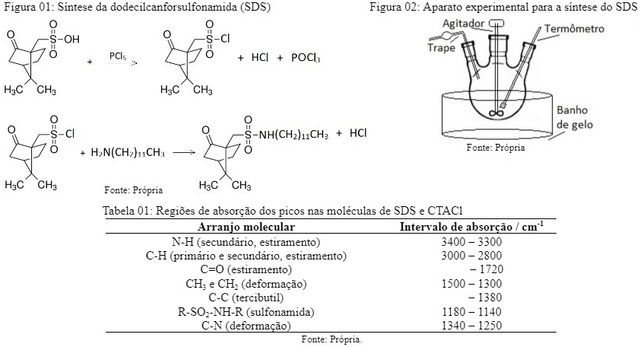
Figura 01: Reações para a síntese do SDS. Figura 02: Aparatos para o experimento da síntese do SDS. Tabela 01: Regiões de absorção (SDS e CTACl).
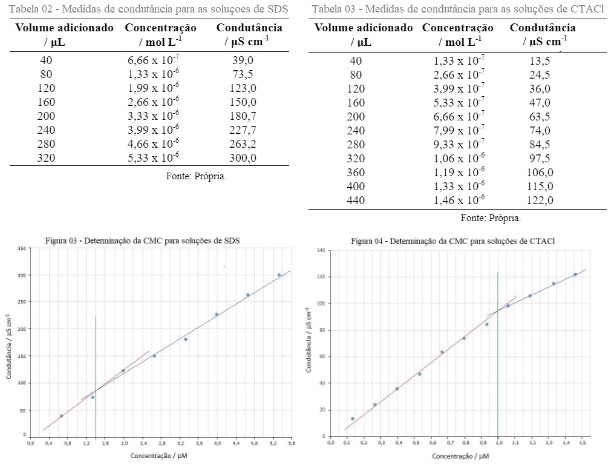
Nas Tabelas 02 e 03: Medidas de condutância para o SDS e CTACl. As Figuras 03 e 04, determinação da concentração micelar crítica para o SDS e CTACl.
Conclusões
Conforme os resultados apresentados nas Figura 03 e 04 e plotados nas Figuras 03 e
04, a partir da intersecção das retas relativas aos valores de condutâncias quando
se variou as concentrações de tensioativo, as CMCs obtidas para SDS foi de 1,4 x
10-6 mM e para CTACl foi de 1,0 x 10-6 mM.
Agradecimentos
Ao CNPq pelas bolsas concedidas.
Referências
McMURRY, J., Química Orgânica vol. 1 e vol. 2. Editora CENGAGE Learning. Tradução da 6ª Edição Norte Americana, 2008.
SOLOMONS, T. W. Graham; Fryhle, Craig B. Química Orgânica, vol. 1 e 2. 9 ed. LTC, 2009.
HARRIS. D. C. Análise Química Quantitativa, LTC, 6ª ed., 2005.
CABRAL. B. V. Hidrólise da Sacarose por Invertase Imobilizada em Duolite A-568 por Adsorção e Ligação Cruzada. Dissertação de Mestrado: Programa de Pós-Graduação em Engenharia Química, Universidade Federal de Uberlândia, 2012.
MORAES. S. L.; REZENDE. M. O. O. Determinação da Concentração Micelar Crítica de Ácidos Húmicos por Medidas de Condutividade e Espectroscopia. Instituto de Química de São Carlos, Universidade de São Paulo. Química Nova, Vol. 27, No. 5, 701-705, 2004.
YIHWA. C. Reatividade Química e Fotoquímica em Agregados de Tensoativos em Água/Acetonitrila. Tese de Doutorado: Instituto de Química, Universidade de São Paulo-USP, 2004, p.100.
ARAÚJO. C. K. C. Avaliação da Influência de Surfactantes Químico e Biológico na Hidrólise Enzimática de Casca de Coco Verde Após Pré-Tratamento Ácido/Alcalino e com Peróxido de Hidrogênio Alcalino. Dissertação de Mestrado: Programa de Pós-Graduação em Engenharia Química. Universidade Federal do Rio Grande do Norte-UFRN. Departamento de Engenharia Química, 2016, p.91.
















