Autores
Pereira, J. (UFRJ) ; Kelber, N. (UFRJ) ; Lombardo, M. (UFRJ) ; Barros, A. (UFRJ) ; Gomes, A.B. (UFRJ) ; Nele, M. (UFRJ)
Resumo
O petróleo brasileiro apresenta níveis altos de ácidos nafténicos, elevando a
acidez do petróleo, levando a corrosão de dutos e equipamentos nas refinarias.
Com isso, o objetivo deste trabalho é de desenvolver uma metodologia de
neutralização de petróleos ácidos e verificar a influência da adição de base no
preparo de emulsões. Onde minimizar os ácidos no petróleo contribui para a
obtenção de produtos de refino de maior qualidade e conservação dos equipamentos
na refinaria. A análise do FTIR após a neutralizar o óleo modelo mostrou que a
banda característica do ácido desapareceu, mostrando que o método foi eficiente.
A mesma metodologia foi aplicada nos óleos ácidos, onde a adição da base formou
emulsões mais estáveis, sendo necessários melhorar a metodologia de
neutralização do petróleo.
Palavras chaves
Petróleos ácidos; nautralização; emulsões
Introdução
Os poços de petróleo da América do Sul estão entre os mais ácidos do mundo e,
dentre eles, os petróleos brasileiros têm como características baixo grau API
(<20º), alta viscosidade e elevada concentração de ácidos orgânicos com anéis
saturados e grupamentos carboxila em sua estrutura (GRUBER et al, 2012).
O petróleo brasileiro apresenta um índice de acidez bastante elevado, sendo esta
acidez responsável pela corrosão de dutos e equipamentos nas refinarias.
Portanto, há uma necessidade crescente em criar mecanismos que minimizam as
espécies ácidas, representando assim um grande desafio para a indústria de
petróleo (GRUBER et al, 2012; BRIENT, 1995).
Tais ácidos orgânicos, denominados ácidos naftênicos, possuem variadas massas
molares, e são atribuídos a eles uma fórmula geral cujo radical é geralmente um
ou mais anéis de ciclopentano ou ciclohexano com alguma cadeia alílica lateral,
e é geralmente maior que 12 carbonos. Entretanto, o termo “ácido naftênico” é
usado de forma ampla para descrever todos os ácidos carboxílicos presentes no
óleo bruto, incluindo os ácidos aromáticos e acíclicos (ZHANG et al., 2006,
SLAVCHEVA et al., 1999, HAVRE et al., 2003).
Devido aos petróleos brasileiros possuírem quantidades elevadas de ácido
nafténico e consequentemente serem considerados petróleos com uma acidez
elevada, o objetivo deste trabalho é de desenvolver uma metodologia simples de
neutralização de petróleos ácidos em escala de bancada, que pudesse ser
facilmente adaptada para escalas maiores e verificar a influência da
neutralização do petróleo no preparo de emulsões. Onde o controle da quantidade
de ácidos no petróleo contribui tanto para a obtenção de produtos de refino de
maior qualidade quanto para a manutenção e conservação dos equipamentos
envolvidos no processo.
Material e métodos
Inicialmente fez-se a homogeneização das amostras de petróleo a 80°Cem estufa
por 2 horas e aplicando-se agitações manuais vigorosas a cada 30 minutos. Esse
processo foi executado a cada amostragem para garantir a reprodutibilidade dos
procedimentos realizados.
Os experimentos foram realizados utilizando o óleo cedidos pela Petróleo
Brasileiro S.A., para o Engepol. A composição SARA e o grau API do óleo também
foi fornecido pela Petróbras. No Engepol, foi análise de Teor de água,
utilizando o método de Karl Fischer seguindo a ASTM-D4377 e Índice de acidez
total (IAT), seguindo a ASTM-D664. Ambas as caracterizações foram realizadas no
titulador potenciométrico 836 Titrando, da Metrohm.
Para ajustar as condições de neutralização das amostras ácidas, foi utilizado
100g de uma amostra modelo contendo 3% p/p de ácido naftênico comercial em
vaselina líquida (IAT ≈ 8 mg KOH/g amostra). E 1mL da solução de NaOH 8 mg/mL
foi gotejada no óleo quente (80°C), para a reação ocorrer 1:1
estequiometricamente, e sob agitação (400 rpm com uma hélice agitadora com
propulsor R e 4 lâminas), e o sistema permaneceu em reação por 1 hora e,
posteriormente, deixado resfriar naturalmente por 30 minutos ainda sob agitação.
Para conferir se a reação de neutralização ocorreu como esperado, foram feitas
análises de FT-IR antes e após a reação de neutralização, para verificar o
desaparecimento da banda de C=O de ácidos carboxílicos.
Estabelecida a metodologia de neutralização com a amostra modelo, o óleo A
seguiu o protocolo de neutralização como o informando anteriormente, mas
modificou-se as quantidades de NaOH para tentar melhorar a neutralização do
petróleo. Após a neutralização do petróleo, foram realizadas emulsões com 50% de
água, utilizando turrax a 8 mil RPM por 3 min a temperatura ambiente.
Resultado e discussão
A neutralização do óleo modelo foi realizada como descrito acima. Após cessar a
agitação e o aquecimento do óleo modelo, pôde-se observar a decantação de uma
fase líquida amarelada bastante viscosa (sal de naftenato) insolúvel no óleo.
Pelos espectros de FTIR, verificou-se o desaparecimento da banda de C=O na
região de 1700 cm-1, onde foram feitas duas análises de FTIR, uma antes da
neutralização e outra após 1 horas de reação (Figura 1).
O óleo utilizado para esses experimentos é um óleo pesado, com alto
índice de acidez (IAT = 1,16 mg KOH/g), bastante viscosos (34 mPa.s a 30°C, 6
mPa.s a 60°C e 3 mPa.s a 80°C) e com baixo teor de água (abaixo de 1%). O óleo
para ser considerado ácido ele precisa ter um índice de acidez total (IAT) acima
de 0,5 mg KOH/g, a partir dessa referência, o óleo usado nesse estudo é
considerado ácido (ZEINALOV, 2009).
Após a neutralização é possível observar que, no espectro do óleo A, não houve o
desaparecimento da banda de ácidos carboxílicos na região de 1700 cm-1 (Figura
2), mostrando que o procedimento de neutralização para o óleo pode não ser tão
eficiente do que para a emulsão modelo. Mesmo alterando a quantidade de base no
óleo, não foi possível verificar o desaparecimento da banda de C=O.
Mesmo a neutralização não sendo tão eficiente, pode-se notar que após realizar
emulsões com 50% de A/O, com quantidade de base diferentes, modifica a
estabilidade da emulsão e quanto maior a quantidade de base no óleo, pior fica a
interface dele com a água (figura 3). Isto ocorre devido a formação de sais de
naftenatos em fase aquosa devido a base reagir com ácidos do óleo e estes sais
são responsáveis por sensíveis variações na estabilidade das emulsões, já que se
acumulam na interface A/O, modificando suas propriedades (GRUBER et al, 2012).

Espectro de FTIR do óleo modelo e do petróleo antes e depois da neutralização.
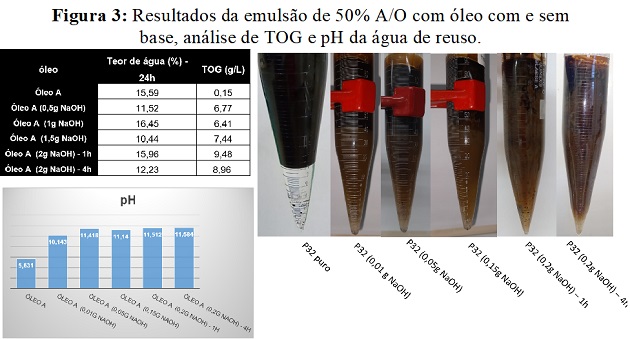
Resultados das emulsões com 50% de água antes e depois da neutralização.
Conclusões
Pode-se concluir que a metodologia foi eficiente para a reação de neutralização do
óleo modelo. No FTIR, pôde-se confirmar que a reação ocorreu devido às
modificações nos espectros. Para os óleos, ainda é necessário melhorar as
condições de temperatura e agitação utilizadas neste trabalho para conseguir
melhor eficiência de neutralização dos óleos. Também foi possível notar que a
adição de base faz com que forme emulsões mais estáveis e com interfaces menos
definidas, sendo necessários melhorar a metodologia de neutralização do petróleo
para evitar também, evitando base livre na água de reuso.
Agradecimentos
A Petrobras pelo envio de amostras e colaboração no desenvolvimento de projetos
com o Grupo Engepol.
Referências
BRIENT, J. A., WESSNER, P. J., DOLY, M. N. Naphthenic acids, fourth ed.. In: Kroschwitz, J.I. (Ed.), Encyclopedia of Chemical Technology, vol. 16 John Wiley, New York, p. 1017–1029, 1995.
GRUBER, L. D. A., DAMASCENO, F. C., CARAMÃO, E. B., JACQUES, R. A., GELLER, A. M., CAMPOS, M. C. V. D. “Ácidos naftênicos no petróleo” Química Nova, v. 35, n. 7, p. 1423-1433, 2012.
HAVRE, T. E., SJOBLOM, J., VINDSTAD, J. E. “Oil/water‐partitioning and interfacial behavior of naphthenic acids” Journal of dispersion science and technology, v. 24, n. 6, p. 789-801, 2003.
SLAVCHEVA, E., SHONE, B., TURNBULL, A. “Review of naphthenic acid corrosion in oilrefining” British Corrosion Journal, v. 34, n. 2, p. 125-131, 1999.
ZHANG, A., MA, Q., WANG, K., LIU, X., SHULER, P., TANG, Y. “Naphthenic acid removal from crude oil through catalytic decarboxylation on magnesium oxide” Applied Catalysis A: General, v. 303, n. 1, p. 103-109, 2006.
ZEINALOV, E. B., Abbasov, V. M. & Alieva, L. I. Petroleum acids and corrosion. Pet. Chem. 49, 185–192 (2009).
















