Autores
Machado, J. (INSTITUTO FEDERAL DE BRASILIA - FACULDADE DE QUÍMI) ; Michereff, M. (EMBRAPA RECURSOS GENÉTICOS E BIOTECNOLOGIA) ; da Silva, S. (EMBRAPA RECURSOS GENÉTICOS E BIOTECNOLOGIA) ; Laumann, R. (EMBRAPA RECURSOS GENÉTICOS E BIOTECNOLOGIA) ; Borges, M. (EMBRAPA RECURSOS GENÉTICOS E BIOTECNOLOGIA) ; Khrimian, A. (USDA-ARS, EUA) ; Barrigossi, J. (EMBRAPA ARROZ E FEIJÃO) ; Blassioli-moraes, M. (EMBRAPA RECURSOS GENÉTICOS E BIOTECNOLOGIA)
Resumo
O objetivo deste trabalho foi identificar o feromônio sexual do percevejo G.
spinosa e avaliar o potencial desse feromônio para uso no manejo no campo. Para
isso, foram conduzidas aerações com machos e fêmeas. Os extratos de aeração
foram analisados por GC-DIC e CG-EM e fracionados em coluna de sílica gel usando
solventes de diferentes polaridades. Para avaliar qual sexo é o produtor de
feromônio foram conduzidos bioensaios em olfatometria em Y com insetos vivos, e
para avaliar o potencial de atração do feromônio foram conduzidos bioensaios com
os extratos de aeração, frações do extrato de aeração e soluções sintéticas A
análise química dos extratos de aeração mostrou que os machos de G. spinosa
produzem como feromônio sexual dois isômeros do zingiberenol e dois isômeros do
sesquipiperitol
Palavras chaves
ecologia química; estereoquímica; semioquímicos
Introdução
O arroz é uma das principais culturas no mundo sendo um alimento de grande
importância para as populações mais desfavorecidas, tendo um consumo mundial
concentrado nos países asiáticos e no Brasil, o consumo médio no mundo é de
54kg/pessoa/ano e o Brasil se destaca com um consumo média de 32kg/pessoa/ano.
Uma preocupação que vem crescendo nas lavouras principalmente nas regiões
Centro-oeste e Norte é o ataque do Glyphepomis spinosa Campos & Grazia
(Hemiptera: Pentatomidae), um percevejo praga do arroz, que causa dano de
herbivoria no colmo das plantas. Atualmente o único método de controle dos
percevejos é através do uso de agrotóxicos, que apresenta riscos ambientais além
de ter alto custo para o agricultor. O fato do percevejo G.spinosa ser um inseto
que ataca o colmo das plantas de arroz e o hábito de se alojar na base das
plantas dificulta que esse seja atingido pelos inseticidas. Dessa forma, é
essencial conduzir estudos visando encontrar outras ferramentas para o manejo e
controle de insetos praga na agricultura. Uma estratégia para o manejo dessa
praga é o uso de semioquímicos, que são substancias químicas produzidas por
organismos que modificam o comportamento de outros seres vivos. Dentre os
semioquímicos os feromônios vem sendo bastante utilizados na agricultura com
sucesso para várias pragas. Os feromônio são biodegradáveis, já estão presentes
na natureza, não agem sobre organismos não alvo, como inimigos naturais ou
polinizadores, são ativos em quantidades diminutas, como poucas nanogramas por
hectare. Dentro desse contexto, feromônios de insetos podem ser utilizados como
ferramentas sustentáveis e eficientes para o controle de insetos-praga na
agricultura. Assim, o objetivo desse trabalho foi identificar e avaliar se o
feromônio sexual do G. spinosa teria potencial para ser usado no seu
monitoramento ou controle.
Material e métodos
Os insetos G. spinosa foram obtidos de uma colônia de laboratório a partir de
adultos coletados em lavouras de arroz durante os anos em Santo Antônio de Goiás
- GO, Brasil. Coleta de voláteis Os voláteis foram coletados de 50 machos e 50
fêmeas de G. spinosa por aeração . O fluxo de ar dentro da câmera foi
estabelecido através de uma bomba de vácuo a um fluxo de 1 L min-1. As aerações
foram mantidas continuamente por 10 dias trocando os tubos adsorventes
diariamente. Os adsorventes foram eluídos a cada 24 horas com hexano (0,5 mL) e
foram concentradas sob fluxo de nitrogênio até 50 µL.Análise química dos
extratos de aeração. Os voláteis coletados foram analisados por cromatografia
usando uma coluna de 60 m × 0,25 mm de diâmetro interno e 0,25 µm de espessura
de filme (DB-5MS). A temperatura do forno foi mantida a 50°C por 2 min e
programada de 5°C min-1 até atingir 180°C, depois 10°C min-1 até atingir 250°C e
mantida por 20 min. O gás de arraste usado foi hélio. O efluente da coluna foi
analisado com um detector de ionização de chama a 270 °C. Para análise
qualitativa extratos de aeração selecionados foram analisados por uma
cromatografia gasosa acoplada a um detector de espectrometria de massas equipado
com um analisador quadrupolar, coluna DB-5MS (30 m × 0,25 mm de diâmetro interno
e 0,25 µm de espessura de filme; e um injetor no modo splitless com hélio como
gás de arraste. A ionização foi por impacto de elétrons. Foi usado o mesmo
programa de temperatura da análise por CG-DIC. Análises de GC em colunas quirais
Para elucidar as configurações absolutas dos dois estereoisômeros de 1,10-
bisaboladien-3-ol produzidos por machos de G. spinosa, padrões de referência e
amostras de aeração dos machos foram analisados usando duas colunas de GC
quirais: Hydrodex-β- 6TBDM (30 m x 0,25 mm de diâmetro interno, 0,25 µm de
espessura de filme) e Lipodex γ (30 m x 0,25 mm de diâmetro interno, 0,25 µm de
espessura de filme), ambos da Macherey-Nagel GmbH & Co. KG. Bioensaios do
olfatômetro Foram realizados três conjuntos de bioensaios: o primeiro conjunto
de bioensaios foram conduzidos com insetos vivos como fonte de odor. Avaliou-se
a resposta de machos e fêmeas para o odor de coespecificos vivos. O segundo
conjunto foi conduzido com os extratos de aeração contendo os voláteis e machos
e fêmeas e com as frações do extrato dos machos. O terceiro foi conduzido usando
soluções hexânicas de padrões sintéticos Para cada bioensaio, uma fêmea foi
liberada na base do olfatômetro de tubo em Y e seu comportamento foi observado
por 10 minutos. A primeira escolha foi registrada. Os dados da resposta de
primeira escolha de fêmeas de G spinosa a cada tratamento nos bioensaios do
olfatômetro de tubo em Y foram analisados teste Qui-quadrado. As análises
estatísticas foram realizadas com o R 3.0.1 (R Development Core Team, 2009).
Resultado e discussão
As análises de GC dos extratos de aeração de machos e fêmeas de G. spinosa
mostraram que apenas os machos produziram os dois isômeros de 1,10-bisaboladien-
3-ol) (Fig 1 picos 14 e 15). O isômero cis de 1,10-bisaboladien-3-ol eluiu
primeiro da coluna DB-5MS seguido pelo isômero trans (Fig. 2), como foi
demonstrado em estudos anteriores (Khrimian et al. 2014 a,b; Khrimian et al.
2015, Blassioli-Moraes 2021). Comparando as áreas de pico dos dois isômeros no
cromatograma de GC, a razão dos cis- e trans-1,10-bisaboaldien-3-ols foi de
aproximadamente 7:3. Além dos isômeros de 1,10-bisaboaldien-3-ols outros
sesquiterpenos (pico 16, Fig. 1) foram identificados nas amostras. Os picos 10,
11,12 e 13 também estavam presentes somente nos extratos de macho, no entanto
esses compostos foram formados da decomposição do sesquipiperitol 1,10-
bisaboaldien-3-ol no injetor do GC. Para elucidação da configuração absoluta do
isômero cis-1,10-bisaboladien-3-ol foi injetado o extrato de machos e comparado
o tempo de retenção desse isômero com os quatro possíveis estereoisômeros do
cis-1,10-bisaboladien-3-ol. O isômero cis-1,1-bisaboladine-3-ol presente no
extrato do macho resolveu com o isômero SSR (Fig 2 A) usando a coluna Hydrodex
β-6TBDM. Quando comparou o isômero cis-1,1-bisaboladine-3-ol do macho com os
estereoisiômeros SSS e RRS na coluna Hydrodex β-6TBDM não houve uma boa
resolução do isômero SSS (Fig 2 B). Assim, utilizamos uma outra coluna Lipodex
, e confirmou-se que o isômero cis-1,10-bisaboladien-3-ol produzido por G.
spinosa tem a configura SSR (Fig 2C). O isômero trans-1,10-bisaboladien-3-ol
produzido pelos machos de G. spinosa foi confirmado como RSR 5 na análise quiral
em uma coluna Hydrodex-β-6TBDM (Fig. 2 D). Bioensaios de olfatometria. Machos
virgens de G spinosa não mostraram diferença na escolha dos braços do
olfatômetro quando expostos ao odor de fêmeas contrastado com ar (2 = 0.61, P =
0.43), ou ao odor de machos vivos contrastado com ar (2 = 0.33, P = 0.94), já
as fêmeas mostraram uma preferência significativa ao braço do olfatômetro com o
odor de machos quando contrastado com ar (2 = 16, P 0.001), e não
distinguiram o odor de fêmeas vivas contrastado com o ar (2 = 2.61, P = 0.122).
As fêmeas de G. spinosa mostraram preferência para o braço do olfatômetro com a
alíquota de 1 I.E do extrato de aeração dos machos quando comparado com hexano
(2 = 9, P = 0.003). Quando se avaliou as respostas das fêmeas as frações
obtidas do extrato de machos, as fêmeas mostraram preferência para as frações
contendo hidrocarbonetos (2 = 5.4, P = 0.02), mas não para as frações contendo
aldeídos e álcoois (2 = 1.7, P = 0.19) quando contrastado com hexano, e
mostraram preferência para a fração do extrato contendo o 1,10-bisaboladien-3-ol
(Zingiberenol) + sesquipiperitol (2 = 9.96, P = 0.002) quando contrastados com
hexano. Quando se contrastou os compostos sintéticos as fêmeas mostraram
preferência para o braço do olfatômetro com zingiberenol racêmico contrastado
com hexano (2 = 16, P 0.001), mas não mostraram preferência quando o
zingiberenol racêmico foi contratado com zingiberenol racêmico + sesquipiperitol
(2 = 1.12, P = 0.28). As fêmeas mostraram preferência para o braço com
zingiberenol em relação ao braço do olfatômetro tratado com a fração de
hidrocarbonetos (2 = 6.6, P = 0.01), mas não foram capazes de distinguir os
odores quando se contrastou fra hidrocarbonetos + zingiberenol com fração de
zingiberenol (2 = 0.25, P = 0.61). As fêmeas responderam preferencialmente para
soluções sintética preparadas com os isômeros de zingiberenol SSR e RSR
comparado ao hexano (2 = 6.4, P = 0.01) e de sesquipiperitol SSR e RSR
comparado ao hexano (2 = 6.1, P = 0.01). Não houve diferença significativa na
escolha das fêmeas quando estas foram expostas aos odores de zingiberenol SSR e
RSR comparado com os odores de sesquipiperitol SSR e RSR (2 = 0.71 P =
0.39), e zingiberenol SSR e RSR comparado com zingiberenol SSR e RSR +
sesquipiperitol SSR e RSR (2 = 2.4, P = 0.12). Os resultados dos bioensaios
mostraram que os hidrocarbonetos, mesmo contendo os específicos do macho, como
α-zingiberno, α-curcumeno e β-sesquifelandreno, e outros comuns aos dois sexos,
como tridecano e dodecano, não fazem parte do feromônio dos machos. Os
resultados mostraram claramente que os compostos zingiberenol SSR e RSR e os
dois isômeros de sesquipiperitol fazem parte do feromônio sexual da espécie,
sendo produzidos pelos machos com a função atrativa para as fêmeas.

Perfil cromatográfico do GC-EM de amostras de aeração de G. spinosa
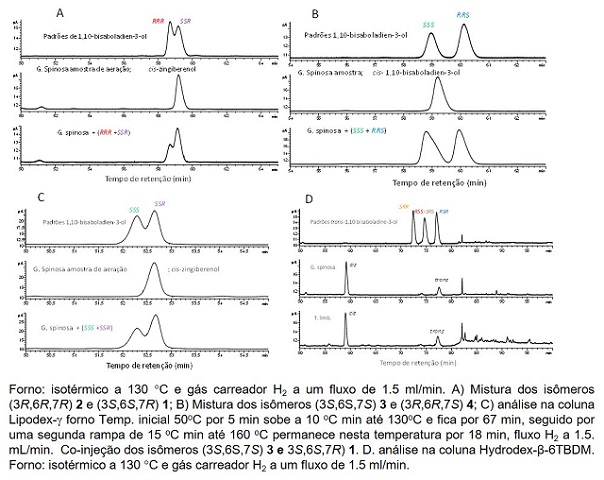
Segmentos do CG_EM A, B e D análise na coluna Hydrodex-β-6TBDM e C Lipodex-.
Conclusões
Nosso estudo mostrou que machos de G. spinosa produzem quatro substâncias
químicas: (3S,6S,7R)- e (3R,6S,7R)-1,10-bisaboladien-3-ols (zingiberenóis), e dois
isômeros de 2,10-bisaboladien-1-ol (sesquipiperitol) como componentes de feromônio
sexual. A composição do feromônio de G. spinosa é extamente igual à do feromônio
de T. limbativentris, não havendo diferença nem na proporção entre os componentes,
nem na estereoquímica da molécula. Essa redundância também ocorre em algumas
espécies dos gêneros de percevejos Nezara (Borges, 1995) e Chinavias, mas neste
caso há uma diferença na proporção entre os componentes. Entre T. limbativentris
(Blassioli-Moraes et al., 2020, Borges et al., 2006) e G. spinosa nem a proporção
entre os componentes foi diferente, pode ser que haja outros compostos
minoritários que não foram detectados que garantam a especificidade das espécies
ou que, como as espécies não ocorrem ao mesmo tempo no campo, não exista
interferência na comunicação entre estas espécies na natureza. Estudos futuros
poderiam conduzir bioensaios em laboratório para avaliar se fêmeas de G. spinosa
são atraídas pelos machos de T. limbativentris. Além disto os feromônios sexuais
de G. spinosa e T. limbativentris compartilham a mesma configuração absoluta de
6S,7R. (3S,6S,7R)-1,10-Bisaboladien-3-ol (1) com os feromônios de agregação M.
histrionica e H. halys, (Khrimian et al., 2014a,b).
Agradecimentos
Este trabalho recebeu apoio financeiro do Conselho Nacional de Desenvolvimento
Científico e Tecnológico (CNPq), Fundação de Amparo à Pesquisa do Distrito Federal
(FAP-DF) e Empresa Brasileira de Pesquisa Agropecuária (EMBRAPA).
Referências
Alves TM, Machado CDS, Souza RDO., Quintela ED, Barrigossi, J. A. F. (2010). Biologia e dano de Glyphepomis spinosa (heteroptera: pentatomidae) em arroz (Oryza sativa L.).
Borges M (1995) Attractant compounds of the southern green stink bug, Nezara viridula (L.) (Heteroptera: Pentatomidae). An Soc Entomol Bras 24: 215-225.
Borges M, Birkett M, Aldrich JR, Oliver JE, Chiba M, Murata Y, Laumann RA, Barrigossi JA, Pickett JA, Moraes. MCB. (2006) Sex attractant pheromone from the rice stalk stink bug, Tibraca limbativentris Stal. J Chem Ecol 32: 2749–2761.
Rosa RMP, Silva PD, Barrigossi JAF. (2021). Antixenose de cultivares de arroz a Glyphepomis spinosa (Hemiptera: Pentatomidae). In Embrapa Arroz e Feijão-Resumo em anais de congresso (ALICE). In: SEMINÁRIO JOVENS TALENTOS, 14., 2020, Santo Antônio de Goiás. Resumos... Santo Antônio de Goiás: Embrapa Arroz e Feijão, 2021.
Rossini MC. Qual é a origem dos alimentos mais consumidos do mundo? Super interessante. (2022) Disponível em: < https://super.abril.com.br/coluna/oraculo/qual-e-a-origem-dos-alimentos-mais-consumidos-do-mundo/#:~:text=Segundo%20a%20Organiza%C3%A7%C3%A3o%20das%20Na%C3%A7%C3%B5es,carne%20de%20porco%20e%20mandioca.> Acesso em: 25 de agosto de 2022.
Ulhoa LA. Influência de semioquímicos emitidos por plantas de arroz no comportamento de Tibraca limbativentris, Glyphepomis spinosa (Heteroptera: Pentatomidae) e Telenomus podisi (Hymenoptera: platygastridae). 2018. 81 f. Dissertação (Mestrado em Agronomia) - Universidade Federal de Goiás, Goiânia.
Khrimian A, Shirali S, Vermillion KE, Siegler MA, Guzman F, Chauhan K et al. (2014a) Determination of the stereochemistry of the aggregation pheromone of harlequin bug, Murgantia histrionica. J Chem Ecol 40: 1260–1268.
Khrimian A, Zhang A, Weber DC, Ho HY, Aldrich JR, Vermillion KE, et al. (2014b) Discovery of the aggregation pheromone of the brown marmorated stink bug (Halyomorpha halys) through the creation of stereoisomeric libraries of 1-bisabolen-3-ols. J Nat Prod 77: 1708–1717.
















