Autores
Costa, D.L. (IFSERTÃO-PE) ; Sousa, I.L. (IFSERTÃO-PE) ; Silva, I.J.G. (IFSERTÃO-PE)
Resumo
Objetivou-se com este trabalho usar o vermelho de metila (VM) como molécula
modelo no estudo de azobenzenos, obtendo seus espectros UV-Vis sob diferentes
pH, fazendo também uma investigação computacional para a obtenção de estruturas
moleculares e seus espectros calculados, a fim de contribuir para um maior
entendimento do equilíbrio ácido-base associado ao VM. Todos os cálculos foram
realizados com o nível de teoria B3LYP/6-31G(d,p), e realizados com software
Gaussian 09. Os efeitos de solvente foram quantificados via teoria de solvatação
baseada na densidade (SMD). Observou-se que quando o pH decresce de 13,0 para
1,0 o λmáx é deslocado de 430 nm para 520 nm. Entretanto, em intervalos
intermediários de pH coexistem estruturas, dificultando assim a interpretação
espectral precisa.
Palavras chaves
vermelho de metila; pH; química computacional.
Introdução
Umas das propriedades mais importantes no estudo do azobenzeno e seus derivados
são seus espectros na região Ultravioleta-Visível (UV-Vis). Com a finalidade de
entender o comportamento de um sistema e complementar as investigações
experimentais, muitos estudos têm feito uso da química computacional na predição
de espectros UV-Vis, os quais são poderosos aliados na interpretação de seus
análogos experimentais (ZHENG, YUAN, MA, 2016; COSTA et al, 2008).
No caso especial do Vermelho de metila (VM), vários trabalhos experimentais têm
sido publicados investigando o efeito da acidez, da alcalinidade e do solvente
nas características espectrais, no entanto não há consenso a respeito do
equilíbrio e das espécies presentes, e poucos trabalhos têm investigado
computacionalmente as possíveis estruturas e seus espectros no equilíbrio ácido
base. Falta um esforço computacional complementar para modelar a influência dos
valores de pH nos espectros de UV-Vis de o-VM em misturas de solventes (DHAMMIKA
BANDARA; BURDETTE, 2021; MERINO, RIBAGORDA, BEILSTEIN, 2012).
Diante da temática apresentada, este trabalho foi motivado pelas questões: qual
é a relação entre o deslocamento para o vermelho dos espectros e a diminuição do
pH da solução aquosa do VM? Qual a influência das ligações de hidrogênio
intramoleculares ou intermoleculares nos espectros de UV-Vis?
O intuito deste trabalho foi usar o VM como molécula-modelo no estudo de
azobenzenos, obtendo seus espectros UV-Vis sob meio ácido e alcalino, fazendo
também uma investigação computacional para a obtenção de estruturas moleculares
e seus espectros calculados, a fim de contribuir para um maior entendimento do
equilíbrio ácido-base associado ao VM e de suas respectivas propriedades ópticas
sob diferentes meios.
Material e métodos
PARTE TEÓRICA:
As estruturas moleculares das espécies presentes no equilíbrio ácido-base do
vermelho de metila foram otimizadas com o funcional híbrido B3LYP (Funcional de
troca e correlação de Lee-Yang-Parr) e os conjuntos de funções de base 6-
31G(d,p). Todos os cálculos foram realizados junto ao CENAPAD-UFC (Centro
Nacional de Processamento de Alto Desempenho – Universidade Federal do Ceará).
Os efeitos de solvente foram inseridos nos cálculos por meio da teoria de
solvatação baseada na densidade (SMD, do inglês Solvent Model Density)
(MARENICH, CRAMER, TRUHLAR, 2009).
PARTE EXPERIMENTAL:
Foram preparadas soluções tampões de NaOH 0,1 mol L-1 (pH = 13,0) e HCl 0,1 mol
L-1 (pH = 1,0) e os espectros de absorção do vermelho de metila (C15H15N3O2)
foram obtidos utilizando um espectrofotômetro de simples feixe (KASUAKI, IL-593-
BI) e cubetas de quartzo com 1,0 cm de caminho óptico.
Resultado e discussão
A varredura espectral entre 350 a 600 nm para soluções tanto em meio básico
quanto em meio ácido apresentaram picos de máxima absorção em torno de 430 nm e
520 nm respectivamente (Figura 1a). Foram simulados os espectros de absorção
UV/Vís das espécies presentes no equilíbrio ácido-base (Figura 2) do VM. O
espectro simulado para a estrutura em meio básico, apresentou o λmáx em torno de
421 nm (Figura 1b). Tem-se uma boa concordância com o λmáx obtido
experimentalmente (430 nm).
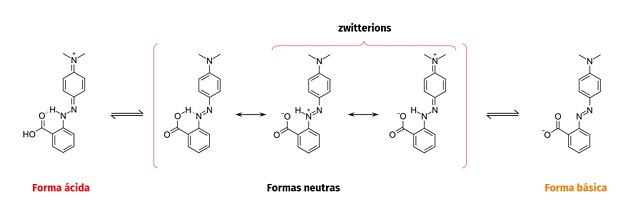
O VM nas suas formas neutras e em meio ácido apresentam estruturas planares,
estabilizadas principalmente por ligações de hidrogênio intramoleculares
apresentando algumas possibilidades conformacionais e assim tem-se uma
coexistência de algumas estruturas em equilíbrio no referido meio, o que explica
o alargamento da banda experimental observada.
No meio ácido existe a possibilidade de existência de uma estrutura com um dos
nitrogênios protonados, do próprio VM neutro e estruturas zwitteriônicas
(DRUMMOND,GRIESER, HEALY, 1989). O λmáx obtido para a estrutura com nitrogênio
protonado gira em torno de 464 nm (Figura 1b). Experimentalmente, verifica-se
que essa mesma grandeza está na faixa de 520 nm logo uma diferença
significativa, cerca de 56 nm. Para a estrutura neutra do VM obteve-se 458 nm,
ainda bastante longe do resultado experimental.
Calculou-se também a estrutura do zwitterion, porém verificou-se nos cálculos
que a estrutura otimizada não correspondeu de fato ao zwitterion esperado. O
λmáx para essa estrutura apresentou um valor de 462 nm, nos levando a inferir
que essa estrutura é bastante similar a estrutura obtida para o meio ácido.
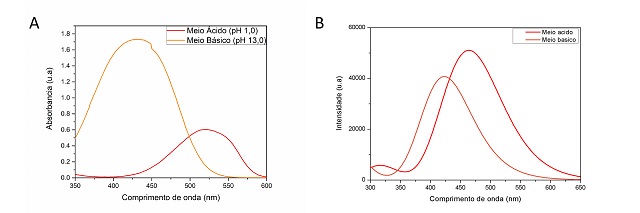
a) Experimental em pH = 1 (λ máx - 430 nm) e pH = 13 (λ máx - 520 nm); b) Teórico, em meio básico e em meio ácido, calculado com B3LYP/6-31G(d,p)//SMD
Conclusões
Observou-se que quando o pH decresce de 13,0 para 1,0 o máximo de absorção é
deslocado de 430 nm para 520 nm. Entretanto, em intervalos intermediários de pH
coexistem estruturas, dificultando assim a interpretação espectral precisa. Para
uma melhor representação, será interessante num trabalho futuro, uma melhoria na
metodologia de solvatação, inclusive com moléculas de água explícitas, isso
acarretará um aumento considerável do custo computacional, entretanto
possivelmente irá melhorar os resultados teóricos.
Agradecimentos
Ao CENAPAD-UFC (Centro Nacional de Processamento de Alto Desempenho – Universidade
Federal do Ceará) pela infraestrutura computacional.
Ao IFSertãoPE/Ouricuri pelo apoio financeiro e institucional.
Referências
COSTA, S. C. S.; GESTER, R. M.; GUIMARÃES, J. R.; AMAZONAS, J. G.; NERO, J. D.;
SILVA, S. B. C.; GALEMBECK, A. The entrapment of organic dyes into sol–gel matrix: Experimental results and modeling for photonic applications. Opt Mater. 2008, 30, 1432.
DHAMMIKA BANDARA, H. M.; BURDETTE, S. C. Photoisomerization in different classes of azobenzene. Chem. Soc. Rev., 2021, 41, 1809 - 1925.
DRUMMOND, C. J.; GRIESER, F.; HEALY, T. W. Acid–base equilibria in aqueous micellar solutions. Part 4.—Azo indicators. J. Chem. Soc., Faraday Trans. 1989, 85, 561.
MARENICH, A. V.; CRAMER, C. J.; TRUHLAR, D. G. Universal Solvation Model Based
on Solute Electron Density and on a Continuum Model of the Solvent Defined by the Bulk Dielectric Constant and Atomic Surface Tensions. J. Phys. Chem. B, 2009, 113, 6378-6396.
MERINO, E.; RIBAGORDA, M. BEILSTEIN J. Control over molecular motion using the
cis– transphotoisomerization of the azo group. Org. Chem. 2012, 8, 1071.
ZHENG, D.; YUAN, X-A.; MA, J. Rationalization of pH-Dependent Absorption
Spectrum of o-Methyl Red in Aqueous Solutions: TD-DFT Calculation and Experiment Study. Acta Phys. -Chim. Sin. 2016, 32 (1), 290–300
















