Autores
Mendes Tanabe, N.B. (UFF) ; Franco Lopes, J.V. (UFF) ; Pena Serna, J.D. (CBPF) ; Checca, N.R. (CBPF) ; Cambraia Alves, O. (UFF) ; Martins da Silva, J.C. (UFF)
Resumo
Diariamente, são produzidos efluentes ricos em ureia, composto encontrado na
urina humana. Alguns problemas podem surgir a partir do descarte desses
efluentes, por isso é necessário tratá-los. A eletro-oxidação da ureia é um
método promissor devido ao seu baixo custo e capacidade de gerar H2. No presente
trabalho foram sintetizados nanobastões de CeO2 com 5%, 10% e 20% de Ni por
diferentes metodologias. Os materiais foram aplicados como catalisadores na
reação de eletro-oxidação de ureia (REU). Os resultados obtidos por voltametria
cíclica mostraram que o catalisador Ni-CeO2/C 10% possibilitou obter densidade
de corrente da REU superiores aos catalisadores contendo 5% e 20% de níquel.
Melhores resultados frente a REU também foram obtidas por cronoamperometria com
o material Ni-CeO2/C 10%.
Palavras chaves
eletro-oxidação da ureia; nanopartículas de níquel; óxido de cério
Introdução
A água na Terra é dividida de forma que 2% corresponde à água doce e 98%
corresponde à água salgada. Logo, a água doce é um recurso escasso e o seu
consumo cresce gradativamente conforme o aumento populacional (RAHIMPOUR et al.,
p. 155, 2010). Diariamente, são produzidos efluentes domésticos e industriais
ricos em compostos orgânicos, dentre eles destaca-se a ureia, produzida nas
indústrias como fertilizante agrícola (LIU et al., p. 118002, 2021).
Adicionalmente, a ureia também é encontrada na urina humana, correspondendo
cerca de 2 a 2,5% em peso (LIU et al., p. 118002, 2021). O descarte de forma
equivocada dessas águas ricas em ureia pode provocar alguns problemas ao meio
ambiente e à saúde humana, pois a ureia é capaz de se decompor naturalmente em
amônia e, posteriormente, ser emitida para atmosfera. A amônia (NH3) é um
composto tóxico e pode ser oxidado a outros poluentes nitrogenados como
nitratos, nitritos e óxidos nítricos (YAN et al., p. 19206, 2020). A
metemoglobinemia é um exemplo de doença causada por elevadas concentrações de
nitrito ingeridas e é caracterizada pela diminuição da oferta de oxigênio,
ocasionando uma pele de coloração azulada nos portadores dessa doença e podendo
levar a morte (DO NASCIMENTO et al., p. 651, 2008). Diante disso, torna-se
importante o desenvolvimento de uma tecnologia que promova a degradação efetiva
da ureia e que gere mínima emissão de poluentes. Um método que vem se destacando
é a oxidação eletroquímica, pois além de não ser prejudicial ao meio ambiente
também apresenta baixo custo. Além disso, apresente um bom controle, fácil
manipulação e os produtos gerados são não-tóxicos (VEDHARATHINAM & BOTTE, p.
292, 2012; YAN et al., p. 266, 2014; YAN et al., p. 19206, 2020). Outra vantagem
é a capacidade de produção de gás hidrogênio, considerado o combustível do
futuro.
Catalisadores são utilizados para acelerar os processos eletroquímicos e torná-
los mais eficientes. Diversos metais podem ser usados como catalisadores para o
processo de eletro-oxidação da ureia como por exemplo platina (Pt), irídio (Ir),
ródio (Rh) e rutênio (Ru), porém o níquel ganha destaque pois é o catalisador
com maior atividade catalítica para o processo de interesse (KING & BOTTE, p.
9579, 2011; MILLER et al., p. 925, 2012). Além disso, apresenta algumas
vantagens como por exemplo baixo custo (KING & BOTTE, p. 2773, 2011; LIU et al.,
p. 118002, 2021; TRAN et al., p.76, 2018).
Na escala ‘’bulk’’, ou seja, na escala macroscópica, o níquel apresenta baixa
eficiência como catalisador na reação de eletro-oxidação de ureia (MIRZAEI et
al., p. 715, 2019), porém sua atividade catalítica pode ser elevada ao se
trabalhar na escala nanométrica. Atualmente, os nanomateriais tem ganhado
destaque devido algumas vantagens, como por exemplo sua maior área superficial e
suas propriedades físico-químicas exclusivas, tais como os defeitos cristalinos
e o confinamento quântico. A atividade catalítica de um metal pode ser
influenciada por alguns fatores como por exemplo: a combinação com um segundo
metal, a adição de suportes e a morfologia (BARANOVA et al., p.28, 2013).
O óxido de cério ou céria (CeO2), como é popularmente conhecida, tem ganhado
destaque na área de catálise, pois sua estrutura cristalina de fluorita permite
alta capacidade de armazenamento de oxigênio (KURAJICA et al., p. 122689 ,
2020). Adicionalmente, o par redox Ce3+/Ce4+ permite a mobilidade de oxigênio
dentro dos cristais (ABD EL-LATEEF et al., p. 111737, 2020). Por consequência
dessas características, a céria é capaz de oxidar o monóxido de carbono (CO),
intermediário formado durante a oxidação da ureia, em dióxido de carbono (CO2) e
evitar a desativação da fase NiOOH (TRAN et al., p. 76, 2018).
É reportado na literatura que a combinação de céria com o níquel resulta em um
aumento da atividade eletrocatalítica do níquel frente a REU (TANABE et al., p.
1411, 2020). Os autores fizeram um estudo com CeO2 com morfologia de fios e sem
controle de morfologia em combinação com níquel. Foi mostrado que resultados
mais promissores foram obtidos com a comninação de níquel com nanofios de céria.
Contudo, no artigo publicado, não foi estudado a influência da relação em
quantidades molares entre o níquel e o cério.
O presente trabalho teve como objetivo sintetizar nanobastões de céria em
combinação com níquel por duas diferentes metodologias: (I) em uma única etapa,
na qual os precursores de Ce e Ni foram inseridos no reator de autoclave
obtendo-se ao final do processo nanobastões de céria com níquel; (II) em duas
etapas, onde primeiramente foram sintetizadas nanobastões de céria pelo método
hidrotémico e em uma segunda etapa nanopartículas de níquel foram suportandas
sobre a céria utilizando o método de redução por borohidreto de sódio. Materiais
com 5%, 10% e 20% de Ni em relação ao Ce foram sintetizados e suportandos em
carbono Vulcan®. Os materiais foram aplicados como catalisadores frente ao
processo de eletro-oxidação de ureia em meio alcalino
Material e métodos
A síntese dos nanobastões de céria e níquel realizada em uma etapa seguiu o
método hidrotermal (MIRZAEI et al., p. 715, 2019; ZHAN et al., p. 398, 2019),
onde dissolveu-se Ce(NO3)3.6H2O e Ni(NO3)2.6H2O, variando-se a porcentagem de
níquel em 5 %, 10 % e 20 %, em 40 mL de NaOH 8 mol L-1. A solução
foi transferida para uma autoclave e aquecida a 120 °C por 16 h. Posteriormente,
o produto foi centrifugado e lavado. Por fim, realizou-se a secagem do produto a
85 °C por 24h (KURAJICA et al., p. 122689, 2020).
A síntese em duas etapas das nanopartículas de níquel suportadas nos nanobastões
de CeO2 teve como base o método de redução por borohidreto de sódio (BARBOSA et
al., p. 136752, 2020; TANABE et al., p. 1411, 2020). Manteve-se a variação da
composição percentual de níquel em 5%,10% e 20%. Para esse fim, os nanobastões
de CeO2, previamente sintetizados, foram dissolvidos em 100 mL de etanol 99,8%.
Certa quantidade de Ni(NO3)2.6H2O foi adicionada e purgou-se N2 por 30 minutos.
Adicionou-se solução de NaBH4 suficiente para obter uma relação molar de 5:1 de
NaBH4 e Ni e manteve-se a purgação de N2 por mais 15 minutos. Posteriormente,
realizou-se a centrifugação e lavagem. Por fim, a secagem foi feita na estufa
por 24 h a 85 °C.
Todos os catalisadores sintetizados foram suportados em Carbono Vulcan®, de
forma a possuir 80% de carbono Vulcan em massa (SILVA et al., p. 193, 2017).
Para tal, carbono Vulcan e o material de interesse foram dispersados em meio de
etanol 99,8% e água milli-Q sob agitação constante por 24 h (SILVA et al., p.
193, 2017). Então, realizou-se a centrifugação e a secagem a 85 °C por 24 h.
As caracterizações físicas dos nanomateriais foram feitas por difração de raios-
X (DRX), microscopia eletrônica por transmissão (MET) em modo varredura,
espectroscopia em energia dispersiva (EDS) e espectroscopia de Ressonância
Paramagnética Eletrônica (EPR). Foram utilizados os equipamentos JEOL JEM-2100 a
200 kV para obtenção das imagens de MET e X’Pert Pro PW3042/10 na faixa entre
10° < 2Ɵ < 90° (KαCu =1,54Å, velocidade de escaneamento 0.025°s-1) para análise
de DRX. Para as análises dos materiais por EPR, utilizou-se um espectrômetro
Bruker EMX Plus com cavidade banda-X (9 GHz).
A caracterização eletroquímica em meio de NaOH 1 mol L foi realizada
por medidas de voltametria cíclica (VC) entre 0 e 0,7 V vs Hg|HgO onde
coletaram-se 10 ciclos a 50 mV s-1. A atividade eletrocatalítica foi avaliada na
presença de NaOH 1 mol L-1 e ureia 0,33 mol L-1 por VC entre 0 e 0,7 V vs Hg|HgO
onde coletaram-se 5 ciclos a 10 mV s-1. Por fim, realizaram-se medidas de
cronoamperometria (CA) por 1 hora à 0,55V.
Para o preparo do eletrodo, coletou-se 8µL de uma dispersão com 20 μL de náfion,
300 μL de álcool isopropílico, 700 μL água Milli-Q e 6 mg de catalisador. As
medidas foram realizadas num potenciostato DropSens e com 3 eletrodos, sendo o
eletrodo de trabalho de carbono vítreo, uma placa de platina como contraeletrodo
e o eletrodo de referência de Hg|HgO
Resultado e discussão
As análises por DRX para os nanobastões de Ni-CeO2/C sintetizados em uma única
etapa, mostraram picos característicos de CeO2 em 2θ = 28,67; 33,20; 47,58;
56,43; 59,17; 69,52; 76,78; 79,11; 88,43 que correspondem, respectivamente, aos
planos (111), (020), (220), (311), (222), (400), (313), (420) e (242) de uma
estrutura cristalina cúbica de face centrada (MA et al., p. 3182, 2020). Os
picos característicos de Ni(OH)2 encontram-se em 2θ = 19,42; 33,20; 38,59; 52,13
e 59,17 e correspondem, respectivamente, aos planos (001), (100), (101), (102) e
(110) (DA SILVA et al., p. 2027, 2010). Já o pico localizado em 2ϴ = 25,03° pode
ser atribuído ao plano de reflexão (002) do grafite no Carbono Vulcan (BARBOSA
et al., p. 136752, 2020). Observou-se que no material com 10% de Ni houve um
deslocamento dos picos de difração do CeO2 para maiores valores de 2θ, sugerindo
que ocorreu uma contração da rede cristalina da céria (ABBAS et al., p. 931,
2015). Porém, notou-se um deslocamento para valores menores de 2θ dos picos de
CeO2 no material contendo 20% de níquel, indicando a expansão da rede cristalina
de CeO2 (MURUGAN et al., p. 583, 2016). Como o Ni2+ possui raio iônico menor do
que o do Ce3+ e Ce4+, ao substituir Ce3+ ou Ce4+ por Ni2+, é possível criar uma
vacância de O para atingir a neutralidade elétrica (MURUGAN et al., p. 583,
2016). Já no material contendo 5% de níquel não foi observado deslocamentos
significativos dos picos de difração do CeO2. Assim, os resultado obtidos por
DRX indicam a presença de um material híbrido, liga de Ni-CeO2 e Ni(OH)2.
Nos difratogramas dos nanobastões de Ni-CeO2 sintetizados em duas etapas,
observou-se que três picos de Ni(OH)2 localizados próximos a 2θ = 19,42; 38,59 e
52,13 não aparecem, provavelmente devido as partículas serem bem pequenas
(BARBOSA et al., p. 136752, 2020). Nesse caso, não se observou deslocamento dos
picos de difração da céria, indicando que o níquel não entrou no retículo
cristalino da mesma, o que era espero visto que os materiais foram sintetizados
em etapas distintas.
As imagens obtidas por MET dos nanobastões de céria e níquel sintetizados em uma
etapa apresentaram diâmetro na faixa de 20-50 nm e comprimento em torno de 80-
400 nm. Observou-se um material de característica híbrida com predominância de
nanobastões, porém com partículas aparentemente esféricas também. Provavelmente
isso aconteceu, pois as condições de síntese dos nanobastões de CeO2 e da céria
policristalina são bem semelhantes.
Através dos espectros de EPR, observou-se que os nanobastões de céria
apresentaram um comportamento ferromagnético que pode estar relacionado com
vacâncias de oxigênio (MARCINIAK et al., p. 111053, 2020). Para os nanobastões
de céria e níquel sintetizados em uma etapa, o sinal de ferromagnetismo crescia
conforme a quantidade de níquel aumentava, o que pode estar associado ao próprio
comportamento ferromagnético do níquel. Em contrapartida, para os nanobatões de
céria e níquel sintetizados em duas etapas, o material que apresentou maior
sinal de ferromagnetismo foi aquele contendo 10% de níquel, que provavelmente
está associado as vacâncias de oxigênio criadas.
Nas caracterizações eletroquímicas obtidas por experimentos de VC em meio de
NaOH 1 mol L-1 foi observado que tanto os nanobastões de céria e níquel
sintetizados em uma etapa quanto os sintetizados em duas etapas, apresentaram
picos referentes a oxidação do Ni2+ (Ni(OH)2) a Ni3+ (NIOOH) na varredura direta
e picos referentes a redução do Ni3+ a Ni2+ na varredura reversa,
característicos do matérias de níquel (BARBOSA et al., p. 136752, 2020).
Na Figura 1A, estão os resultados obtidos por VC na presença de NaOH 1 mol L-1 e
0,33 mol L-1 de ureia no intervalo de potencial ente 0 e 0,7 V vs Hg|HgO com os
nanobastões de céria e níquel sintetizados numa única etapa. Os três materiais
contendo níquel permitiram densidades de corrente da REU (densidade de corrente
de pico, em aproximadamente 0,47 V) superiores à com céria pura, fato esperado
visto que o níquel é a fase ativa para o processo. Percebe-se que a densidade de
corrente de pico referente a REU obtida com o material Ni-CeO2/C 10 % foi cerca
de 4,1 vezes maior que a com material com 20% de Ni, enquanto que com o material
Ni-CeO2/C 5% obteve-se uma densidade de corrente 3,4 vezes superior à com
material com 20% de Ni.
Já na Figura 1B, estão os resultados obtidos nas mesmas condições com os
nanobastões de céria com níquel sintetizados em duas etapas, onde também se
observou que a densidade de corrente de pico localizada em 0,47V é referente a
REU. Novamente, os materiais contendo níquel possibilitaram obtenções de
corrente de picos superiores à da céria pura. Pode-se observar que a densidade
de corrente de pico referente a REU obtida com o material Ni-CeO2/C 10% foi
cerca de 2,1 vezes maior que a com material com 5% de níquel, enquanto que com
material Ni-CeO2/C 20% obteve-se uma densidade de corrente 1,6 vezes superior à
com material com 5% de níquel. Ao comparar os métodos de síntese, percebe-se que
maiores densidades de corrente da REU foram obtidas com os nanobastões
sintetizados em duas etapas, onde o catalisador Ni-CeO2/C 10% sintetizado em
duas etapas possibilitou obter melhores resultados. Nos materiais sintetizados
em duas etapas, o níquel está suportado sobre os nanobastões de céria, enquanto
que nos materiais sintetizados em uma etapa, parte do níquel entrou na rede
cristalina da céria e parte ficou exposta, de acordo com os resultados obtidos
por DRX. Já que o níquel é a fase ativa para a REU, os materiais contendo níquel
exclusivamente na superfície proporcionam melhores resultados.
Na Figura 2A, encontram-se os resultados obtidos por cronoamperometria
referentes a REU para os nanobastões de céria e níquel sintetizados em uma
etapa. Observa-se que os materiais Ni-CeO2/C 5% e Ni-CeO2/C 10% possibilitaram
obter densidades de corrente ao final do processo bem próximas e cerca de 4
vezes superior à do material NiCeO2/C 20%. Isso era esperado pois, nesse mesmo
valor de potencial, a VC mostrou que as densidades de corrente obtidas com esses
materiais para oxidação da ureia estavam bem próximas. Adicionalmente, observa-
se um decaimento da atividade catalítica que pode estar relacionada com a
adsorção de intermediários formados durante a oxidação da ureia na superfície
dos catalisadores (por exemplo o CO) considerando venenos catalíticos. Na Figura
2B, encontram-se os resultados obtidos cronoamperometria referentes a REU para
os nanobastões de céria e níquel sintetizados em duas etapas. O material com 10%
de níquel possibilitou obter densidade de corrente aos 60 minutos de experimento
1,8 vezes maior que o catalisador Ni-CeO2/C 5%, enquanto que o material com 20%
de níquel possibilitou a obtenção de densidade de corrente ao final do processo
1,2 vezes superior ao catalisador Ni-CeO2/C 5%. Adicionalmente, observou-se que
durante a análise ocorreu mínima flutuação do sinal de corrente, fato ligado a
liberação de produtos gasosos que estavam adsorvidos na superfície do
catalisador. Ao comparar os métodos de síntese, percebemos que maiores
densidades de corrente ao final do processo foram obtidas com os nanobastões
sintetizados em duas etapas, onde o catalisador Ni-CeO2/C 10% sintetizado em
duas etapas possibilitou obter densidade de corrente de pico 6,1 vezes maior que
o catalisador Ni-CeO2/C 20% sintetizado em uma etapa. Novamente essa diferença
provavelmente está ligada à presença de nanopartículas de níquel na superfície
dos nanobastões de céria.
É importante ressaltar que em trabalho publicado (TANABE et al., p.
1411, 2020), foi observado que suportar nanopartículas de níquel sobre a céria
possibilitou melhorar a atividade eletrocatalítica do níquel frente a REU,
contudo no artigo não foi variada a porcentagem de níquel em relação a céria. Já
no presente trabalho, além da porcentagem de níquel em relação a céria, também
foi avaliado o método de síntese.

Figura 1: (a) VC dos nanobastões de Ni-CeO2 sintetizados em uma etapa (b) VC dos nanobastões de Ni-CeO2 sintetizados em duas etapas
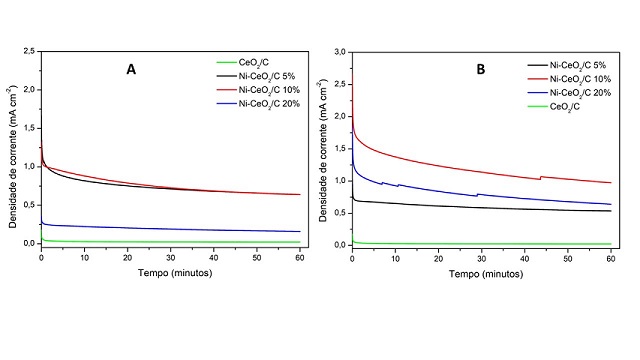
Figura 2: (a) CA dos nanobastões de Ni-CeO2 sintetizados em uma etapa (b) CA dos nanobastões de Ni-CeO2 sintetizados em duas etapas
Conclusões
Os nanobastões de CeO2 e níquel sintetizados em uma única etapa pelo método
hidrotermal e sintetizados em duas pelo método hidrotermal e NaBH4 foram
sintetizados com sucesso. Os resultados obtidos por DRX referentes aos materiais
Ni-CeO2 sintetizados em uma etapa confirmaram a presença de níquel na fase
Ni(OH)2, tal como de CeO2 e do Carbono. Observou-se deslocamento dos picos de
CeO2 configurando a entrada do níquel na rede cristalina da céria. Já os
resultados por DRX dos materiais Ni-CeO2 sintetizados em duas etapas não
mostraram deslocamentos dos picos de difração do CeO2, mostrando que não houve a
formação de liga metálica.
A partir das imagens de MET confirmou-se a morfologia dos nanobastões e
descobriu-se a distribuição das nanopartículas de Ni no material. Por meio do
mapeamento por EDS dos nanobastões sintetizados em uma única etapa, observou-se
que o níquel e o cério estão na mesma região corroborando a entrada do níquel na
rede cristalina da céria. A presença de oxigênio nas regiões onde ambos os
elementos se encontram também corroboram com a formação de CeO2 e Ni(OH)2. Os
espectros de EPR para os nanobastões de céria e níquel sintetizados em uma etapa
apresentaram comportamento ferromagnético, porém foi mais expressivo para o
material Ni-CeO2/C 10% sintetizado em duas etapas provavelmente devido a criação
de vacâncias de oxigênio. Em relação a porcentagem de níquel, melhores
resultados frente a REU foram obtidos quando o percentual foi equivalente a 10%.
Ao comparar os métodos de síntese, melhores atividades eletrocatalíticas
referentes a REU foram observadas com os materiais sintetizados em duas etapas,
fato que pode estar associado a presença de níquel na superfície dos nanobastões
de céria. O material que apresentou melhores resultados frente a REU quando
comparado aos demais materiais foi o Ni-CeO2/C 10% sintetizado em duas etapas.
Agradecimentos
FAPERJ (E-26/211.371/2019, 26/201.435/2021, E-26/210.793/2021), Capes-PrInt
(88887.310269/2018-00.), CAPES, CNPq e CBPF.
Referências
ABBAS, F.; JAN, T.; IQBAL, J.; AHMAD, I.; NAQVI, M. S. H.; MALIK, M. Facile synthesis of ferromagnetic Ni doped CeO2 nanoparticles with enhanced anticancer activity. Applied Surface Science, no 357, 931–936, 2015.
ABD EL-LATEEF, H. M.; ALMULHIM, N. F.; MOHAMED, I. M. A. Physicochemical and electrochemical investigations of an electrodeposited CeNi2@NiO nanomaterial as a novel anode electrocatalyst material for urea oxidation in alkaline media. Journal of Molecular Liquids, no 297, 111737, 2020.
BARANOVA, E. A.; CALLY, A.; ALLAGUI, A.; NTAIS, S.; WUTHRICH, R. Nickel particles with increased catalytic activity towards hydrogen evolution reaction. Comptes Rendus Chimie, no 16, 28–33, 2013.
BARBOSA, J. R.; PARANHOS, C. H.; ALVES, O. C.; CHECCA, N. R.; SERNA J. P.; ROSSI, A. L.; SILVA, J. C. M. Low loading platinum dispersed on Ni/C nanoparticles as high active catalysts for urea electrooxidation reaction. Electrochimica Acta, no 355, 136752, 2020.
DO NASCIMENTO, T. S.; PEREIRA, R. O. L.; MELLO, H. L. D.; COSTA, J. Methemoglobinemia: from diagnosis to treatment. Revista Brasileira de Anestesiologia, no 58, 651–664, 2008.
KING, R. L.; BOTTE, G. G. Hydrogen production via urea electrolysis using a gel electrolyte. Journal of Power Sources, no 196, 2773–2778, 2011.
KING, R. L.; BOTTE, G. G. Investigation of multi-metal catalysts for stable hydrogen production via urea electrolysis. Journal of Power Sources, no 196, 9579–9584, 2011.
KURAJICA, S.; MUZINA, K.; DRAZIC, G.; MATIJASIC, G.; DUPLANCIC, M.; MANDIC, V.; ZUPANCIC, M.; MUNDA, I. K. A comparative study of hydrothermally derived Mn, Fe, Co, Ni, Cu and Zn doped ceria nanocatalysts. Materials Chemistry and Physics, no 244, 2019.
LIU, Y. H.; HUNG C. H.; HSU, C. L. Electrochemical fabrication of carbon fiber-based nickel hydroxide/carbon nanotube composite electrodes for improved electro-oxidation of the urea present in alkaline solutions. Separation and Purification Technology, no 258, 118002, 2021.
MA, Y.; MA, Y.; GIULI, G.; EUCHNER, H.; GROB, A.; LEPORE, G. O.; D’ACAPITO, F.; GEIGER, D.; BISKUPEK, J.; KAISER, U.; SCHUTZ, H. M.; CARLSSON, A.; DIEMANT, T.; BEHM, R. J.; KUENZEL, M.; PASSERINI, S.; BRESSER, D. Introducing Highly Redox-Active Atomic Centers into Insertion-Type Electrodes for Lithium-Ion Batteries. Advanced Energy Materials, no 10, 2020.
MARCINIAK, A. A.; HENRIQUE, F. J. F. S.; LIMA, A. F. F.; ALVES, O. C.; MOREIRA, C. R.; APPEL, L. G.; MOTA, C. J. A. What are the preferred CeO2 exposed planes for the synthesis of dimethyl carbonate? Answers from theory and experiments. Molecular Catalysis, no 493, 111053, 2020.
MILLER, A. T.; HASSLER, B. L.; BOTTE, G. G. Rhodium electrodeposition on nickel electrodes used for urea electrolysis. Journal of Applied Electrochemistry, no 42, 925–934, 2012.
MIRZAEI, P.; BASTIDE, S.; DASSY, A.; BENSIMON, R.; BOURGON, J.; AGHAJANI, A.; ZLOTEA, C.; BOUVET, D. M.; VIVIER, C. C. Electrochemical oxidation of urea on nickel-rhodium nanoparticles/carbon composites. Electrochimica Acta, no 297, 715–724, 2019.
MURUGAN, R.; VIJAYAPRASATH, G.; MAHALINGAM, T.; RAVI, G. Enhancement of room temperature ferromagnetic behavior of rf sputtered Ni-CeO 2 thin films. Applied Surface Science, no 390, 583–590, 2016.
RAHIMPOUR, M. R.; BARMAKI, M. M.; MOTTAGHI, H. R. A comparative study for simultaneous removal of urea, ammonia and carbon dioxide from industrial wastewater using a thermal hydrolyser. Chemical Engineering Journal, no 164, 155–167, 2010.
SILVA, M. R.; ÂNGELO, A. C. D.; DALL’ANTONIA, L. H. Hidróxido de níquel suportado em carbono: um catalisador de baixo custo para a eletro-oxidação de alcoóis em meio alcalino. Química Nova, no 33, 2027–2031, 2010.
SILVA, J. C. M.; NTAIS, S.; NETO, É. T.; SPINACÉ, E. V.; CUI, X.; NETO, A. O.; BARANOVA, E. A. Evaluation of carbon supported platinum–ruthenium nanoparticles for ammonia electro-oxidation: Combined fuel cell and electrochemical approach. International Journal of Hydrogen Energy, no 42, 193–201, 2017.
TANABE, N. B. M.; BARBOSA, J. R.; CHECCA, N. R.; RODRIGUES, T. S.; SILVA, F. A.; ALVES, O. C.; SILVA, J. C. M. Ni/C-CeO2 with Different Morphologies of CeO2 towards Urea Electro-Oxidation Reaction. Revista Virtual de Quimica, no 12, 1411–1422, 2020.
TRAN, T. Q. N.; YOON, S. W.; PARK, B. J.; YOON, H. H. CeO2-modified LaNi0.6Fe0.4O3 perovskite and MWCNT nanocomposite for electrocatalytic oxidation and detection of urea. Journal of Electroanalytical Chemistry, no 818, 76–83,2018.
VEDHARATHINAM, V.; BOTTE, G. G. Understanding the electro-catalytic oxidation mechanism of urea on nickel electrodes in alkaline medium. Electrochimica Acta, no 81, 292–300, 2012.
YAN, W.; WANG, D.; DIAZ, L. A.; BOTTE, G. G. Nickel nanowires as effective catalysts for urea electro-oxidation. Electrochimica Acta, no 134, 266–271, 2014.
YAN, X.; HU, Q. T.; WANG, G.; ZHANG, W.D.; LIU, J.; LI, T.; GU, Z. G. NiCo layered double hydroxide/hydroxide nanosheet heterostructures for highly efficient electro-oxidation of urea. International Journal of Hydrogen Energy, no 45, 19206–19213, 2020.
ZHAN, S.; Zhou, Z.; LIU, M.; JIAO, Y.; WANG, H. 3D NiO nanowalls grown on Ni foam for highly efficient electro-oxidation of urea. Catalysis Today, no 327, 398–404, 2019.
















