Autores
Camargo, K. (UNIVERSIDAD NACIONAL DE COLOMBIA) ; Avila, M. (UNIVERSIDAD NACIONAL DE COLOMBIA) ; Sierra, C. (UNIVERSIDAD NACIONAL DE COLOMBIA)
Resumo
Los ácidos grasos desempeñan un papel de protección contra los hongos patógenos. Aunque
la inestabilidad y oxidación de sus ácidos grasos ha limitado sus aplicaciones. Entre
las estrategias utilizadas para prevenir estos desafíos, la técnica de encapsulación ha
sido el método más exitoso. Por lo tanto, el objetivo del presente estudio fue la
encapsulación del aceite de palmiste (AP) en β-ciclodextrina (β-CD) por medio de
amasado y coprecipitación, obteniendo eficiencias de 78,3 ±0,5 % y 75,9 ± 0,7%
respectivamente. Posteriormente seleccionando el mejor método, se realizaron los
complejos de inclusión (CI) en diferentes relaciones molares y se evaluó el éxito de la
encapsulación mediante técnicas térmicas como DSC y TGA, espectroscópicas como IR, RMN
y DRX, obteniendo éxito en el CI.
Palavras chaves
COMPLEJO DE INCLUSION; BIOMASA RESIDUAL; ACTIVIDAD BIOLOGICA
Introdução
La producción exitosa de cultivos frutales se ve afectada por el ataque de plagas y
enfermedades, siendo los hongos fitopatógenos la causa de pérdidas significativas,
tanto en el campo como en la postcosecha, debido a infecciones latentes [1]. Dentro
de los cultivos que presentan mayor afectación en el campo colombiano esta la Persea
americana (aguacate)[2], el Solanum betaceum (Tomate de arbol) [3], y la familia de
plantas del género passiflora [4]. Teniendo en cuenta lo anterior y la importancia
del control fúngico en estas frutas tropicales debido a la creciente demanda de
estas en los mercados internacionales [5], se buscan fuentes naturales para inhibir
el crecimiento de los hongos patógenos en estas frutas. En estudios anteriores,
Albarracín et al. [6] demostraron la actividad inhibitoria del ácido láurico contra
el patógeno Colletotrichum tamarilloi del tomate de árbol. De acuerdo con lo
anteriormente mencionado y teniendo en cuenta que el ácido láurico se encuentra en
altas cantidades en fuentes naturales, se realiza la búsqueda de estas para la
ejecución de este estudio [8]. Las fuentes conocidas más ricas de ácido láurico en
la naturaleza son el aceite de coco, aceite de palmiste y aceite de semillas de
laurel [9], [10]. El aceite de palmiste (AP) es especialmente atractivo como fuente
de ácido láurico porque puede obtenerse como subproducto industrial de la producción
de aceite de palma[11], que es una industria activa en Colombia y otros países. El
ácido láurico presente en el aceite de palmiste puede ser protegido contra la
degradación para aumentar sus aplicaciones por medio de varios métodos incluyendo la
encapsulación [12]. Por lo que, para superar esta limitación, se ha utilizado
ciclodextrina (CD) para formar complejos de inclusión [13].
Material e métodos
Aceite de palmiste (subproducto del aceite de palma) suministrado por Cenipalma y β-
CD (97%, peso molecular 1134.98) Sigma-Aldrich.
La composición de ácidos grasos del aceite de palma se determinó mediante análisis
GC-MS con n-hexano [11].Los complejos de inclusión (CI) de β-CD y aceite de palmiste
(AP) se sintetizaron mediante el método de amasado y de coprecipitación [13].
La eficiencia de inclusión (IE) se determinó según la siguiente ecuación (Ecuación
(1)): Eficiencia de inclusión (%)=(masa de aceite de palmiste encapsulado(mg))/(masa
de aceite de palmiste inicial (mg)) x100 (Ecuación 1)
Se realiza una solución acuosa para disolver y disociar el complejo y se usa hexano
para atrapar el aceite de palmiste extraído del complejo. Se determinó el ácido
graso contenido en la solución mediante titulación con KOH [14].
Técnicas de caracterización
Termogravimetría (TGA) mediante un equipo de termo equilibrio TGA55 (Shimadzu) en el
rango de temperatura de 25-500°C. El análisis de calorimetría de barrido diferencial
(DSC) se realizó en un calorímetro DSC 250 de TA instruments con una rampa de
calentamiento de 0 a 50 °C a 10 °C/min luego, con una rampa de enfriamiento de 50°C
a 0°C a 20°C/min y finalmente de 0°C hasta 250°C a 10°C/min. Los espectros
infrarrojos de las muestras se obtuvieron en el rango de 4000-500 cm-1 a temperatura
ambiente. Los experimentos de RMN de 1H se realizaron en un espectrómetro Bruker
400. Los resultados del difractómetro de rayos X en polvo se obtuvieron en un Rigaku
XRD con un tubo de CuKα, en el rango de 10-60 θ.
Actividad antifúngica
Las muestras de los complejos de inclusión obtenidos se evaluaron por medio de
bioensayos biológicos en cajas de 96 pozos y 24 pozos con una suspensión de esporas
de los hongos patógenos de interés.
Resultado e discussão
Por medio del análisis GC-MS, se identificaron 8 compuestos que consistían en el
99,9% del AP. El AP se caracterizó principalmente por la presencia del ácido láurico
(C12:0) 51,23%, el ácido mirístico (C14:0) 16,68% y el ácido oleico (C18:1) 13,87%.
Los resultados de la eficiencia de inclusión (EI) indican que, en el caso del
complejo de inclusión preparado por el método de amasado, la eficiencia de inclusión
(%EI) determinada fue de 78,3 ± 0,6 %, y por el método de coprecipitación fue del
75,9 ± 0,8 %, lo que indica que el método de amasado es más adecuado para la
encapsulación del AP en la cavidad β-CD. Por lo tanto, se utilizó el método de
amasado para la preparación de los CIs. La estequiometría determinada por medio del
método de Jobs es AP: β-CD (1:2) lo que concuerda con la eficiencia de este complejo
de inclusión de 88, 6 ± 0,6 % y su constante de formación 323,8 ± 1,3 mol/kg.
Adicionalmente se confirma la formación de los complejos de inclusión AP: β-CD 2 y
AP: β-CD 3 por medio de las técnicas de TGA, DSC, RMN y DRX.
Los resultados a resaltar se encuentran principalmente en las curvas comparativas de
TGA de la β-CD, AP y los CI se muestran en la Fig. 1. La CD pura presenta un primer
paso de pérdida de peso en el rango de 50-120°C que se atribuye a la evaporación de
agua. Sin embargo, este primer paso de pérdida de peso no se observa tan claramente
en los complejos de inclusión preparados (AP: β-CD 2 4.97% y AP: β-CD 3 4.71%) (Fig.
1). Según estudios publicados anteriormente, esto podría atribuirse al
desplazamiento parcial de las moléculas de agua en las cavidades β-CD por los
componentes de AP atrapados [16]. Adicionalmente cuando se observan las perdidas
para la mezcla física AP: β-CD 1 se evidencian la unión de las perdidas tanto en AP
como en β-CD.
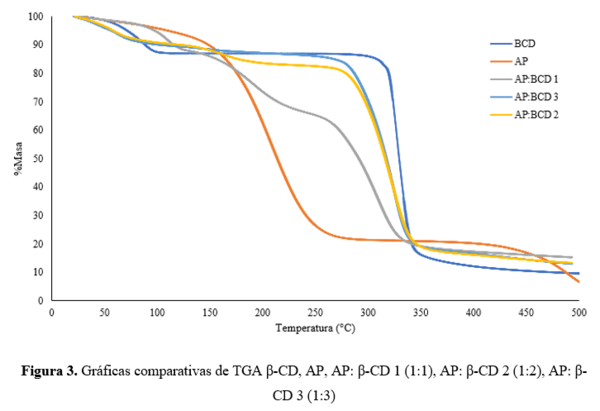
Figura 1. Gráficas comparativas de TGA β-CD, AP, AP: β- CD 1 (1:1), AP: β-CD 2 (1:2), AP: β-CD 3 (1:3)

Figura 2. Gráficas comparativas DSC de β-CD, AP, AP: β- CD 1, AP: β-CD 2, AP: β-CD 3
Conclusões
De acuerdo con los resultados obtenidos en las técnicas de caracterización y en la
actividad in vitro contra los hongos patógenos, el complejo AP: β-CD 2 es el que se
presenta como el complejo más promisorio teniendo en cuenta que frente a los hongos
patógenos Colletotrichum tamarilloi, Colletotrichum gloeosporioides y Fusarium
oxysporum, Fusarium solani, Fusarium equiseti presenta una concentración mínima
inhibitoria (ICM) que va desde 318,6 ±0,4 - 956,7 ± 0,5 ppm, con lo anterior, el CI
formado puede encontrar aplicaciones en la preparación de películas para el envasado
activo de productos.
Agradecimentos
Los autores agradecen a la Universidad Nacional de Colombia por su apoyo financiero
proyecto HERMES 42047 y a los grupos de Investigación de Química de Productos Naturales
Vegetales Bioactivos Y macromoléculas.
Referências
[1] R. Dean et al., “The Top 10 fungal pathogens in molecular plant pathology,” Mol Plant Pathol, vol. 13, no. 4, pp. 414–430, 2012, doi: 10.1111/j.1364-3703.2011.00783.x.
[2] C. F. C. J. E. Urrea Jimenez, “Manejo integrado de las principales plagas y enfermedades en aguacate Hass (Persea americana) en el departamento de Caldas,” 2020. [Online]. Available: http://dx.doi.org/10.1016/j.jss.2014.12.010%0Ahttp://dx.doi.org/10.1016/j.sbspro.2013.03.034%0Ahttps://www.iiste.org/Journals/index.php/JPID/article/viewFile/19288/19711%0Ahttp://citeseerx.ist.psu.edu/viewdoc/download?doi=10.1.1.678.6911&rep=rep1&type=pdf
[3] S. Cabrera, Laura;Rojas, Paola;Rojas, “Most Colletotrichum species associated with tree tomato (solanu betaceum) and mango (Mangifera indica) crops are not host specific,” Int J Lab Hematol, vol. 38, no. 1, pp. 42–49, 2016, doi: 10.1111/ijlh.12426.
[4] N. M. Sanabria-Rodriguez, “Reconocimiento de enfermedades en gulupa (Passiflora edulis Sims) en el departamento de Boyaca,” pp. 1–44, 2010.
[5] L. T. Albarracín, W. Delgado, L. E. Cuca, and M. C. Ávila, “New butyrolactone and other metabolites from the bark of Endlicheria arenosa against of the phytopathogen Colletotrichum tamarilloi,” Nat Prod Res, vol. 33, no. 5, pp. 687–694, 2019, doi: 10.1080/14786419.2017.1408090.
[6] F. D. Gunstone, “Production and Trade of Vegetable Oils,” 2011.
[7] A. J. Dijkstra, “Lauric Oils,” in Encyclopedia of Food and Health, Elsevier Inc., 2015, pp. 517–522. doi: 10.1016/B978-0-12-384947-2.00513-4.
[8] FEDEPALMA, “La agroindustria de la palma de aceite en Colombia y en el mundo,” 2015.
[9] P. dos Passos Menezes et al., “Molecular Modeling and Physicochemical Properties of Supramolecular Complexes of Limonene with α- and β-Cyclodextrins,” AAPS PharmSciTech, vol. 18, no. 1, pp. 49–57, 2017, doi: 10.1208/s12249-016-0516-0.
[10] A. Cid-Samamed, J. Rakmai, J. C. Mejuto, J. Simal-Gandara, and G. Astray, “Cyclodextrins inclusion complex: Preparation methods, analytical techniques and food industry applications,” Food Chem, vol. 384, no. February, p. 132467, 2022, doi: 10.1016/j.foodchem.2022.132467.
[11] P. Araujo, T. T. Nguyen, L. Frøyland, J. Wang, and J. X. Kang, “Evaluation of a rapid method for the quantitative analysis of fatty acids in various matrices,” J Chromatogr A, vol. 1212, no. 1–2, pp. 106–113, Nov. 2008, doi: 10.1016/j.chroma.2008.10.006.
[12] K. P. Sambasevam, S. Mohamad, N. M. Sarih, and N. A. Ismail, “Synthesis and characterization of the inclusion complex of β-cyclodextrin and azomethine,” Int J Mol Sci, vol. 14, no. 2, pp. 3671–3682, 2013, doi: 10.3390/ijms14023671.
[13] A. Halahlah et al., “Synthesis and characterization of inclusion complexes of rosemary essential oil with various β-cyclodextrins and evaluation of their antibacterial activity against Staphylococcus aureus,” J Drug Deliv Sci Technol, vol. 65, no. November 2020, p. 102660, 2021, doi: 10.1016/j.jddst.2021.102660.
[14] D. Benchasattabuse, “Microencapsulation of virgin coconut oil in β-cyclodextrin by using paste method,” 2015.
[15] S. Rashmi and H. G. Rajkumar, “Phytochemical Analysis and In Vitro Evaluation of Antifungal Activity of Five Invasive Plant Species against Macrophomina Phaseolina (Tassi) Goid,” International Journal of Plant Research, vol. 1, no. 1, pp. 11–15, Aug. 2012, doi: 10.5923/j.plant.20110101.02.
[16] M. Kotronia, E. Kavetsou, S. Loupassaki, S. Kikionis, S. Vouyiouka, and A. Detsi, “Encapsulation of oregano (Origanum onites l.) essential oil in β-cyclodextrin (β-CD): Synthesis and characterization of the inclusion complexes,” Bioengineering, vol. 4, no. 3, Sep. 2017, doi: 10.3390/bioengineering4030074.
[17] L. M. A. Pinto, L. F. Fraceto, M. H. A. Santana, T. A. Pertinhez, S. Oyama, and E. de Paula, “Physico-chemical characterization of benzocaine-β-cyclodextrin inclusion complexes,” J Pharm Biomed Anal, vol. 39, no. 5, pp. 956–963, Oct. 2005, doi: 10.1016/j.jpba.2005.06.010.
[18] A. G. Marangoni et al., “Structure and functionality of edible fats,” Soft Matter, vol. 8, no. 5. pp. 1275–1300, Feb. 07, 2012. doi: 10.1039/c1sm06234d.
















