Autores
Rosa, M.F. (UNIOESTE) ; Halim, B.J. (UNIOESTE) ; Paz, J.B. (UNIOESTE) ; Lobo, V.S. (UTFPR)
Resumo
A contaminação do ambiente por compostos orgânicos de origem antropogênica tem
levado a severos desequilíbrios ecológicos. A remoção destes contaminantes por
adsorção ou degradação, por métodos oxidativos avançados, pode ser uma
alternativa. Este projeto objetivou desenvolver um material que aliasse essas
duas propriedades na remoção de contaminantes em um mesmo material. Para o
desenvolvimento deste material foi utilizado a diatomita, um resíduo da
indústria cervejeira, que serviu como material adsorvente e também suporte para
o TiO2, um reconhecido fotocatalisador. Testou-se a eficiência dos catalisadores
preparados na fotocatálise da 17-metiltestosterona (17MT) em solução aquosa, e
os ensaios mostraram até o momento que todos os catalisadores apresentaram baixa
eficiência (17%
Palavras chaves
17a-metiltestosterona; fotocatálise; poluentes emergentes
Introdução
Os fármacos enquadram-se em um grupo de poluentes denominado contaminantes
emergentes, pois esta classe de compostos foi durante muito tempo desconsiderada
como um potencial poluente, uma vez que estavam presentes somente em
pequeníssimas concentrações no meio. Entretanto estudos mostram que sua presença
em ambientes naturais, especialmente o aquático, podem comprometer a qualidade
dos recursos hídricos, alterando a biodiversidade e o equilíbrio de ecossistemas
aquáticos, fenômeno conhecido como ecotoxicologia, assim como está associado ao
aparecimento de cepas bacterianas cada vez resistentes ao uso dos antibióticos
padrões (Taheran et al., 2018; Chaturvedi et al., 2021; Shahid et al., 2021).
A 17MT é um esteroide anabolizante e antineoplásico utilizado pela medicina para
suprir a deficiência de testosterona e tratamento dos sintomas da andropausa nos
homens. No cultivo de peixes ela é utilizado para promover a reversão sexual dos
alevinos (Zanardi et al. 2011; Nunes & Tonini, 2019), e com isso acelerar o
crescimento e o ganho de peso. O modo mais empregado para a administração deste
hormônio na população de peixes é associá-lo à ração. Entretanto esta mistura é
feita sem muito cuidado e sem obedecer a critérios de dosagem. O descarte da
água do tanque de criação de peixes é feita sem nenhum controle dos resíduos
presentes, e assim grandes volumes de água e sedimentos contendo 17MT são
despejados nos cursos d’água. Os efeitos da presença de 17MT em águas naturais
ainda não é bem conhecido, mas seu efeito mais conhecido, a reversão sexual ou
masculinização dos peixes, pode agora ocorrer no meio natural, acarretando a
diminuição da população de peixes fêmeas no ambiente natural, o que pode
representar uma ameaça a sobrevivência da espécie e uma ameaça ao equilibrio
biológico. Quanto ao ser humano, a 17MT, por ser um hormônio, é considerado um
disruptor endócrino, e sua presença em cursos d’água no qual ocorra captação de
água para consumo pode também levar a efeitos deletérios. As estações de
tratamento de água não são capazes de remover estas substâncias da água pelos
processos convencionais. Assim pode-se estar consumindo uma água que apresenta
segurança do ponto de vista de contaminação microbiológica, porém não do ponto
de vista químico (Lopes et al., 2010; Tijani et al., 2016).
Um dos processos mais estudados para a degradação total de contaminantes
orgânicos em sistemas aquáticos é a fotocatálise heterogênea com óxidos
metálicos semi-condutores. (Shahid et al., 2021).
Dos catalisadores empregados com esta finalidade o dióxido de titânio (TiO2) é
sem sobra de dúvida o catalisador mais largamente empregado em Processos
Oxidativos Avançados (POA) (Rodriguez-Narvaez et al., 2017; Shahid et al.,
2021).
A diatomita é um material silicoso de origem biológica proveniente de algas de
conchas resistentes (diátomos) rica em dióxido de silício amorfo (SiO2 87-91%),
termicamente estável, poroso e de baixa densidade (Padmanabhan et al., 2014).
Uma das principais aplicações da terra diatomácea (diatomita) é como adsorvente
em processos industriais, principalmente na indústria cervejeira, que, após seu
uso são descartados em aterros sanitários.
Na literatura já existem relatos da obtenção de compósitos diatomita-titânia e o
emprego destes como fotocatalisadores na degradação de contaminantes (Sun et
al., 2014; Xia et al., 2014; Wang et al., 2015; Wang et al., 2016).
Material e métodos
Os catalisadores foram preparados adaptando-se o procedimento reportado por Sun
et al. (2014), que, exemplificando para o catalisador 2,5%, procedeu-se da
seguinte forma: Em uma solução de ácido acético 10% em etanol foram adicionados,
sob agitação vigorosa, 4,9882g de diatomita. Em seguida foram adicionados, gota
a gota, 9,5 mL de isopropóxido de titânio (Ti(OiPr)4) em concentração 2,5%
(m/m), sendo mantida a agitação por mais 24 horas. O sólido obtido foi filtrado
sob vácuo, lavado com água, e levado à estufa a 70oC para eliminação da água. A
seguir o sólido foi calcinado em mufla à 550oC por 4 h. Este mesmo procedimento
foi realizado para todos os catalisadores, sendo obtidos catalisadores nas
proporções 2,5%, 5%, 10% e 15% de TiO2. Os quatro catalisadores preparados foram
caracterizados por Difração de Raios X (DRX), Espectroscopia de Infravermelho
com Transformada de Fourier (FTIR) e Microscopia Eletrônica de Varredura (MEV).
Para o preparo da solução-estoque de 17α-metiltestosterona (17MT) foram
solubilizados 0,1512g de 17MT em 100 mL de etanol (5x10^-3 mol L-1). A partir
desta solução foram retiradas 4 alíquotas (0,5 mL, 1,0 mL, 5,0 mL e 10,0 mL) que
foram transferidas para balões volumétricos de 50 mL e avolumadas com água
destilada, obtendo-se então 4 soluções com concentrações variando de 5x10^-5 a
1x10^-3. O objetivo deste procedimento foi determinar qual a melhor concentração
para se trabalhar espectrofotometricamente na região do UV-vis. Definida
experimentalmente qual a melhor ordem de grandeza da concentração, foi traçada
uma curva de calibração.
Os experimentos de fotocatálise foram realizados irradiando-se 50 mL de uma
solução hidroalcóolica de 17MT, na concentração que apresentou melhor perfil
espectrofotométrico, na presença de 5,5 mg de catalisador por 120 min. Antes de
iniciar a irradiação as amostras foram deixadas 30 min sob agitação para se
estabelecer o equilíbrio entre o analito e o catalisador. Este intervalo de
tempo tinha também por objetivo verificar se ocorria adsorção do analito na
superfície do catalisador.
Para a irradiação foi empregado um gabinete de irradiação que consiste
basicamente de uma caixa de MDF, tendo em seu interior um agitador magnético
colocado sobre um lab-jack, estando a lâmpada posicionada de Hg de média pressão
de 125W, cujo bulbo externo foi retirado, na parte superior do gabinete, como
descrito por Schneider et al.(2014). A solução de trabalho estava contida em um
béquer de 50 mL, e a irradiação ocorria pelo topo superior do béquer à uma
distância de 10 cm.
Os experimentos foram monitorados pela aquisição dos espectros de absorção antes
e depois da irradiação acompanhando-se o comprimento de onda de 249 nm. Foi
utilizado como fator de resposta o percentual de redução de absorbância
(%RedAbs) do analito, determinado pela expressão matemática %RedAbs = (1-
(Abs/Abs0))*100.
Resultado e discussão
Inicialmente foram preparados todos os catalisadores segundo o procedimento
descrito anteriormente. Para fins de caracterização foram obtidos os
difratogramas da diatomita (DIA), do dióxido de titânio comercial (DT) e dos
quatro catalisadores preparados (DIA-DTx%). A Figura 1 apresenta o DRX dos três
compostos mencionados (DIA, DT e DIA-DT2,5%), mostrando a correlação entre os
picos dos compostos puros e no compósito.
Os espectros de FTIR de todos os catalisadores preparados (DIA-DTx%) e da
diatomita pura (DIA) foram obtidos empregando-se a técnica de ATR. Todos os
espectros se caracterizam pela presença de uma banda em torno de 1070 cm-1
correspondente a vibração de estiramento assimétrico de Si-O-Si, referente a
estrutura da sílica presente na estrutura da diatomita (Padmanabahn et al.,
2014). Esta banda sofre redução da sua intensidade à medida que a concentração
de TiO2 aumenta na amostra. No espectro da diatomita pura (DIA) observa-se
também uma banda fina, de intensidade moderada, em aproximadamente 790 cm-1.
Esta banda está associada à vibração estiramento simétrico do Si-O-Si
(Padmanabahn et al., 2014). Ao contrário do caso anterior, sua intensidade não é
afetada pelo aumento do teor de TiO2 na amostra, porém ela sofre uma
sobreposição de outra banda centrada em 600 cm-1.
As imagens de MEV (Figura 2). Na imagem da esquerda observa-se a característica
padrão da diatomita, e na imagem a presença de cristais de TiO2.
A partir do experimento para se determinar a melhor concentração de trabalho, ou
seja, aquela que apresentava dentro dos limites de detecção do equipamento, foi
verificado que esta era da ordem de 10^-5 mol L-1. Assim todos os experimentos
de fotodegradação foram realizados empregando-se uma solução de 17MT de nesta
ordem de concentração.
Foi traçada uma curva de calibração da 17MT no intervalo de concentração de 0,5
a 4,5 x 10^-5 mol L-1. O gráfico apresentou excelente ajuste linear dos pontos
com coeficiente de linearidade R^2 = 0,9996.
Por último foram realizados os experimentos de fotodegradação empregando-se uma
solução aquosa de 17MT 5 x 10^-5 mol L-1. O percentual de redução da absorbância
(%RedAbs), parâmetro utilizado para avaliação da eficiência, ficou em torno de
17% para todos os catalisadores preparados (DIA-DTx2,5% = 15%; DIA-DTx5% = 19%;
DIA-DT10% = 16%; DIA-DT15% = 18%).
Verifica-se, pelos valores apresentados anteriormente, que a eficiência de
degradação foi modesta em todos os casos. Segundo Trawinski & Skibinski (2019),
a presença de solventes próticos no meio reduzem a eficiência do processo de
fotocatálise. Considerando que na solução de trabalho a concentração de etanol
era cerca de 3440 vezes superior à concentração do analito (([17MT] = 5x10-^5
mol L-1; [EtOH] = 1,72x10^-1 mol L-1), será necessário uma alteração no arranjo
experimental, excluindo-se a utilização de solventes orgânicos próticos, visando
uma melhora nos resultados.
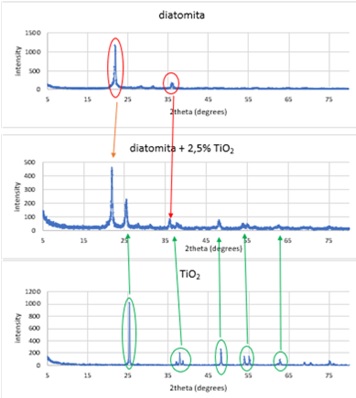
Figura 1 – Difratogramas de raios-x da DIA (superior), DT (inferior) e DIA-DT 2,5% (intermediário).

MEV da DT0% (esquerda) e DT15% (direita) com ampliação de 10000x. Os circulos em vermelho mosrtam o TiO2 na superficie da diatomita
Conclusões
O preparo do compósito diatomita@TiO2, a partir da reação da diatomita com
isopropóxido de titânio, em meio etanol-acético foi bem secedida, como mostram os
difratogramas de raios-X, espectros de FTIR e imagens de MEV.
Entretanto os catalisadores preparados apresentaram baixa eficiência na
fotocatálise da 17MT (19%) no arranjo experimental utilizado nos ensaios.
Uma das providências será evitar o uso de solventes orgânicos próticos (álcoois)
no preparo das soluções-estoque do fármaco estudado, visto que esse pode atuar
como supressor de radicais hidroxila no meio.
Agradecimentos
Agradecimentos à Fundação Araucária e a CAPES
Referências
Chaturvedi, P.; Shukla, P.; Giri, B. S.; Chowdhary, P.; Chandra, R.; Gupta, P.; Pandey, A. (2021). Prevalence and hazardous impact of pharmaceutical and personal care products and antibiotics in environment: A review on emerging contaminants. Environmental Research, v. 194, 110664.
Lopes, L.G.; Marchi, M.R.R.; Souza, J.B.G.; Moura, J.A.; Lorenzon, C.S.; Cruz, C.; Amaral, L.A.. (2010). Estrogênios em águas naturais e tratadas da região de Jaboticabal-São Paulo. Química Nova, 33, 639-643.
Nunes, L.S. & Tonini, W.C.T. (2019). Eficiência do hormônio metiltestosterona na masculinização de tilápia do Nilo (Oreochromis niloticus). Revista Sertão Sustentável, 1, 20-25.
Padmanabahn, S. K.; Pal, S.; Haq, E. U.; Licciulli, A. (2014). Nanocrystalline TiO2- diatomite composite catalysts: Effect of crystallization on the photocatalytic degradation of rhodamine B. Applied Catalysis A: General, v. 485, 157-162.
Rodriguez-Narvaez, O. M.; Peralta-Hernandez, J. M.; Goonetilleke, A.; Bandala, E. R. (2017). Treatment technologies for emerging contaminants in water: A review. Chemmical Engineering Journal, v. 323, 361-380.
Schneider, M. V.; Rosa, M. F.; Lobo, V. S.; Bariccatti, R. A. (2014). Degradação fotocatilítica da bentazona com TiO2. Engenharia Sanitária e Ambiental, 19, 61-66.
Shahid, M. K.; Kashif, A.; Fuwad, A.; Choi, Y. (2021). Current advances in treatment technologies for removal of emerging contaminants from water – A critical review. Coordination Chemistry Reviews, v. 442, 213993.
Sun, Z.; Hu, Z.; Zheng, S. Effect of preparation conditions on the characteristics and photocatalytic activity of TiO2/purified diatomite composite photocatalysts. (2014). Applied Surface Science, 314, 251-259.
Taheran, M.; Naghdi, M.; Brar, S. K.; Verma, M.; Surampalli, R. Y. (2018). Energing contaminants: Here today, ther tomorrow! Environmental Nanotechnology, Monitoring & Manegement, v. 10, 122-126.
Tijani, J.O.; Fatoba, O.O; Babajide, O.O.; Petrik, L.F. (2016). Pharmaceuticals, endocrine disruptors, nanomaterials and perfluorinated pollutants: a review. Environmental Chemistry Letters, 14, 27-49.
Trawinski, J.; Skibinski, R. (2019). Rapid degradation of clazapine by heterogeneous photocatlysis. Comparison with direct photolysis, kinectics, identification of transformation products and scavenger study. Science of the Total Environment, v. 665, 557-567
Wang, B.; Godoi, F. C.; Sun, Z.; Zeng, Q.; Frost, R. L. (2015). Synthesis, characterization and activity of an immobilized photocatalyst: Natural porous diatomite supported titania nanoparticles. Journal of Colloid and Interface Science, v. 438, 204-211.
Wang, B.; Godoi, F. C.; Zheng, S.; Gentle, I. R.; Li, C. (2016) Enhanced photocatalytic properties of reusable TiO2-loaded natural porous minerals in dye wastewater purification. Powder Technology, v. 302, 426-433.
Xia, Y.; Li, F.; Jiang, Y.; Xia, M.; Xue, B.; Li, Y. (2014). Interface actions between TiO2 and porous diatomite on the structure and photocatalytic activity of TiO2-diatomite. (2014). Applied Surface Science, v. 303, 290-296.
Zanardi, M.F.; Koberstein, T.C.R.D.; Urbinati, E.C.; Fagundes, M.; Santos, M.A.; Mataqueiro, M.I. (2011). Concentrações de hormônio na carcaça de tilápias-do-nilo e maturação precoce após reversão sexual. Revista Brasileira de Zootecnia, 40, 7-11.
















