Autores
Klaiss Luna, M.C. (UNIVERSIDAD DE ANTIOQUIA) ; Jemioła Rzemińska, M. (JAGIELLONIAN UNIVERSITY) ; Strzałka, K. (JAGIELLONIAN UNIVERSITY) ; Manrique Moreno, M. (UNIVERSIDAD DE ANTIOQUIA)
Resumo
Los péptidos bioactivos han surgido como potenciales candidatos para el
tratamiento del cáncer. LTX-315 es un péptido sintético de 9 residuos,
catiónico, activo contra células tumorales bajo un mecanismo de acción
membranolítico e inmunogénico. El objetivo de este estudio fue evaluar la
interacción de LTX-315 con los lípidos PC, PE, SM, PS y modelos lipídicos
representativos de membrana tumoral y no tumoral, a través de espectroscopia
infrarroja y calorimetría diferencial de barrido. Los resultados destacan la
selectividad de LTX-315 hacia el modelo de membrana tumoral debido a la
atracción electrostática con la fosfatidilserina. Adicionalmente, se pudo
determinar que el péptido LTX-315 no presenta cambios en su estructura
secundaria que puedan ser asociados a su actividad biológica
Palavras chaves
Cáncer; Interacción LípidoPéptido; LTX-315
Introdução
Los péptidos han demostrado ser una de las familias moleculares con mayor
actividad de amplio espectro como agentes antifúngicos, antivirales,
antibacterianos y anticancerosos, por lo que han surgido como candidatos
prometedores para la búsqueda de nuevos fármacos (RAHEEM y STRAUS, 2019). LTX-
315 (K-K-W-W-K-K-W-Dip-K-NH2), es un péptido sintético, catiónico (+ 6) a pH
fisiológico y con reportada actividad contra melanoma avanzado, sarcoma de
tejidos blandos, carcinoma de células basales y cáncer de seno (CAMILIO et al,
2019), (EIKE et al, 2015), (HAUG et al, 2016); (NIELSEN et al, 2022). Este
péptido ejerce su actividad anticancerígena a través de un mecanismo de acción
membranolítico, seguido de muerte celular inmunogénica (SPICER et al, 2021). Su
selectividad hacia las células cancerosas está relacionada con la interacción
entre los residuos cargados positivamente del péptido y las moléculas cargadas
negativamente presentes en las células tumorales como la fosfatidilserina en la
monocapa externa de la membrana (HOSKIN y RAMAMOORTHY, 2008), (SPICER et al,
2021).
Los modelos de membrana son sistemas útiles para estudiar la composición, carga
y fluidez de las células bajo estudio (KLAISS-LUNA y MANRIQUE-MORENO, 2022).
Estos sistemas se preparan fácilmente en el laboratorio y con el uso de técnicas
biofísicas se puede realizar el seguimiento de las interacciones lípido-péptido,
lo que podría entender la dinámica del mecanismo de acción del péptido (LUCHINI
y VITIELLO, 2021). Este estudio tuvo como objetivo evaluar la interacción entre
el péptido LTX-315 con modelos de membrana tumoral y no tumoral, incluida su
estructura secundaria a través de espectroscopia infrarroja con transformada de
Fourier (FT-IR) y calorimetría diferencial de barrido (DSC).
Material e métodos
Análisis del comportamiento termotrópico de los sistemas lipídicos por DSC: Se
pesaron cantidades apropiadas de DPPC, DPPE, SM, DPPS, y de mezclas de sistemas
representativos de membrana no tumoral PC/SM/PE 4.35:4.35:1(p/p) y tumoral
PC/SM/PE/PS 4.35:4.35:1:0.3(p/p)(ALMARWANI et al, 2018) para obtener una
concentración 1 mM. Los lípidos se disolvieron en cloroformo y el solvente se
secó bajo N2(g). Para el control, las mezclas fueron hidratadas con buffer
(HEPES 10 mM, NaCl 500 mM, 1 EDTA mM, pH 7.4) con vortex por 7 min a una
temperatura por encima de la transición de fase principal de los lípidos. Para
las diferentes concentraciones de péptidos, este se resuspendió en buffer y se
adicionó a 1, 5 y 10% de concentración molar del lípido. Las mediciones se
realizaron en un Calorímetro NANO DSC Series III (WatersTM, USA), a un
calentamiento de 1°C/min. Determinación del cambio conformacional de LTX-315: Se
preparó una solución 1mM de LTX-315 en buffer (HEPES 10 mM, NaCl 500 mM, EDTA 1
mM, pH 7.4). Se pesaron cantidades adecuadas de POPC/SM/POPE 4.35:4.35:1 (p/p) y
POPC/SM/POPE/POPS 4.35:4.35:1:0.3 (p/p) para obtener los modelos de membrana no
tumoral y tumoral a una concentración 6mM. Cada mezcla se disolvió en
cloroformo, se evaporó el solvente bajo N2(g) y se hidrató con buffer. Se
formaron vesículas unilamelares pequeñas (SUV) sonicando las muestras por encima
de la temperatura de transición de los lípidos durante al menos 15 min. Para la
determinación de la estructura secundaria se adicionó LTX-315 a la suspensión de
liposomas a una proporción 15% molar. Los experimentos se realizaron a 37°C en
una celda AquaSpec, Tensor II (Bruker Optics, Alemania) con resolución espectral
4 cm−1 y 120 scans por espectro. La predicción de la estructura se realizó con
el método BPROT1
Resultado e discussão
De acuerdo con los resultados de la figura 1 LTX-315 no induce cambios en el
comportamiento termotrópico de PC y PE. Por el contrario, la formación de
vesículas de SM demostró ser susceptible a la presencia del péptido de manera
proporcional a la concentración evaluada. Los resultados con PS muestran una
fuerte interacción, con la presencia de hasta 3 fases en los termogramas. Lo
anterior demuestra que la atracción electrostática es un factor determinante en
la interacción y selectividad del péptido hacia las membranas tumorales. Se
continuó con la evaluación con los modelos lipídicos representativos de la
membrana celular tumoral y no tumoral. Los resultados en la figura 2 muestran
una mayor interacción del péptido con el modelo de membrana tumoral a altas
concentraciones; esto concuerda con lo reportado en la literatura, ya que LTX-
315 ha mostrado ser selectivo hacia las células tumorales debido a su carácter
catiónico(SPICER et al, 2021). Por último, dado que la mayoría de los péptidos
experimentan un cambio de plegamiento cuando interaccionan con membranas
celulares, se determinó la estructura secundaria de LTX-315 en buffer y en los
dos modelos de membrana. Los resultados mostraron que el péptido evidenció tener
una conformación aleatoria independiente del ambiente en el que fue evaluado.
Los resultados sugieren que las moléculas peptídicas son atraídas
electrostáticamente a la superficie de la bicapa lipídica y allí el péptido
inserta sus residuos hidrofóbicos en el núcleo de la membrana. Sin embargo, el
plegamiento del péptido es desfavorable, posiblemente por el número de
aminoácidos que lo conforman. No obstante, aún se requieren estudios estructura-
actividad para comprender totalmente el mecanismo de acción y la interacción
biofísica con las membranas modelo.
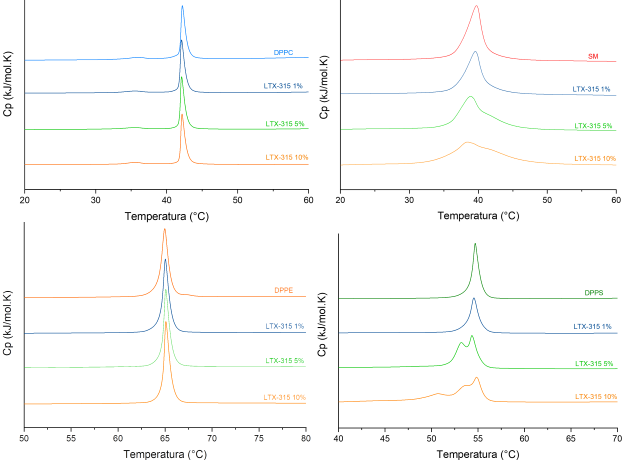
Efecto de LTX-315 en el comportamiento termotrópico de PC,SM,PE,PS bajo los porcentajes molares 1,5,10 en buffer HEPES 10mM NaCl 500mM EDTA 1mM pH 7.4
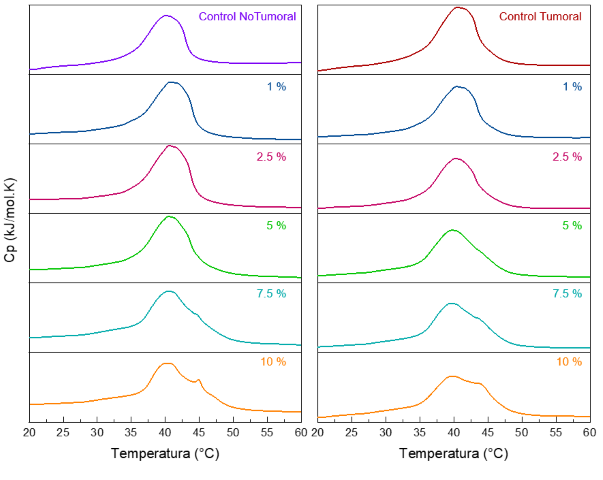
Termogramas DSC de modelos de membrana no tumoral y tumoral con LTX-315 al 1, 2.5, 5, 7.5, 10% molar en buffer HEPES 10mM NaCl 500 mM EDTA 1 mM pH 7.4
Conclusões
LTX-315 demostró ser selectivo hacia el modelo de membrana tumoral y generar un
efecto dependiente a la concentración. Además, se pudo determinar que el péptido
no presenta estructura helicoidal, independiente del ambiente acuoso y lipídico
evaluado. Los resultados de este estudio se correlacionan con los reportes sobre
la actividad antitumoral de LTX-315.
Agradecimentos
Este trabajo fue financiado por el Ministerio de Ciencia Tecnología e innovación-
MinCiencias (Proyecto Cód. 111584467189, RC 946-2019).
Referências
ALMARWANI, B.; PHAMBU, E. N.; ALEXANDER, C.; NGUYEN, H. A. T.; PHAMBU, N.; SUNDA-MEYA, A. Vesicles mimicking normal and cancer cell membranes exhibit differential responses to the cell-penetrating peptide Pep-1. Biochimica et Biophysica Acta (BBA)-Biomembranes, 1860(6), 1394-1402, 2018.
CAMILIO, K. A.; WANG, M.Y.; MAUSETH, B.; WAAGENE, S.; KVALHEIM, G.; REKDAL, Ø.; SVEINBJØRNSSON, B.; MAELANDSMO, G.M. Combining the oncolytic peptide LTX-315 with doxorubicin demonstrates therapeutic potential in a triple-negative breast cancer model. Breast Cancer Research, 21(1), 9, 2019.
EIKE, L-M; YANG, N; REKDAL, Ø.; SVEINBJØRNSSON B.The oncolytic peptide LTX-315 induces cell death and DAMP release by mitochondria distortion in human melanoma cells. Oncotarget, 6(33), 34910, 2015.
HAUG, B. E.; CAMILIO, K. A.; ELIASSEN, L. T.; STENSEN, W.; SVENDSEN, J. S.; BERG, K.; MORTENSEN, B.; SERIN, G.; MIRJOLET, J.F.; BICHAT, F. Discovery of a 9-mer cationic peptide (LTX-315) as a potential first in class oncolytic peptide. ACS Publications, 2016.
HOSKIN, D. W.; RAMAMOORTHY, A. Studies on anticancer activities of antimicrobial peptides. Biochimica et Biophysica Acta (BBA)-Biomembranes, 1778(2), 357-375, 2008.KLAISS-LUNA, M.C.; MANRIQUE-MORENO, M. Infrared Spectroscopic Study of Multi-Component Lipid Systems: A Closer Approximation to Biological Membrane Fluidity. Membranes, 12, 2022.
LUCHINI, A.; VITIELLO, G. Mimicking the Mammalian Plasma Membrane: An Overview of Lipid Membrane Models for Biophysical Studies. Biomimetics, 6(1), 3, 2021. NIELSEN, M.; MONBERG, T.; ALBIERI, B.; SUNDVOLD, V.; REKDAL, O.; JUNKER, N.; SVANE, I.M. LTX-315 and adoptive cell therapy using tumor-infiltrating lymphocytes in patients with metastatic soft tissue sarcoma. Journal of Clinical Oncology, 40(16), 2022.
RAHEEM, N.; STRAUS, S. K. Mechanisms of Action for Antimicrobial Peptides With Antibacterial and Antibiofilm Functions [Review]. Frontiers in Microbiology, 10(2866), 2019.
SPICER, J.; MARABELLE, A.; BAURAIN, J.F.; JEBSEN, N.L.; JØSSANG, D.E.; AWADA, A.; KRISTELEIT, R.; LOIRAT, D.; LAZARIDIS, G.; JUNGELS, C.; BRUNSVIG, P.; NICOLAISEN, B.; SAUNDERS, A.; PATEL, H.; GALON, J.; HERMITTE, F.; CAMILIO, K.A.; MAUSETH, B.; SUNDVOLD, V.; SVEINBJØRNSSON B.; REKDAL, Ø. Safety, Antitumor Activity, and T-cell Responses in a Dose-Ranging Phase I Trial of the Oncolytic Peptide LTX-315 in Patients with Solid Tumors. Clinical Cancer Research, 27(10), 2755-2763, 2021.
















