Autores
Ramos, L.G. (IME; FARMANGUINHOS/FIOCRUZ) ; Câmara, C.C. (BIO-MANGUINHOS/FIOCRUZ) ; de Souza, K.R. (INSTITUTO MILITAR DE ENGENHARIA (IME)) ; Carvalho, S.D. (FARMANGUINOS/FIOCRUZ)
Resumo
Neste trabalho reportamos a síntese, avaliação antitripanossomal e avaliação
citotóxica de uma nova série de fenoxiacetoidrazonas. Todos os derivados foram
avaliados frente a forma tripomastigota sanguínea (cepa Y) e amastigota
intracelular (cepa Tulahuen), cisteíno protease cruzaína e enzima nitroredutase.
O composto (11) mostrou atividade frente a forma tripomastigota (IC50/24 h =
10,3 μM) equivalente ao benznidazol. Em relação a forma
amastigota, o composto (19) foi ativo na ordem de nanomolar (IC50/96 h = 40 nM),
sendo assim 38 vezes mais ativo que o benznidazol. Em relação a
cruzaína, os compostos não apresentaram significativa atividade. O composto 19
mostrou promissora atividade frente a nitroredutase, sendo 5,4 vezes mais ativo
que o benznidazol.
Palavras chaves
Doença de Chagas; Trypanosoma cruzi; N-acilidrazonas
Introdução
Doenças tropicais negligenciadas (DTNs) são definidas pela Organização Mundial
de Saúde (WHO) como um grupo de doenças causadas por vírus, bactérias ou
parasitos, que afetam principalmente a população de áreas tropicais em situação
de vulnerabilidade socioeconômica e são negligenciadas devido principalmente ao
desinteresse da indústria farmacêutica tendo em vista o alto custo de
desenvolvimento de novos fármacos e ao baixo retorno financeiro. Dentre as 20
doenças consideradas como DTNs, está a doença de Chagas, ainda considerada um
problema de saúde pública global (WHO, 2022a).
A doença de Chagas (DCH), também conhecida como tripanossomíase americana, é uma
doença tropical causada pelo protozoário Trypanosoma cruzi (T. cruzi).
Descoberta em 1909 pelo médico e pesquisador brasileiro Carlos Ribeiro
Justiniano Chagas (CHAGAS, 1909), possui como principais vetores insetos
hematófagos do gênero Triatoma, conhecidos popularmente como “barbeiro”. É
endêmica nos 21 países da américa na Latina. Acomete de 6 a 7 milhões de pessoas
e a migração pode levar esta doença a outros continentes, como o europeu,
africano e asiático colocando 75 milhões de pessoas em risco de contaminação e
levando a aproximadamente 10.000 mortes ao ano (WHO, 2022b).
Pode ser transmitida por via vetorial, por transfusão de sangue ou transplante
de órgãos, por via oral, por via congênita ou mesmo ocasionado por acidente de
laboratório (DE OLIVEIRA; SOCCOL; ROGEZ, 2019; GÓES COSTA et al., 2017). Em
áreas endêmicas a infecção se dá principalmente de forma vetorial, em
contrapartida nas não endêmicas prevalece as demais formas de contaminação. Em
abril de 2021, em comemoração ao Dia Mundial da Doença de Chagas, celebrado pela
primeira vez em 14 de abril de 2020 pela OMS (WHO, 2021c), o Ministério da Saúde
publicou o último boletim epidemiológico da doença, confirmando em 2020 146
casos de doença de Chagas aguda (DCA) com letalidade de 2% (3/146) no estado do
Pará, sendo a transmissão oral responsável por esses números. De acordo com esse
observatório, as prováveis formas de transmissão ocorridas no país nesse período
foram 75% por via oral, 7% vetorial e 18% não foram identificadas (MINISTÉRIO DA
SAÚDE, 2022a).
A contaminação através da transfusão de sangue tem diminuído ao longo dos anos,
principalmente devido ao controle sorológico para T. cruzi nos bancos de sangue,
através da realização de exames de triagem. Entretanto a contaminação oral,
através da ingestão de alimentos contaminados com o macerado do vetor e/ou suas
excretas, principalmente como o açaí e o caldo de cana tem apresentado grande
preocupação (MINISTÉRIO DA SAÚDE, 2021b). Outra forma de transmissão consiste na
infecção transplacentária, ou seja, congênita, podendo a mãe infectada
transmitir a doença ao bebê durante a gestação ou mesmo no parto. A doença
apresenta-se em duas fases: aguda e crônica. A fase aguda inicia-se logo após o
período de incubação do protozoário, que pode variar de 4 a 40 dias de acordo
com a forma de infecção. Entretanto na maior parte dos casos não há evidências
de sintomas, ou mesmo há a presença de sintomas leves e comuns, confundindo-se
com infecções cotidianas, fato que prejudica e atrasa o diagnóstico correto. A
fase crônica, caracteriza-se por um estágio mais avançado da doença, estando o
parasito no coração e nos músculos digestivos, podendo dessa forma manter-se
assintomática por anos, chamado assim de fase crônica indeterminada. Este
estágio compreende cerca de 70 % dos pacientes diagnosticados com DCH (CALDAS;
SANTOS; NOVAES, 2019). Se sintomático, o estágio crônico avançado, acomete
principalmente o sistema digestivo ocasionando o alargamento do cólon ou do
esôfago, e ao coração levando a arritmia e insuficiência cardíaca, sendo esta a
principal de causa óbito (FIOCRUZ, 2017).
Material e métodos
Visando incorporar o perfil inibidor de cruzaína e tripanocida aos novos
derivados fenoxiacetoidrazonas, foi explorado no planejamento estrutural o
conceito de hibridação molecular pela escolha de dois potentes agentes
antiparasitários: o derivado 1, por apresentar uma subunidade farmacofórica
fenólica responsável pela atividade sobre a cruzaína expressa em IC50 = 0,21 µM
e, 2 contendo uma subunidade hidrazona que demonstrou caráter farmacofórico in
vitro sobre as formas tripomastigotas de T. cruzi (IC50 = 5,3 µM), possivelmente
interferindo no metabolismo oxidativo (Figura 1).
Baseado no planejamento molecular, a primeira série das fenoxiacetoidrazonas foi
sintetizada explorando a variação de substituintes na subunidade Ar/Het (3 - 19)
(CAPELINI et al., 2021). A escolha desses substituintes foi feita em
reconhecimento às suas propriedades químicas e farmacocinéticas
significativamente diferentes sobre o anel aromático de forma a avaliar como
estas propriedades poderiam influenciar seu perfil antiparasitário (MEANWELL,
2017). Os compostos foram sintetizados, caracterizados, e avaliados frente a
forma tripomastigota (cepa Y), amastigota (cepa Tulahuen), cruzaína e
nitroredutase.
Resultado e discussão
A rota sintética planejada para a síntese das NAH (3-19) consistiu em 3 etapas
(Figura 1). Na primeira etapa o éster foi obtido pela reação de substituição
nucleofílica de segunda ordem (SN2), entre o ânion fenolato e o 2-bromoacetato
de metila. Nesta metodologia, a formação do fenóxido (nucleófilo) ocorre na
presença de carbonato de potássio para a formação da base conjugada. O emprego
desta reação clássica permitiu obter o fenoxiacetato de metila (22) em 90 % de
rendimento. O composto foi confirmado pelo espectro de infravermelho pelo
desaparecimento da banda de absorção em 3313 cm-1 referente a hidroxila do fenol
e ao aparecimento das bandas em 1758 e 1738 cm-1 referente a carbonila do éster.
A hidrazonólise do éster gerou o intermediário chave N-acilidrazida (23) em 95 %
de rendimento, confirmado pelo desaparecimento do sinal do grupo metila em 3,70
ppm e o aparecimento dos sinais dos grupos NH2 e NH em 4,33 e 9,33 ppm
respectivamente. Os compostos finais (3-19) foram obtidos pela adição à
carbonila seguida pela eliminação de água nos correspondentes aldeídos
(Het/ArCHO) usando ácido clorídrico como catalisador e água como solvente. Os
produtos foram confirmados pelos sinais no RMN 13C do carbono imínico dos
confôrmeros na faixa de 131,2-148,3.
Fenoxiacetoidrazonas existem em equilíbrio entre dois confôrmeros, onde os
hidrogênios de N-H encontram-se antiperiplanar (ap) ou sinperiplanar (sp) em
relação ao oxigênio da carbonila. O HPLC e o RMN 1H foram consistes com a
formação de somente um isômero geométrico em relação a ligação imínica, no qual
a difração de raio-X o indicou com configuração relativa (E).
Os compostos caracterizados e puros foram analisados frente ao parasito.
Inicialmente analisou-se o efeito dos compostos frente a forma tripomastigota de
T. cruzi (cepa Y, DTU II). A avaliação in vitro frente a este ensaio, mostrou
que o composto 11 foi o mais ativo, com IC50/24 h = 10,3 µM, equivalente ao
benznidazol (IC50/24 h = 8,8 µM). Para avaliar a contribuição do grupo
hidroxila, foi comparado a atividade com os diferentes análogos 9, 12, 13, 14 e
16. Observou-se assim uma redução na atividade destes, mostrando assim a
importante contribuição dos dois grupos hidroxilas do catecol na atividade
tripanocida (Figura 2).
Em relação aos substituintes da fenila, os 4 derivados mais ativos possuem o
grupo hidroxila (9, 10, 11 e 13), sendo 3 destes apresentando hidroxila na
posição para. O derivado nitrofurânico (19) também apresentou significante
atividade (IC50/24 h = 19,11 µM). Os derivados substituídos na posição para (4-
9) assim como o derivado trissubstituído (15), não apresentaram atividade
tripanocida, com exceção de 9 (4-OH) com IC50/24 h = 53,3 µM.
Analisou-se também a contribuição desses compostos frente a cepa Tulahuen (DTU
VI) considerando sua suscetibilidade a derivados nitro. Todos os compostos (4-
19) foram avaliados frente a forma amastigota da cepa Tulahuen. O Composto mais
ativo foi o derivado nitrofurânico (19) com IC50/96 h = 40 nM, sendo 38 vezes
mais ativo que o Benznidazol (IC50/24 h = 1,5 µM). Os compostos para
substituídos (4-9), 17, 12-14 e 16 apresentaram moderada atividade. O derivado
trisubstituído (15) foi inativo, e o derivado o-OH (10), o qual foi planejado
para aumentar a interação com sítios nucleofílicos da cruzaína apresentou
moderada atividade (IC50/96 h = 22,7 µM). Observou-se nesse estudo que os
melhores resultados foram obtidos na forma amastigota. As diferenças expressas
nos resultados entre cepa Y e Tulahuen podem estar associadas as diferenças
intrínsecas de cada cepa e ao tempo de ensaio conforme os protocolos padrões (24
h e 96 h).
Em relação a cruzaína, os compostos apresentaram baixa inibição, não
prosseguindo assim para a avaliação do IC50. Frente a nitroredutase, os
derivados 18 e 19 foram avaliados devido a sua capacidade de interferirem no
processo de oxirredução do parasito, e o derivado (19) apresentou-se 5,4 vezes
mais ativo que o benznidazol. Evidenciando dessa forma o potencial dos derivados
19 e 11 frente ao T. cruzi.
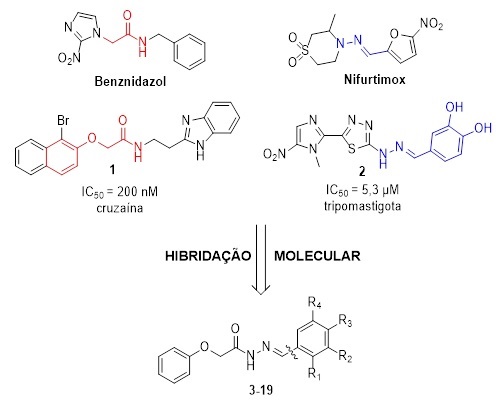
Planejamento molecular dos derivados fenoxiacetoidrazonas (3-19)
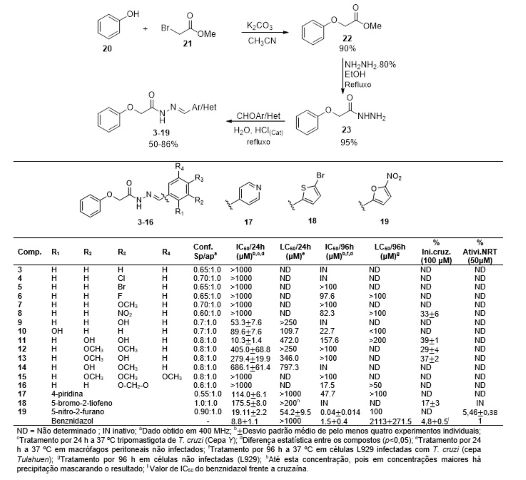
Rota sintética, atividade in vitro, citotoxicidade, e propriedades físicas das fenoxiacetoidrazonas (3- 19)
Conclusões
Descrevemos neste trabalho a síntese, avaliação antitripanossomal e avaliação
citotóxica de novos derivados fenoxiacetohidrazonas frente ambas as formas
infecctivas de T. cruzi, tripomastigota sanguíneo e amastigota intracelular. A
metodologia sintética foi reprodutível com rendimentos globais de 43 % a 74 %. Os
resultados contra a forma tripomastigota de T. cruzi mostrou o composto 11
(IC50/24 h = 10.3 μM) com atividade equivalente ao benznidazol. Em relação a forma
amastigota o composto 19 (IC50/96 h = 40 nM) apresentou promissora atividade.
Frente a inibição da cruzaína os compostos em questão não apresentaram inibição
relevante. Entretanto, frente a nitroredutase o composto 19 apresentou atividade
5,4 vezes maior que o benznidazol utilizado como fármaco de referência. Assim
sendo, os derivados fenoxiacetoidrazonas 11 e 19 forneceram resultados
significativos e foram assim encaminhados para testes in vivo em modelos animais.
Agradecimentos
À Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pelo
financiamento. Agradecemos também ao Serviço de Cristalografia, Southampton, pelos
raio-X realizados, a Fiocruz e ao IME.
Referências
CALDAS, I. S.; SANTOS, E. G.; NOVAES, R. D. An evaluation of benznidazole as a Chagas disease therapeutic. Expert Opinion on Pharmacotherapy, v. 20, n. 15, p. 1797–1807, 1909.
CAPELINI, C.; CÂMARA, V. R. F.; VILLAR, J. D. F.; BARBOSA, J. M. C.; SALOMÃO, K.; de CASTRO, S. L.; SALES-Jr, P. A.; MURTA, S. M. F.; COUTO, T. B.; LOURENÇO, M. C. S.; WARDELL, J. L.; LOW, J. N.; da SILVA, E. F.; CARVALHO, S. A. Synthesis, antitrypanosomal and antimycobacterial activities of coumarinic N-acylhydrazonic derivatives. Medicinal Chemistry. v. 17, n. 6, p. 630-637, 2021.
CHAGAS. Nova tripanozomiaze humana: estudos sobre a morfolojia e o ciclo evolutivo do Schizotrypanum cruzi n. gen., n. sp., ajente etiolojico de nova entidade morbida do homem. Memórias do Instituto Oswaldo Cruz, v. 1, n. 2, p. 159–218, 1909.
DE OLIVEIRA, A; SOCCOL, V. T; ROGEZ, H. Prevention methods of foodborne Chagas disease: Disinfection, heat treatment and quality control by RT-PCR. International Journal of Food Microbiology, v. 301, n. 301, p. 34–40, 2019.
FERREIRA, R. S.; DESSOY, M. A.; PAULI, I.; SOUZA, M. L.; KROGH, R.; SALES, A. I. L.; OLIVA, G.; DIAS, L. C.; ANDRICOPULO, A. D. Synthesis, Biological Evaluation, and Structure–Activity Relationships of Potent Noncovalent and Nonpeptidic Cruzain Inhibitors as Anti-Trypanosoma cruzi Agents. Journal of Medicinal Chemistry, v. 57, n. 6, p. 2380–2392, 2014.
FIOCRUZ, 2017. Organização Estrutural. Fundação Oswaldo Cruz. Disponível em: http://chagas.fiocruz.br/organizacao-estrutural/. Acesso em: 19 mar. 2021.
MEANWELL, N. A. Chapter Five - A Synopsis of the Properties and Applications of Heteroaromatic Rings in Medicinal Chemistry. Advances in Heterocyclic Chemistry, v. 123, p. 245-361, 2017.
MINISTÉRIO DA SAÚDE, 2022a. Boletim Epidemiológico. Número especial, abr. 2021. Disponível em: https://www.gov.br/saude/pt-br/centrais-de conteudo/publicacoes/boletins/epidemiologicos/especiais/2021/boletim_especial_chagas_14abr21_b.pdf Acesso em 15 de fev. de 2022
MINISTÉRIO DA SAÚDE, 2022b. Doença de Chagas: o que é, causas, sintomas, tratamento e prevenção. 2021. Disponível em: https://antigo.saude.gov.br/saude-de-a-z/doenca-de-chagas. Acesso em: 19 mar. 2022.
WHO, 2022a. Neglected tropical diseases. Disponível em: https://www.who.int/health-topics/neglected-tropical-diseases#tab=tab_1. Acesso em: 29 mar. de 2022.
WHO, 2022c. Chagas disease (American trypanosomiasis). Disponível em: https://www.who.int/health-topics/chagas-disease#tab=tab_1. Acesso em: 30 mar. de 2022.
WHO, 2021c. World Health Organization. World Chagas Disease Day. Disponível em: https://www.who.int/campaigns/world-chagas-disease-day. Acesso em 16 de abr de 2021.
















