Autores
Ardila-chantré, N. (UNIVERSIDAD NACIONAL DE COLOMBIA – SEDE BOGOTÁ) ; Barragán-cárdenas, A.C. (UNIVERSIDAD NACIONAL DE COLOMBIA – SEDE BOGOTÁ) ; Fierro-medina, R. (UNIVERSIDAD NACIONAL DE COLOMBIA – SEDE BOGOTÁ) ; Parra-giraldo, C.M. (PONTIFICIA UNIVERSIDAD JAVERIANA – SEDE BOGOTÁ),) ; Rivera-monroy, Z.J. (UNIVERSIDAD NACIONAL DE COLOMBIA – SEDE BOGOTÁ) ; García-castañeda, J.E. (UNIVERSIDAD NACIONAL DE COLOMBIA – SEDE BOGOTÁ)
Resumo
Los péptidos son una alternativa para el tratamiento del cáncer de cuello uterino
gracias a las ventajas que presentan por su tamaño, estructura, espectro de
acción, mecanismo de acción y especificidad (ERAK et al., 2018). La estrategia de
formación de péptidos quiméricos permite obtener nuevas moléculas a partir de la
unión de secuencias peptídicas bioactivas con el objetivo de mejorar sus
propiedades y/o conferir o potenciar una actividad biológica (WANG et al., 2019).
Esta investigación se basa en el diseño e identificación de nuevos agentes
citotóxicos basados en péptidos, a través del diseño y síntesis de quimeras a los
cuales se les evaluó su toxicidad in vitro frente a la línea celular humana
derivada de cáncer de cuello uterino HeLa.
Palavras chaves
SPPS; quimeras peptídicas; citotoxicidad
Introdução
En la actualidad existen tratamientos farmacológicos para el cáncer de cuello
uterino, sin embargo, están restringidos a terapias convencionales que no
ofrecen especificidad, no evitan la recurrencia de la enfermedad y generan
efectos adversos severos. Es por esto que se considera esencial trabajar en el
desarrollo de nuevos fármacos eficaces para tratar la enfermedad. Es aquí, en
donde los péptidos son considerados como una alternativa viable ya que se pueden
obtener a través de la SPPS, un método versátil y rápido que permite obtener
péptidos modificados con alta pureza. Esta versatilidad se refleja en que es
posible obtener péptidos quiméricos en los cuales se unen dos secuencias con el
objetivo de mejorar sus propiedades, generar y/o potenciar la actividad
biológica, mejorar la selectividad e incluso disminuir la toxicidad (WANG et
al., 2019).
Esta investigación se basa en el diseño, obtención e identificación de nuevas
moléculas peptídicas con propiedades citotóxicas que contienen la secuencia
RRWQWR y secuencias de péptidos funcionales.
La secuencia de partida 20RRWQWR25 es considerada como el motivo mínimo de
actividad de la Lactoferricina Bovina (LfcinB) ya que secuencias derivadas de
este motivo han presentado actividad anticancerígena in vitro contra líneas
celulares humanas derivadas de cáncer oral y cáncer de mama (SOLARTE et al.,
2015; BARRAGAN et al., 2020). Por tanto, esta secuencia peptídica permitió
diseñar y obtener los péptidos quiméricos con citotoxicidad mejorada.
Material e métodos
Síntesis: Se utilizó la síntesis de péptidos en fase sólida (SPPS- Fmoc/tBu)
manual. La eliminación del grupo Fmoc se llevó a cabo mediante tratamiento con
4-metilpiperidina al 5% en DMF. La reacción de acoplamiento se realizó con Fmoc-
aminoácido/DCC/6-Cl-HOBt (1/1/1 equiv) en DMF a TA durante 2 h a TA. La
eliminación del grupo Fmoc y la incorporación de cada aminoácido se confirmó
mediante la prueba de Kaiser. La desprotección de la cadena lateral de los
aminoácidos y la separación de los péptidos de la resina se llevó a cabo
mediante tratamiento con una solución de TFA/agua/TIPS/EDT (92,5/2,5/2,5/2,5;
v/v) durante 6–8 h a TA y agitación. Los péptidos crudos se precipitaron por
tratamiento con éter etílico frío, se lavaron con éter etílico y se secaron.
Purificación y caracterización: La purificación se realizó mediante
cromatografía de extracción en fase sólida (SPE) utilizando columnas Supelclean
(INSUASTY, 2019). La caracterización se realizó por HPLC utilizando un
cromatógrafo de líquidos con detector UV/Vis, una columna monolítica Chromolith
C18 (50 × 4,6 mm), fase móvil en gradiente de 5% a 50% en 8 minutos con agua-TFA
al 0,05 % y acetonitrilo-TFA al 0,05%, a flujo 2,0 mL/min y 210 nm. Los péptidos
se caracterizaron por espectrometría de masas.
Citotoxicidad: Se evaluó mediante el ensayo de viabilidad celular por MTT
(LANGDON, 2003). Se cultivaron las células, luego se adicionaron 50 μL del medio
suplementado en 10% SFB y 50 μL del péptido (12,5-200 μg/mL). Se incubó en
condiciones estándar, posteriormente se retiró el medio y se adicionaron 10 μL
de MTT (0,5mg/mL). Se incubaron por el tiempo requerido, después se retiró el
sobrenadante y se reemplazó con 100 μL de DMSO, se incubó por 30 min.
Posteriormente, se realizó la lectura de la densidad óptica a 570 nm.
Resultado e discussão
Se lograron sintetizar quimeras peptídicas que contienen la secuencia 20RRWQWR25
y secuencias de péptidos anticancerígenos, péptidos dirigidos a las células de
cáncer de cuello uterino y péptidos de internalización celular. Las quimeras
peptídicas obtenidas contienen entre 14 y 19 aminoácidos y purezas entre el 85-
99% determinada por RP-HPLC. Además, fueron caracterizadas mediante
espectrometría de masas, en donde se encontró, para todos los casos, la señal
principal correspondió a la relación m/z del ion [M+H]+, donde M es la masa
monoisotópica de la especie deseada. En cuanto a los ensayos de citotoxicidad,
se evidenció que las quimeras peptídicas presentaron mayor citotoxicidad que los
péptidos precursores frente a la línea celular HeLa, particularmente las
quimeras conformadas por la secuencia RRWQWR y péptidos anticancerígenos como
RLLRRLLR y RWQWRWQWR, tuvieron un efecto citotóxico dependiente de la
concentración y rápido. Particularmente se estableció que la combinación del
motivo RRWQWR con secuencias anticancerígenas fue la estrategia más efectiva ya
que estas quimeras presentaron la mayor actividad citotóxica contra las células
HeLa. Conforme a lo anterior, se demuestra que la formación de quimeras es una
estrategia eficaz y versátil para el diseño de agentes citotóxicos basados en
péptidos, ya que fue posible obtener moléculas con propiedades mejoradas, con
mayor citotoxicidad y selectividad contra células derivadas de cáncer de cuello
uterino. Así mismo, se comprobó que el uso de péptidos híbridos es una
estrategia acertada en el diseño de moléculas citotóxicas (WANG et al., 2019).

Valores de IC50 obtenidos para los péptidos frente a la línea celular de cáncer de cuello uterino HeLa.
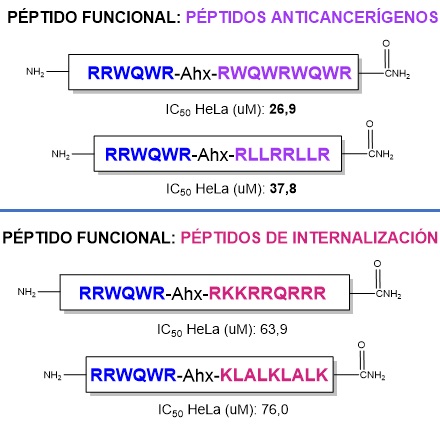
Secuencias de las quimeras peptídicas con los valores de IC50 obtenidos frente a líneas celulares de cáncer de cuello uterino HeLa.
Conclusões
Es viable sintéticamente obtener péptidos quiméricos de alta pureza que contienen
la secuencia RRWQWR conjugada con péptidos funcionales. Las quimeras RRWQWR-Ahx-
RWQWRWQWR y RRWQWR-Ahx-RLLRRLLR exhibieron actividad citotóxica selectiva,
depediente de la concentración y que reducen la viabilidad celular de manera
rápida. Los resultados permiten establecer que la estrategia de formación de
quimeras peptídicas puede ser una opción para obtener moléculas promisorias para
el tratamiento de esta patología.
Agradecimentos
A la Universidad Nacional de Colombia y a MinCiencias por la financiación del
proyecto: código 110180762973, contrato RC No. 706–2018
Referências
BARRAGÁN-CÁRDENAS, A.; INSUASTY-CEPEDA, et al D. The Nonapeptide RWQWRWQWR: A Promising Molecule for Breast Cancer Therapy. ChemistrySelect, 5, 9691–9700, 2020.
ERAK, M.; BELLMANN-SICKERT, K.; et al. Peptide Chemistry Toolbox – Transforming Natural Peptides into Peptide Therapeutics. Bioorganic and Medicinal Chemistry, 26, 2759–2765, 2018.
INSUASTY CEPEDA, D.S.; PINEDA CASTAÑEDA, H.M.; et al. Synthetic Peptide Purification via Solid-Phase Extraction with Gradient Elution: A Simple, Economical, Fast, and Efficient Methodology. Molecules, 24, 1215, 2019.
LANGDON, S.P. Cell Sensitivity Assays: The MTT Assay. Cancer Cell Culture; 2003; Vol. 731, pp. 237–245 ISBN 9781617790805.
LIAN, Z.; JI, T. Functional Peptide-Based Drug Delivery Systems. Journal of Materials Chemistry B 8, 6517–6529, 2020.
SOLARTE, V.A.; ROSAS, J.E.; et al. Tetrameric Peptide Derived from Bovine Lactoferricin Exhibits Specific Cytotoxic Effects against Oral Squamous-Cell Carcinoma Cell Lines. BioMed Research International, 2015.
WANG, C.; YANG, C.; et al. Rational Design of Hybrid Peptides: A Novel Drug Design Approach. Current Medical Science, 39, 349–355, 2019.
















