Autores
Diaz, C. (UNIVERSIDAD ANDRES BELLO) ; Guzman, J.L. (UNIVERSIDAD DE CONCEPCION) ; Alderete, J. (UNIVERSIDAD DE TALCA) ; Jimenez, V. (UNIVERSIDAD ANDRES BELLO)
Resumo
En este trabajo, se funcionalizaron dendrímeros poliamidoamina de tercera generación
(PAMAM-G3) con el fotosensibilizador Chlorin e6 (Ce6), con el propósito de generar un
nanomaterial híbrido y biocompatible para su potencial uso en fototerapia. La conjugación
de PAMAM-G3-Ce6 se realizó al 19% de sustitución de la superficie de PAMAM, con lo cual
se redujo la citotoxicidad del dendrímero nativo y se le confirió fototoxicidad contra las
células cancerosas HeLa, solo cuando el nanomaterial es irradiado con luz roja (628 nm).
Las simulaciones de dinámica molecular confirman que los nanoconjugados PAMAM-G3-
Ce6 adoptan una estructura esférica manteniendo las cavidades dendríticas internas. Esto
último es relevante, pues permitiría su uso en terapia combinada fotodinámica y
quimioterapia.
Palavras chaves
Fototerapia; Chlorin e6; Dendrimeros PAMAM
Introdução
El tratamiento de las patologías ya no se realiza de forma unilateral como en la medicina
tradicional. En este contexto, la fototerapia es una herramienta emergente para tratar
enfermedades agresivas y multifactoriales (Agostinis et al. 2004; Darwish 2021). Los
fotosensibilizadores (PS) como el Chlorin e6 (Ce6) han demostrado varias ventajas en su
aplicación clínica, ya que son inocuos en ausencia de luz y al arradiar con una longitud
de onda específica, generan oxígeno singlete que provoca muerte celular. No obstante, los
PS son poco solubles en agua y no penetran bien en los tejidos; por lo que, este problema
se puede superar acoplando PS a nanomateriales (Bharathiraja et al. 2017).
Los dendrímeros poliamidoamina (PAMAM) son materiales poliméricos hiper-
ramificados. Pueden ser modificados a través de reacciones químicas sencillas, para
darles nuevas propiedades a PAMAM y potenciar su uso como nanocarriers (Diaz et al.
2018; Ortiz et al. 2020). En esta línea, conjugar Ce6 aumentaría la biocompatibilidad de
PAMAM, optimizando sus características fisicoquímicas.
En este trabajo, se desarrolló un sistema conjugado PAMAM de tercera generación
(PAMAM-G3) junto Chlorin e6 (PAMAM-G3-Ce6), para proyectarlo como un nuevo
material híbrido, hidrosoluble y biocompatible de doble función; administración de
fármacos y terapia fotodinámica. PAMAM-G3-Ce6 se utilizarían para eliminar del
organismo células patógenas altamente invasivas y agresivas, por ello, se realizaron
pruebas de fototoxicidad y citotoxicidad en cultivos de células HeLa como modelo de
estudio. Se demostró que el sistema funcionalizado era más biocompatible que el sin
funcionalizar, menos tóxico en la oscuridad y podía causar la muerte celular solo al
irradiar cultivos celulares con luz roja (Díaz et al. 2022).
Material e métodos
SÍNTESIS PAMAM-G3-Ce6: Se disolvió Ce6 (0,15 mmol) en buffer DMSO/HCO3 (1:1).
Luego, se añadió al matraz NHS (0,30 mmol), EDC (0,30 mmol) y TEA (0,30 mmol) y se
agitó la mezcla durante 1 h en oscuridad y T° ambiente. Posteriormente, se disolvió
PAMAM-G3 (25 µmol) en DMSO, se añadió a la reacción y quedó en agitación 24 h. El
producto crudo se purificó por diálisis contra agua y después se liofilizó. El grado de
funcionalización se verificó mediante 1H RMN en DMSO-d6. (Díaz et al. 2022)
VIABILIDAD PAMAM-G3-Ce6: Se evaluó la viabilidad in vitro en cultivos de células HeLa.
Las células se incubaron en una placa de 96 pocillos en medio DMEM modificado, más
diferentes concentraciones (1.0, 10.0 y 100 µM) de PAMAM-G3 y PAMAM-Ce6 (6
repeticiones de cada concentración,) por 24 h a 37°C y 5% CO2. Se retiró el
medio y se reemplazó por medio de cultivo con Alamar Blue. Se empleó DMEM como
control de supervivencia (C+), mientras que se empleó DMSO al 1,0% como control de
muerte (C-). La comparación con los grupos de control se realizó considerando p<0,05
para diferencias significativas. Experimento se realizó en triplicado.
FOTOTOXICIDAD PAMAM-G3-Ce6: Se realizó en las mismas condiciones antes descritas,
en dos placas de 96 independientes. Se incubaron con dendrímero 1h y luego se
reemplazó el medio por medio nuevo. Posteriormente, una placa se expuso a la luz roja
por 3 min a 10 cm de distancia y la otra placa se usó como control. Luego se midió la
viabilidad a 24 h con el kit Alamarblue usando p<0.001 para diferencias significativas
entre los grupos de estudio. (Díaz et al. 2022)
Resultado e discussão
SÍNTESIS DE PAMAM-G3-Ce6: La caracterización de los sistemas mediante 1H RMN
corroboró que la funcionalización fue del dendrímero fue del 19%, lo que corresponde a
6 grupos de Chlorin e 6 unidos a la superficie de un PAMAM de tercera generación (32
grupos disponibles).
Viabilidad celular de PAMAM-G3 y PAMAM-G3-Ce6: Los resultados demuestran que la
funcionalización de los dendrímeros disminuye significativamente la citotoxicidad con
respecto al sistema nativo, en comparación al control de sobrevivencia. El bloqueo de
cargas positivas causados por la conjugación de Ce6 a la superficie fue efectivo dando
biocompatibilidad al sistema.
Efecto fototóxico de PAMAM-G3 y PAMAM-G3-Ce6: Se analizó las propiedades
fototóxicas de Chlorin e6 cuando está acoplado al dendrímero en cultivos de células
HeLa. Esta molécula, produce oxígeno singlete al excitarse con luz roja, gatillando la
muerte celular. Se comparó el efecto de concentraciones crecientes de PAMAM-G3 y
PAMAM-G3-Ce6, desde 1.0 hasta 100 umol/L, en presencia y ausencia de luz, sobre la
proliferación celular. En primer lugar, las células expuestas a la luz no mostraron ver
afectada su viabilidad con respecto al control. Asimismo, el dendrímero sin funcionalizar,
generó similar muerte que en los estudios previos; mientras que el sistema modificado
con Ce6 produjo una caída significativa de la población celular, sobre todo en la
concentración más alta. Con estos antecedentes, observamos un sistema de generación
baja, que es mucho más económico que los de generaciones mayores (G4 o superior), que
con escasa funcionalización (19%) genera un efecto que solo se activa en presencia de la
fuente de radiación y a tiempos (3 min de exposición a la fuente) que no produce impacto
negativo en las células.
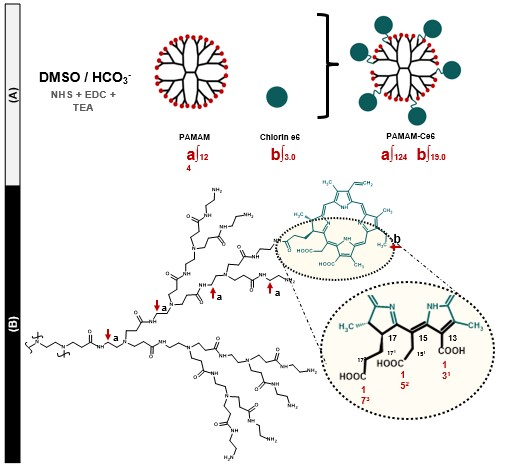
Funcionalización de PAMAM-G3 al 19% de las aminas superficiales
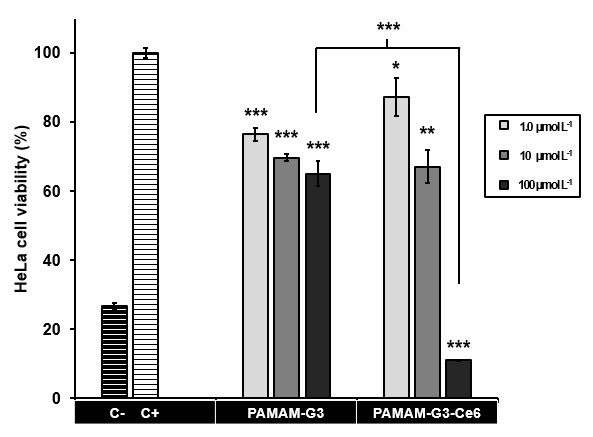
Fototoxicidad evaluada en células HeLa a 24 hrs de incubación.
Conclusões
La unión covalente de Chlorin e6 a PAMAM-G3 permitió aumentar la solubilidad intrínseca
de Ce6, además de su capacidad de producir oxígeno singlete. Por otro lado, la
funcionalización generó un nanomaterial inocuo bajo las condiciones de estudio en células
HeLa en comparación con el dendrímero no funcionalizado. Finalmente, es muy prometedor
que el nanotransportador haya causado la muerte celular de forma selectiva en presencia de
luz roja, porque esto demostró que ni la luz, ni el sistema PAMAM-G3-Ce6 son capaces de
generar daño celular inespecífico por sí mismos.
Agradecimentos
C. Díaz agradece el financiamiento al proyecto FONDECYT 3200546, V. Jiménez
al proyecto FONDECYT 1200204 y J.L. Guzmán al proyecto VRID 2021000249
Referências
Agostinis, Patrizia, Esther Buytaert, Hilde Breyssens, and Nico Hendrickx. 2004. “Regulatory Pathways in Photodynamic Therapy Induced Apoptosis.” Photochemical & Photobiological Sciences 3(8): 721–29. https://pubs.rsc.org/en/content/articlehtml/2004/pp/b315237e (July 11, 2021).
Bharathiraja, Subramaniyan et al. 2017. “Chlorin E6 Conjugated Silica Nanoparticles for Targeted and Effective Photodynamic Therapy.” Photodiagnosis and Photodynamic Therapy 19: 212–20.
Darwish, Wael. 2021. “Polymers for Enhanced Photodynamic Cancer Therapy: Phthalocyanines as a Photosensitzer Model.” Polymers for Advanced Technologies 32(3): 919–30. https://onlinelibrary.wiley.com/doi/full/10.1002/pat.5154 (July 16, 2021).
Diaz, Carola et al. 2018. “Cytotoxicity and in Vivo Plasma Kinetic Behavior of Surface-Functionalized PAMAM Dendrimers.” Nanomedicine: Nanotechnology, Biology and Medicine 14(7): 2227–34.
Díaz, Carola F, Leonardo Guzmán, Verónica A Jiménez, and Joel B Alderete. 2022. “Polyamidoamine Dendrimers of the Third Generation–Chlorin E6 Nanoconjugates: Nontoxic Hybrid Polymers with Photodynamic Activity.” Journal of Applied Polymer Science 139(12): 51835. https://onlinelibrary.wiley.com/doi/abs/10.1002/app.51835.
Ortiz, Natalia et al. 2020. “Polyamidoamine-Based Nanovector for the Efficient Delivery of Methotrexate to U87 Glioma Cells.” Nanomedicine 15(28): 2771–84. https://www.futuremedicine.com/doi/abs/10.2217/nnm-2020-0305 (May 9, 2021).
















