Autores
Miranda de Farias, P.H. (UFPE) ; de Sá Magalhães Vieira, G. (UFPE) ; Bezerra de Moraes Medeiros, E. (UFPE) ; Medeiros de Lima Filho, N. (UFPE)
Resumo
O presente trabalho realizou um estudo de acetilação do glicerol com ácido
acético. Foi realizado um estudo via planejamento fatorial, onde foi realizado
um planejamento entre três parâmetros, Temperatura, carga de catalisador e Razão
de ácido acético:Glicerol. Foram avaliados dois níveis de fatores, o nível alto
e o nível baixo. Para a maior conversão encontrada, X = 90,18%, os parâmetros
reacionais foram utilizados em seus níveis altos. A temperatura apresentou maior
influência na conversão do glicerol. O mecanismo reacional proposto apresentou
um resultado satisfatório, com baixos valores de erros médios percentuais. Com
isso, pode ser utilizado para calcular os valores das constantes cinéticas, e
obteve-se os valores K'2 = 1,13 x[10][/-2], K'3 = 2,06 [10][/-2] e K'4 = 2,70
x[10][/-3].
Palavras chaves
Acetilação; Glicerol; Planejamento fatorial
Introdução
O rápido crescimento da população mundial e o aumento da procura por
combustíveis fósseis, devido à dependência de petróleo e gás natural, têm levado
à escassez dessas fontes (GONÇALVES et al, 2008; REDDY et al,2010). Além disso,
as mudanças mundiais na qualidade do ar e impactos ao meio ambiente levantaram
questionamentos e sérias preocupações, nos últimos anos, sobre o processamento
da matéria prima oriunda de fontes fósseis para fabricação de combustíveis e
solventes. (OKLO, MATSINHA, MAKHUBELA,2019). Assim sendo, a utilização de
combustíveis renováveis vem sendo pesquisada pela comunidade científica, como
fontes de energias mais limpas, reduzindo assim os resíduos dos processos
químicos (GONÇALVES et al, 2008; OKLO, MATSINHA, MAKHUBELA,2019; REDDY et
al,2010). Dentre os combustíveis renováveis se encontram os biocombustíveis.
Esses tipos de combustíveis vêm em contrapartida aos combustíveis derivados do
Petróleo (RAMOS, 2003). Eles são superiores por não possuírem enxofre em sua
composição, evitando assim a formação de gases SOx, no momento da sua queima,
gases causadores de poluição e chuva ácida (MOTA, DA SILVA, GONÇALVES, 2009). Os
biocombustíveis são classificados como primário e secundário. Essa classificação
está focada na origem desse biocombustível. Se for um produto sem processamento,
como lenha in natura e aparas de madeira, esse biocombustível é classificado
como primário. Já o etanol e o biodiesel são oriundos de um processamento da
biomassa, o que os classificam como bicombustíveis secundários (NIGAM, SINGH,
2011). Como um dos principais representantes dos biocombustíveis secundários, o
biodiesel é um éster monoalquílico, podendo ser produzido por meio de gorduras
animais ou óleos vegetais (RAMOS, 2003). O biodiesel vem se tornando cada vez
mais presente na sociedade brasileira, uma vez que a legislação vem exigindo uma
maior porcentagem desse tipo de combustível no diesel oriundo de petróleo. Em
2004, o Brasil iniciou o Programa Nacional de Produção e Uso do Biodiesel, que
previa a adição do biodiesel no diesel fóssil. Nos anos seguintes, sua
concentração cresceu de 3 %, em 2008, a 11%, em 2019, com uma projeção de 15% de
mistura em 2023 (ANP, 2018). O principal meio de produção do biodiesel é pela
transesterificação de óleos vegetais, por meio de uma catálise básica (MOTA, DA
SILVA, GONÇALVES, 2009). Por essa rota sintética, os triacilglicerídeos são
hidrolisados e formam, dentre outros componentes, o Biodiesel e o Glicerol
(SANTOS, 2016). O glicerol é classificado como um tri álcool, com três carbonos
na estrutura. É uma substância incolor, sem cheiro, e muito viscosa (BEATRIZ,
ARAÚJO, LIMA, 2011). O aumento na produção de biodiesel acarretará numa produção
maior de glicerol. Com isso, esse subproduto ficará cada vez mais disponível. A
demanda de glicerol ainda não é o suficiente para a sua oferta, resultando num
excedente desse subproduto. Uma oportunidade de otimizar o rendimento industrial
da produção do biodiesel é transformar esse subproduto gerado em um produto com
maior valor agregado (PEITER,2016). Em 2009, o volume de glicerol produzido como
subproduto da produção do biodiesel, no Brasil, foi de 171.829 m³. Sua produção
em 2018 chegou ao valor de 440.628 m³, mais que dobrando de valor. A região Sul
e Centro-Oeste são as maiores produtoras, 179.155m³ e 175.061m³, respectivamente
(ANP, 2019). Os derivados de glicerol vêm sendo estudado e aplicados em
diferentes áreas. O glicerol pode ser utilizado como solvente em síntese
orgânica. A síntese seletiva de 1,3-Propanodiol foi estudada via hidrogenólise
do glicerol. O 1,3 Propanodiol é amplamente utilizado em diversos setores, como
resinas de poliésteres, tintas, lubrificantes e anti-congelantes
(NAKAGAWA,2010).
A reação de acetilação seletiva do glicerol vem sendo estuda, a fim de se obter
um processo produtivo mais eficiente. Os gliceróis monoacetilados são empregados
como lubrificante de grau alimentício, fabricação de explosivos e biosolventes
(NEBEL, MITTELBACH, URAY, 2008). Diante de alguns trabalhos levantados sobre o
processamento do glicerol oriundo da produção de biodiesel, entende-se a
importância e relevância desse estudo.
Atualmente, a produção de glicerol monoacetilado vêm sendo um desafio. A
desvantagem desse método de produção é que não há um grande controle no número
de acetilações que o glicerol pode sofrer, podendo formar monoacetinas,
diacetinas e triacetinas. Os principais fatores que influenciam a seletividade é
a carga de catalisador, temperatura da reação, tempo de reação e razão molar de
ácido e glicerol (BALARAJU, 2010).
O presente trabalho visa o desenvolvimento de uma nova rota sintética para a
produção de glicerol monoacetilado, com alta pureza e eficiência. Portanto, será
realizado um estudo da reação de acetilação catalítica do glicerol a fim de se
encontrar os principais parâmetros de reação que aumentem a seletividade e a
conversão do glicerol na produção da monoacetina.
Material e métodos
Materiais
Foram utilizados os reagentes ácido acético e glicerol. Os solventes utilizados
na análise do meio reacional por meio da cromatografia líquida de alta
eficiência foram a acetonitrila e água ultrapura.
Metodologia experimental
Os testes reacionais foram realizados em um reator batelada, por agitação
mecânica, acoplado à um condensador de refluxo, com uma manta aquecedora e um
termômetro. O reator foi mantido aquecido, conforme temperatura desejada para
realizar o teste. Na realização dos experimentos, inicialmente foi estabilizado
a temperatura de acordo com a temperatura desejada. Em seguida, foi adicionado o
glicerol, o catalisador e o ácido acético. Foi coletado a amostra inicial para o
tempo de reação igual a zero. O tempo de reação foi estudado até 150 minutos.
Foi realizado um planejamento fatorial dos experimentos, a fim de otimizar o
número de experimentos e poder avaliar três parâmetros reacionais, Temperatura,
Razão Ácido Acético/Glicerol e a Carga de catalisador (% em relação ao
glicerol). Para cada parâmetro foi escolhido dois níveis, o nível alto e o nível
baixo. Dessa forma, a combinação de experimentos realizados pode fornecer quais
parâmetros mais influenciam a reação.
Metodologia Analítica
Para realizar a análise de dados, foi utilizado o método de Cromatografia
Líquida de Alta Eficiência, CLAE, utilizando uma bomba SHIMADZU LC-8a, com um
detector de índice de refração MOD 410, da INSTRUMENTOS CIENTÍFICOS C.G. LTDA.
Foi utilizada uma coluna de fase reversa, C-18, recheio de octadecilsilano, com
fase móvel composta de uma mistura de Acetonitrila:Diclorometano:Água, na
proporção 59,6:0,4:40, respectivamente 27 (LOPES, 2015; GOMES, 2017). A fase
móvel foi acidificada com ácido acético, 4mM.
Resultado e discussão
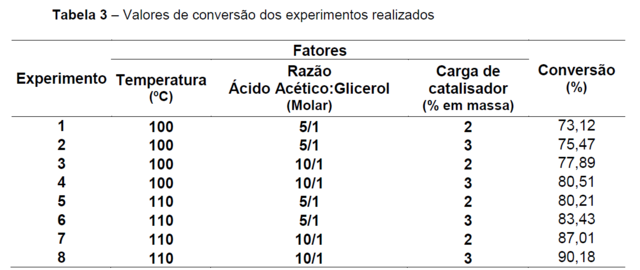
Foram realizados oito experimentos, alterando os parâmetros Temperatura, Carga
de catalisador e Razão ácido acético:Glicerol conforme descrito no planejamento
fatorial. A tabela 1 contém os valores de conversão para cada experimento.
Para melhor avaliar os valores de conversão obtidos, e assim poder avaliar a
influência de cada parâmetro, foi construído um gráfico de cubo. Este gráfico
foi construído com o auxílio de um software comercial Minitab 16. O Minitab é um
software estatístico amplamente utilizado nas empresas com o fim de avaliar
processos industriais e sua variação, muito empregado como auxílio na
metodologia Seis Sigma. Para analisar o gráfico de cubo, é necessário observar
seus vértices, que contém o valor da conversão em cada experimento. Cada vértice
é composto por um conjunto dos três parâmetros, variando entre seus níveis alto
e baixo, 1 e -1, respectivamente. Ao observar o gráfico de cubo, pode-se
perceber a influência de cada parâmetro apenas “andando” entre os vértices e
vendo qual parâmetro está constante. A figura 1.A está o gráfico de cubo
representado com seus níveis alto e baixo.
Para facilitar o entendimento, cada vértice será referenciado com um trio de
símbolos 1 e -1, e será referenciado na ordem (Razão Ácido, Carga de
Catalisador, Temperatura). Portanto, no vértice (-1, -1, -1), temos o valor de
73,12% para a conversão. Andando pelo cubo, seguindo para o vértice (-1, 1, -
1), ou seja, variando o nível da carga do catalisador, pode-se observar um valor
de conversão de 75,47%. Portanto, pode-se afirmar que a carga de catalisador é
um parâmetro que influencia positivamente a conversão do glicerol. Agora,
continuando no vértice (-1, 1, -1) e indo ao (1, 1, -1), ou seja, variando a
Razão do Ácido, pode-se observar que o valor da conversão aumenta de 75,47% para
80,51%. Logo, a Razão de ácido também influencia de forma positiva na conversão
do glicerol. Por fim, saindo do vértice (1,1,-1) para o (1,1,1), variando agora
a temperatura, pode-se perceber um aumento da conversão para 90,18%. Isso atesta
que a temperatura também é um parâmetro que influencia na reação. Portanto, ao
observar o vértice (-1, -1, -1), composto pelos níveis mais baixos de cada
parâmetro, temos a conversão de 73,12%, e no vértice (1, 1, 1), onde representa
os níveis mais altos de cada parâmetro, a conversão encontrada foi de 90,18%.
Variando os três parâmetros pode-se obter uma maior conversão do glicerol.
Como já é sabido que todos esses parâmetros influenciam a reação, é necessário
avaliar qual parâmetro é mais importante na conversão da reação. Para tal, foi
construído um gráfico que é denominado Diagrama de Pareto. Por meio deste, pode-
se observar, em um experimento fatorial, quais efeitos são significantes para a
reação e qual é o parâmetro que mais interfere na conversão. O diagrama de
Pareto foi construído também com o auxílio do software Minitab 16. A figura 1.B
contêm o diagrama de Pareto para o planejamento fatorial deste trabalho.
No eixo horizontal encontram-se os valores dos efeitos padronizados. Esses
efeitos são valores de estatísticas T que testam a hipótese nula de que tal
efeito provocado pelo parâmetro é zero. Quanto maior o valor do efeito
padronizado, maior é a intensidade do seu respectivo parâmetro. Ao observar o
diagrama, pode-se notar que há um traço vermelho cujo valor é 2,78. Esse traço é
denominado Linha de Referência. Os parâmetros que cujos valores dos efeitos
padronizados cruzam essa linha, são os que contêm uma significância estatística.
A linha de referência depende do nível de significância determinado para a
análise, representado por Alpha. O valor de Alpha = 0,05 representa uma
confiabilidade de 95%, pois Alpha = 1 – (Nível de confiança para a análise).
Para verificar a influência de cada parâmetro na conversão, foi construído um
gráfico normal de efeitos padronizado para cada parâmetro. Esse gráfico é
formado por pontos formados pelas médias ajustadas de cada nível do respectivo
parâmetro. A temperatura apresenta uma inclinação maior que os demais
parâmetros. Isso significa que a variação entre os níveis baixo e alto reflete
numa maior variação da conversão. Logo, a temperatura é o parâmetro de maior
magnitude na influência na conversão da reação. A conversão está associada a
reação química. Quanto maior a quantidade de energia cedida à uma reação, maior
é vibração das moléculas, aumentando os choques efetivos para atingir a energia
de ativação da reação. Como a reação é favorecida com o aumento da temperatura,
pode-se inferir que tal reação é endotérmica, ou seja, ela recebe energia para
realizar a reação. Ao comparar este comportamento com outros trabalhos na
literatura, Silva et. al (2010) obtiveram resultados semelhantes ao variar a
temperatura da reação de acetilação com o anidrido acético, entre as
temperaturas 60°C e 120°C.
Seguindo para o parâmetro que apresenta a segunda maior inclinação, a razão de
ácido acético:Glicerol também é um fator importante na taxa de reação de
acetilação do glicerol. Uma maior razão de ácido aumenta a conversão do glicerol
pois há uma maior quantidade de moléculas de ácido acético disponível para
sofrer a reação química. Ou seja, uma maior quantidade de moléculas presente na
reação aumentará a probabilidade de choque efetivo entre o glicerol e o ácido
acético. A reação do ácido acético apresenta uma menor conversão, quando
comparado ao anidrido acético, pelo menor valor de pKa que o anidrido apresenta.
Por ser mais ácido, o anidrido torna-se mais reativo Silva et. al (2010).

Conclusões
O presente trabalho realizou o estudo de acetilação do glicerol com o ácido
acético, com o acetato de sódio como catalisador. Foram utilizadas diferentes
temperaturas, razões de ácido acético:glicerol e diferentes carga de
catalisadores.
Uma maior conversão do glicerol foi observada para as condições: Temperatura –
110ºC, Razão de AA:G – 10:1 e uma carga de catalisador – 3%, cujo valor foi de
90,18%.
E o menor valor de conversão foi para as condições Temperatura – 100ºC, Razão de
AA:G – 5:1 e uma carga de catalisador – 2%, cujo valor encontrado foi 73,12%.
Foi observado que quanto maior forem os valores dos parâmetros estudados,
temperatura, razão de AA:G e carga de catalisador, a formação da triacetina é
favorecida. Pode-se concluir, também, que a temperatura é o parâmetro que mais
influência na conversão e seletividade da reação.
Agradecimentos
Ao Laboratório de processos catalíticos e à Universidade Federal de Pernambuco
pela estrutura para realizar o experimento. À CAPES, CNPQ e FACEPE pelo fomento às
pesquisas.
Referências
AGÊNCIA NACIONAL DO PETRÓLEO (ANP). Anuário Estatístico Brasileiro do Petróleo, Gás Natural e Biocombustíveis 2019.
BEATRIZ, Adilson; ARAÚJO, Yara JK; LIMA, Dênis Pires de. Glicerol: um breve histórico e aplicação em sínteses estereosseletivas. Química Nova, v. 34, n. 2, p. 306-319, 2011.
GONÇALVES, Valter LC et al. Acetylation of glycerol catalyzed by different solid acids. Catalysis Today, v. 133, p. 673-677, 2008.
MOTA, Claudio JA; DA SILVA, Carolina XA; GONÇALVES, Valter LC. Gliceroquímica: novos produtos e processos a partir da glicerina de produção de biodiesel. Química Nova, v. 32, n. 3, p. 639-648, 2009.
NAKAGAWA, Yoshinao et al. Direct hydrogenolysis of glycerol into 1, 3-propanediol over rhenium-modified iridium catalyst. Journal of Catalysis, v. 272, n. 2, p. 191-194, 2010.
NEBEL, Bernd; MITTELBACH, Martin; URAY, Georg. Determination of the composition of acetylglycerol mixtures by 1H NMR followed by GC investigation. Analytical chemistry, v. 80, n. 22, p. 8712-8716, 2008.
NIGAM, Poonam Singh; SINGH, Anoop. Production of liquid biofuels from renewable resources. Progress in energy and combustion science, v. 37, n. 1, p. 52-68, 2011.
OKLU, Novisi K.; MATSINHA, Leah C.; MAKHUBELA, Banothile CE. Bio-Solvents: Synthesis, Industrial Production and Applications. In: Solvents, Ionic Liquids and Solvent Effects. IntechOpen, 2019.
OLIVEIRA, Simone Santos de Sousa et al. Glicerol como solvente verde em eficiente obtenção de beta-hidroxiésteres. Química Nova, v. 37, n. 3, p. 545-548, 2014.
PEITER, Gabrielle Caroline et al. Alternativas para o uso do glicerol produzido a partir do biodiesel. Revista brasileira de energias renováveis, v. 5, n. 4, p. 519-537, 2016.
RAMOS, Luiz Pereira et al. Biodiesel. Revista Biotecnologia Ciência & Desenvolvimento-Edição nº, v. 31, p. 29, 2003.
REDDY, Padigapati S. et al. Synthesis of bio-additives: Acetylation of glycerol over zirconia-based solid acid catalysts. Catalysis Communications, v. 11, n. 15, p. 1224-1228, 2010.
RESOLUÇÃO Nº 16, DE 29 DE OUTUBRO DE 2018. Agência Nacional do Petróleo.
SANTOS, Maísa da Costa. Síntese de solketal a partir de glicerol e seu uso como precursor na síntese de ésteres de solketila e monoacilglicerídeos. 2016.
WONG, Ying-Chieh; JAYANTH, Thiruvellore Thatai; CHENG, Chien-Hong. Cobalt-catalyzed aryl− sulfur bond formation. Organic letters, v. 8, n. 24, p. 5613-5616, 2006.
















