Autores
Gomes, T.M.V. (IQUSP) ; Graziuso, G.M. (IQUSP) ; Ramos, L.D. (IQUSP) ; Stevani, C.V. (IQUSP) ; Bechara, E.J.H. (IQUSP)
Resumo
Espécies carbonílicas excitadas ao estado triplete possuem propriedades de
iniciar reações tipicamente fotoquímicas mesmo na ausência de luz. Neste
trabalho é apresentado o uso dos aminoácidos L-Tyr e L-Met como supressores ou
alvos prioritários da acetona triplete. O sistema isobutanal/peroxidase de raiz
forte, já conhecido como gerador de acetona triplete, foi submetido ao estudo de
supressão com os aminoácidos em questão. Com o tratamento de Stern-Volmer
obtiveram-se as constantes de supressão (kq), 1,1 x 109 L/mol.s para
L-Met e 2,2 x 1011 L/mol.s para L-Tyr, caracterizando processos
controlados principalmente por difusão. Nas análises por HPLC da reação foram
detectados possíveis produtos da reação, tendo sido observado também o consumo
do aminoácido em questão.
Palavras chaves
fotoquímica no escuro; acetona triplete; aminoácidos
Introdução
No início da década de 70, Giuseppe Cilento (IQUSP), Emil White (Johns Hopkins
University) e Angelo Lamola (AT T Bell Laboratories) postularam que reações
tipicamente fotoquímicas poderiam ocorrer no escuro in vivo a partir de
intermediários eletronicamente ricos e excitados, formados na ausência de luz
(CILENTO, 1973; WHITE et al, 1974; LAMOLA, 1971). Essa hipótese paradoxal de
“fotoquímica no escuro” foi quimicamente ancorada pela síntese e estudo de 1,2-
dioxetanos e 1,2-dioxetanonas, cuja termólise gera produtos carbonílicos
excitados ao estado triplete, com tempos de vida relativamente longos e que
apresentam uma quimiluminescência ultra fraca (ultraweak chemiluminescence)
(BECHARA et al, 1979). A oxidação de isobutanal (IBAL) catalisada por peroxidase
de raiz forte (HRP) é um exemplo de reação enzimática que gera acetona triplete,
tendo como intermediário um derivado do 1,2-dioxetano (BECHARA et al, 1979)
(Figura 1).
Danos estruturais à HRP durante a oxidação do IBAL são provenientes da ação da
acetona triplete e radicais formados, principalmente pela abstração de
hidrogênio da porção carbohidrato da enzima (BAADER et al, 2015). O uso do
aminoácido L-Trp mostrou-se eficiente na proteção da estrutura da enzima (RAMOS
et al, 2021), e pode ser o caminho para o desenvolvimento de possíveis
supressores das espécies excitadas. Alterações no metabolismo de L-Tyr e L-Met
estão relacionadas a complicações hepáticas, renais e neurológicas, podendo
culminar em quadros de hipertirosinemia e hipermetioninemia (MORROW et al, 2017;
SOARES et al, 2017). O estudo de mecanismo de reação de espécies carbonílicas
geradas enzimaticamente frente a um quadro de excesso de Tyr e Met pode
contribuir para o desenvolvimento de estratégias terapêuticas que abrandem os
quadros dessas doenças.
Material e métodos
Reagentes e Soluções: Todos os reagentes de mais alto grau de pureza disponível
foram comprados da Sigma-Aldrich e Merk e usados sem prévia purificação, a menos
que seja citado. Soluções estoque e tampão fosfato foram preparados em água
MilliQ®, pré-tratada com Chelex®-100. As soluções de HRP, H2O2 e L-Met foram
preparadas em tampão fosfato 100 mM pH 7,4 com adição de DTPA 0,1 mM. O IBAL foi
previamente destilado e sua solução foi preparada em etanol. A solução estoque
de L-Tyr foi preparada em HCL 0,1 M. Estudos de supressão: A constante de Stern-
Volmer, KSV, foi determinada plotando-se I0/I vs [Q], em que I0 e I são,
respectivamente, a intensidade de quimioluminescência medida em luminômetro
(Berthold, Sirius) na ausência e presença de L-Tyr (2,5 – 50 µM) ou L-Met (0,25
– 2,5 mM), e [Q] é a concentração do aminoácido, de acordo com a equação de
Stern-Volmer I0/I = 1 + KSV[Q]. As constantes cinéticas de supressão (kq) foram
determinadas pela inclinação KSV = kqτ obtida pelo plot de Stern-Volmer, na qual
τ é o tempo de vida da espécie excitada. Os experimentos foram realizados a 37°C
em tampão fosfato (100 mM pH 7,4, DTPA 0,1 mM), IBAL (20 mM), HRP (5 µM), H2O2
(0,5 µM) e concentrações crescentes de L-Tyr e L-Met. Análises em HPLC: As
análises de separação de produtos das reações incubadas em atmosfera de O2 por
24h a 37 ºC foram realizadas em um HPLC (Shimadzu LCMS-2020) com detector UV-Vis
utilizando a coluna Luna C18, 100 Å, 250 x 4,6 mm. Como fase móvel foi utilizado
ácido fórmico 0,05% (fase A) e acetonitrila (fase B). As corridas foram
realizadas em gradiente do eluente, variando a proporção da fase B de 4% até 30%
em 30 min, seguido de um regime isocrático de 30% da fase B por 10 min.
Retornando para 4% da fase B após 1 min mantendo-se até o final da corrida.
Resultado e discussão
Com o aumento da concentração dos aminoácidos, ocorre supressão linear da luz
emitida (Figuras 2A e 2B), suficiente para traçar as curvas de Stern-Volmer,
cujas inclinações (KSV) encontradas foram 1,3 x 103 L/mol e 2,6 x
105 L/mol para L-Met e L-Tyr, respectivamente (Figuras 2C e 2D).
Considerando o tempo de vida da acetona triplete em meio aquoso aerado como 1,2
µs (CATALANI et al, 1987), obtiveram-se os valores das constantes cinética de
supressão (kq) de 1,1 x 109 L/mol.s para L-Met e 2,2 x
1011 L/mol.s para L-Tyr. O valor para a supressão por L-Met é
coerente com um processo controlado por difusão, considerando que o coeficiente
difusional em água é de aproximadamente 5 x 109 L/mol.s (MONTALTI et
al, 2006). No caso da supressão por L-Tyr, esse valor ultrapassa o de uma
supressão controlada por difusão, indicando provavelmente um componente estático
significativo na supressão, como observado para o L-Trp (RAMOS et al, 2021).
Nas análises de HPLC, observou-se um pico intenso com tempo de retenção de
aproximadamente 5 min, em ambos os casos, correspondente ao aminoácido
utilizado. Comparando-se este pico com o padrão de aminoácido, de mesma
concentração, é possível observar seu consumo. Entre 25 - 40 min foi possível
observar picos de menor intensidade possivelmente correspondentes aos produtos
de oxidação e/ou adutos formados com radicais gerados na reação, tanto para L-
Met como para L-Tyr, não observados no controle da reação na ausência dos
mesmos. Estes produtos podem ser a adição direta de radicais terciários e
secundários do IBAL ou da acetona triplete, bem como a oxidação dos aminoácidos
por oxigênio singlete, um produto quase sempre formado em meio aerado na
presença de acetona triplete (RAMOS et al; 2021).
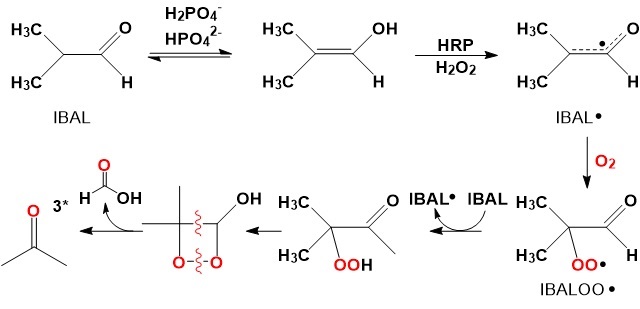
Geração de acetona triplete pela oxidação aeróbica de isobutanal (IBAL) catalisada por HRP (BECHARA et al, 1979).
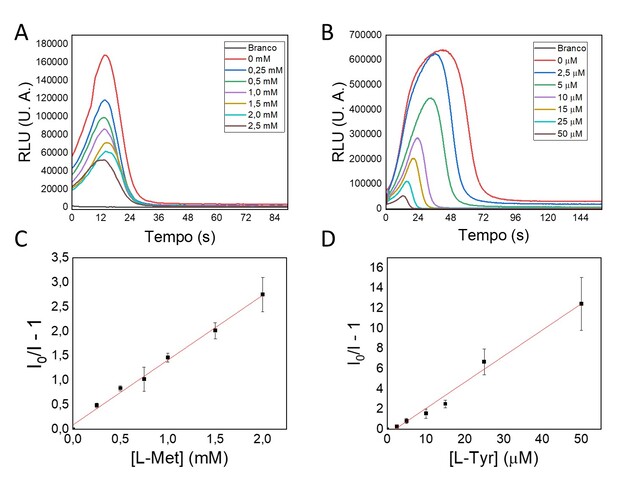
Quimiluminescência do sistema IBAL/HRP em concentrações crescentes de supressor, sendo (A) L-Met, (B) L-Tyr. Stern-Volmer para (C) L-Met, (D) L-Tyr.
Conclusões
Com os dados obtidos é possível mostrar que os aminoácidos L-Tyr e L-Met podem ser
alvos de espécies eletronicamente excitadas, radicais intermediários e
possivelmente oxigênio singlete como sugerido para o Trp (RAMOS et al, 2021). A
supressão colisional (com possível componente estático para L-Tyr), bem como a
obtenção de evidências da formação de produtos apontam para uma cinética de
supressão rápida entre os aminoácidos e a espécie excitada, podendo estes serem
alvos preferenciais destas espécies em sistemas biológicos onde ocorre o acúmulo
destes aminoácidos.
Agradecimentos
Esse trabalho está sendo apoiado pela FAPESP (EJHB e CVS 2017/22501-2, LDR
2019/24515-6; TMVG 2020/04082-5) e pelo CNPq (EJHB 306460/2016-5; CVS 303525/2021-
5; TMVG 140320/2022-9; GMG 161036/2021-0).
Referências
BAADER, WILHELM J., STEVANI, CASSIUS V., BECHARA, ETELVINO J. H. (2015) "Photo" Chemistry Without Light? Journal of the Brazilian Chemical Society, 12: 2430-2447.
BECHARA, E. J. H., OLIVEIRA, O. M. M. F., DURAN, N., BAPTISTA, R. C., E CILENTO, G. (1979) Peroxidase catalyzed generation of triplet acetone. Photochemistry and Photobiology, 30, 101–110.
CATALANI, L. H., WILSON, T., BECHARA, E. J. H. (1987) Two water soluble fluorescence probes for chemiexcitation studies: Sodium 9,10-dibromo- and 9,10-diphenylanthracene-2-sulfonate. Synthesis, properties and application to triplet acetone and tetramethyldioxetane. Photochemistry and Photobiology, 45, 273-281.
CILENTO, G. (1973). Excited electronic states in dark biological process. Quarterly Reviews of Biophysics, 6, 485–501.
LAMOLA, A. (1971) Production of pyrimidine dimers in DNA in the dark. Biochemical and Biophysical Research Communications, 43, 893–898.
MONTALTI, M.; CREDI, A.; GANDOLFI, M. T. (2006) Handbook of Photochemistry, third ed., CRC Press, Boca Raton.M. Montalti, A. Credi, L. Prodi, M.T. Gandolfi, Handbook of Photochemistry, third ed., CRC Press, Boca Raton, 2006.
MORROW, G.; TANGUAY, R. M. (2017) Biochemical and clinical aspects of hereditary tyrosinemia type 1. Advances in Experimental Medicine and Biology, 959:9-21.
RAMOS, L. D., PRADO, F. M., STEVANI, C. V., DI MASCIO, P., BECHARA, E. J. H. (2021) LTryptophan Interactions with the Horseradish Peroxidase-Catalyzed Generation of Triplet Acetone. Photochemistry and Photobiology, v. 97, n. 2.
SOARES, M. S. P.; OLIVEIRA, P. S.; DEBOM, G. N.; MATTOS, B. S.; POLACHINI, C. R.; BALDISSARELLI, J.; MORSCH, V. M.; SCHETINGER, M. R. C.; TAVARES, R. G.; STEFANELLO, F. M.; SPANEVELLO, R. M. (2017) Chronic administration of methionine and/or methionine sulfoxide alters oxidative stress parameters and ALA-D activity in liver and kidney of young rats. Amino Acids, 2017. 49(1):129-138.
WHITE, E. H., MIANO, J. D., WATKINS, C. J., BREAUX, E. J. (1974) Chemically Produced Excited States. Angewandte Chemie International Edition, 13, 229–243.
















