Autores
Garcia, M. (UNIVERSIDAD DE LOS ANDES) ; Tigreros, A. (UNIVERSIDAD DE LOS ANDES) ; Portilla, J. (UNIVERSIDAD DE LOS ANDES)
Resumo
El objetivo de la investigación es obtener sondas fluorescentes de potencial
aplicación en el marcado de biomoléculas, las cuales posean el núcleo de
pirazolo[1,5-a]pirimidina (PP). Considerando las propiedades fotofísicas
demostradas por este fluoróforo, se lleva a cabo la síntesis de nuevos derivados
sustituidos en la posición 3 y 7 con grupos ricos y deficientes en electrones
mediante reacciones de ciclocondensación y de sustitución aromática (SA) en una
secuencia de 4 pasos. Los resultados obtenidos del estudio fotofísico realizado
indican que restringir la rotación de los sustituyentes favorece
significativamente sus propiedades fotofísicas en disolución, además de que la
presencia de átomos de nitrógeno dentro del puente π N-heterocíclico interfiere
con el fenómeno de TCI.
Palavras chaves
Pirazolo[1,5-a]pirimidina; Sondas fluorescentes; Sistema donor-π-aceptor
Introdução
Los fluoróforos orgánicos son moléculas con propiedades fotofísicas atractivas
en diferentes campos de investigación, tales como como en dispositivos orgánicos
emisores de luz (OLEDs, por sus siglas en inglés) (GODUGU e colab., 2021) y
bioimágenes (KIM e colab., 2009). Con la escasez de minerales y las crecientes
necesidades del sector tecnológico, cada vez son más relevantes las
investigaciones hacia el desarrollo de nuevos materiales orgánicos que
sustituyan los metales utilizados actualmente. Por otro lado, las aplicaciones
biológicas de este tipo de compuesto en el reconocimiento de analitos (ZHANG e
colab., 2015), marcadores de células cancerosas (KIM e colab., 2009) y en
ciencias de materiales para el estudio de procesos dinámicos en el área de
polímeros (BOSCH e colab., 2005), sustentan el amplio número de estudios en este
interesante y actual campo de investigación.
El diseño de una amplia gama de fluoróforos con propiedades fotofísicas
determinadas que incluyen la absorción y emisión hacia longitudes de onda larga,
fotoestabilidad, alto coeficiente de absorción molar, alto rendimiento cuántico
y solvatofluorocromismo, atrae la atención de los investigadores debido a que
estos fluoróforos, facilitan el marcaje de biomoléculas con alto grado de
especificidad molecular, propiedad que no se obtiene por ningún otro método de
observación visual. Uno de los fluoróforos orgánicos más utilizados como sonda
fluorescente es el Prodan, que por su alta sensibilidad al cambio en la
polaridad del entorno (solvatofluorocromismo) ha permitido el estudio de una
variedad de sistemas biológicos como membranas celulares y vesículas
fosfolipídicas (PARISIO e colab., 2011).
En esta línea, se han estudiado diversos análogos estructurales del Prodan,
dentro de los cuales se encuentran los compuestos heterociclos. Sin embargo, han
surgido dificultades en la aplicación biológica porque además de los
requerimientos espectroscópicos de este tipo de sonda, también se debe tener en
cuenta que su tamaño no afecte la actividad biológica del organismo o
biomolécula en el que se va a utilizar. Adicional a los requerimientos
fotofísicos y de tamaño, las sondas reportadas presentan inconvenientes como
largas rutas sintéticas y bajos rendimientos globales. De este modo, surge la
necesidad de buscar alternativas para el diseño de sondas fluorescentes con
propiedades fotofísicas deseadas y que se puedan obtener mediante rutas
sintéticas cortas, eficientes y accesibles.
En el Grupo de Investigación de Compuestos Bio-orgánicos – GICOBIORG, se han
desarrollado una serie de estudios sobre las pirazolo[1,5-a]pirimidinas
(TIGREROS e colab., 2021) en donde se han encontrado propiedades fotofísicas
notables que podrían ser útiles para aplicaciones en biología, en
quimiosensores, y otras aplicaciones ópticas. Por lo tanto, el objetivo de esta
investigación es contribuir con el desarrollo de una metodología de síntesis
eficiente y versátil que permita la obtención de derivados de pirazolo[1,5-
a]pirimidina funcionalizados y post-funcionalizadas, como fluoróforos análogos
heterociclos del Prodan, que exhiban propiedades fotofísicas adecuadas para su
posterior aplicación biológica.
Material e métodos
Todos los materiales de partida se pesaron y manipularon en presencia de aire a
temperatura ambiente. Las reacciones se controlaron mediante cromatografía en
capa fina (TLC) visualizada mediante una lámpara UV (254 nm o 365 nm). La
cromatografía de columna se realizó en gel de sílice (malla 230-400). Todas las
reacciones fueron asistidas por microondas CEM Discover SP (ν = 2.45 GHz). Los
puntos de fusión se recogieron usando un aparato de punto de fusión capilar.
Los datos espectroscópicos de RMN se realizaron en un equipo Bruker Avance 400 a
298 K utilizando TMS (0,00 ppm) o el disolvente residual no deuterado como
referencia interna. Los datos espectroscópicos de RMN de 1H (400 MHz) y 13C (101
MHz) se registraron en CDCl3 (δH = 7,26 ppm/δC = 77,0 ppm) o DMSO-d6 (δH = 2,50
ppm/δC = 39,5 ppm). Se usaron espectros DEPT-135 para asignar las señales de
carbono. Los espectros de masas de alta resolución se registraron utilizando un
espectrómetro Agilent Technologies Q-TOF 6520 vía ionización por
electropulverización (ESI). Los espectros de absorción y de emisión fueron
tomados utilizando un espectrofotómetro de UV/Vis Varian Cary 100 y otro de
fluorescencia Agilent Technologies Cary Eclipse, respectivamente.
La estrategia sintética inició con la reacción de ciclocondensación entre 5-
amino-3-metilpirazol y acetoacetato de etilo, con la cual se obtuvo 2,5-
dimetilpirazolo[1,5-a]pirimidin-7-ona. Luego, se llevó a cabo una reacción de
cloración utilizando oxicloruro de fósforo (POCl3) para obtener 7-cloro-2,5-
dimetilpirazolo[1,5-a]pirimidina. Posteriormente, mediante una reacción de
sustitución nucleofílica aromática con aminas secundarias sobre el intermedio,
se logró obtener los 7-aminoderivados sobre los que se llevaron a cabo
reacciones de formilación o acetilación sobre el carbono 3 para obtener las
sondas moleculares deseadas. En la formilación se usaron condiciones de
Vilsmeier-Haack y para la acetilación, se utilizaron las condiciones
recientemente publicadas por el GICOBIORG (ARANZAZU e colab., 2022).
Resultado e discussão
Síntesis: Para confirmar la formación de los compuestos deseados mediante la
ruta sintética propuesta, se realizó su correspondiente caracterización
utilizando Resonancia Magnética Nuclear (RMN) de 1H, 13C, DEPT-135 y espectros
bidimensionales como HSQC y HMBC. Los precursores y productos deseados se
obtuvieron mediante la ruta planteada y en altos rendimientos. La 2,5-
dimetilpirazolo[1,5-a]pirimidin-7-ona en 87%, la 7-cloro-2,5-
dimetilpirazolo[1,5-a]pirimidina en 71%, la 7-(N,N-dietilamina)-2,5-
dimetilpirazolo[1,5-a]pirimidina en 85% y la 2,5-dimetil-7-(1-
pirrolidin)pirazol[1,5-a]pirimidina en 88%. Finalmente, los productos de la
formilación DF y PF se obtuvieron en rendimientos del 68% y cuantitativo,
respectivamente, mientras que los acetilados DA y PA se obtuvieron en 69% y 99%
de rendimiento, respectivamente.
En todos los casos, los rendimientos globales para los compuestos obtenidos son
superiores al del Prodan (DF=35.7; PF=37.5; DA=52.5; PA=53.8; Prodan=30.8
(TAYLOR e colab., 2014)). Asimismo, el rendimiento global para los compuestos
sustituidos con el grupo acetilo es mayor por la eficiencia y regioselectividad
de la reacción en la posición 3 del anillo de PP.
Propiedades fotofísicas: Los espectros de absorción (figura 1) y de emisión
(figura 2) de los compuestos DF, PF, DA y PA fueron medidos en diez diferentes
disolventes: tolueno, terc-butil metil éter (TBME), dioxano, tetrahidrofurano
(THF), cloroformo (CHCl3), diclorometano (DCM), N,N-dimetilformamida (DMF),
acetonitrilo (MeCN), propanol (PrOH) y etanol (EtOH). Las soluciones se
prepararon a 20 °C con una concentración de 1 × 10-5 mol L-1. La longitud de
onda de excitación fue tomada de la longitud de onda de máxima absorción, la
cual correspondió a 340 nm para DF, PF, DA y PA. El coeficiente de absortividad
molar (ε) fue calculado mediante la ecuación de Beer-Lambert (ecuación 1) y el
rendimiento cuántico de fluorescencia se calculó utilizando la ecuación (2)
(WÜRTH e colab., 2013) donde x y st se refieren a la muestra analizada y el
estándar (Prodan), respectivamente. ɸ es el rendimiento cuántico, F es el área
bajo la curva de las bandas de emisión, A es la absorbancia en la longitud de
onda de excitación y η es el índice de refracción de los disolventes.
A= ε*l*c Ecuación (1)
ɸ_(f,x)= ɸ_(f,st)*F_x/F_st *(1-〖10〗^(-AstLst))/(1-〖10〗^(-AxLx) )*
(η_x^2)/(η_st^2 ) Ecuación (2)
Tomando el promedio de los coeficientes de absortividad molar (ε’) de los
compuestos DF, PF, DA y PA, se encontró que excepto para DF, los valores son
mayores en todos los casos que aquellos encontrados para el Prodan. Estos
resultados tienen la siguiente tendencia: DF (ε’ = 10348 M-1 cm-1) < Prodan (ε’
= 15654 M-1 cm-1) < DA (ε’ = 16422 M-1 cm-1) < PA (ε’ = 17609 M-1 cm-1) < PF (ε’
= 23735 M-1 cm-1). Además, se puede inferir que cuando el sustituyente rico en
electrones en la posición 7 es un grupo dialquilamino cíclico como la
pirrolidina (PF y PA), en lugar del grupo dietilamino (DF y DA), los valores de
ε aumentan, lo cual sugiere que esta propiedad está influida por la rigidez del
grupo dador de electrones en dicha posición.
Por otro lado, las longitudes de onda de máxima emisión de los compuestos se
encuentran entre 378 – 388 nm para DF, 374 – 388 nm para PF, 380 – 406 nm para
DA y 375 – 390 nm para PA (Figura 2). El Prodan presentó un comportamiento
solvatofluorocrómico desde 418 nm en tolueno hasta 488 nm en etanol, lo cual
coincide con lo descrito en la literatura (KUCHERAK e colab., 2010). Este
comportamiento batocrómico se puede explicar conforme a lo descrito
anteriormente sobre el proceso de TCI en el estado excitado, que da lugar a la
formación de un estado excitado considerablemente polarizable, que es
estabilizado por el disolvente y permite una emisión hacia una energía más baja.
En contraste, para los compuestos DF, PF, DA y PA, se observó un corrimiento
hipsocrómico de las longitudes de onda de máxima emisión en los disolventes
polares (MeCN, PrOH y EtOH) en relación con los disolventes apolares (tolueno,
TBME y 1,4-dioxano), lo que sugiere que este grupo de compuestos son más polares
en el estado fundamental que en el estado excitado, exhibiendo un leve
solvatofluorocromismo negativo (GONZÁLES-VERA et al, 2020).
Mediante el análisis de Lippert-Mataga se estima que el valor del cambio en el
momento dipolar entre los estados fundamental y excitado (µ* - µ) es pequeño, lo
que explica los bajos desplazamientos de Stokes mostrados en todos disolventes.
Además, la pendiente negativa obtenida mediante este análisis para DF, PF, DA y
PA, confirma el efecto solvatofluorocrómico negativo descrito anteriormente.
Al comparar con otra relación comúnmente utilizada para especificar la
dependencia de los compuestos frente a las propiedades de los disolventes, como
es el caso de la escala multiparamétrica de Catalán (CATALAN, 2009), la cual
tiene en cuenta cuatro propiedades que son: la dipolaridad (SdP), polaridad
(SP), acidez (SA) y basicidad (SB), se encuentra que no hay mejora en la
correlación entre la dipolaridad de los disolventes y los máximos de emisión.
Así mismo, no se evidencia una influencia de SP, SA o SB. Esto indica que las
interacciones soluto-disolvente no son tan fuertes como para el Prodan.
De otro lado, el número de interacciones posibles entre la molécula y el
disolvente aumenta respecto a las del Prodan, generando una pérdida de energía
de forma no radiante ocasionando una baja posibilidad de emitir energía en forma
de fluorescencia. Idealmente, el puente π en un sistema de tipo D-π-A debería
actuar únicamente como el medio por donde se transfieren los electrones; sin
embargo, se presenten interacciones intermoleculares entre las moléculas de
disolvente y los heteroátomos del núcleo heterocíclico de los compuestos, es
decir, el anillo de PP posee átomos de nitrógeno de diferente naturaleza
electrónica a la de los átomos de carbono en arenos. Este tipo de interacciones
favorece la pérdida de energía de forma no radiante y disminuye la
fluorescencia.
De forma particular, con los disolventes polares próticos (EtOH y PrOH), la
intensidad de fluorescencia de los compuestos DF, PF, DA, PA y PDC disminuye a
medida que aumenta la capacidad de donación de enlaces H (EVERETT e colab.,
2010), mientras que los disolventes apróticos apolares, como tolueno o TBME
(incluso con 1,4-dioxano), aumentan el rendimiento cuántico y se tienen un
corrimiento batocrómico en relación con los disolventes próticos polares. En los
entornos polares apróticos (DMF y MeCN), se observa un desplazamiento hacia el
azul en relación a los disolventes apolares apróticos. En todos los casos se
encontró que el rendimiento cuántico era mayor en DMF frente al MeCN, debido a
que la mayor viscosidad de la DMF ralentizó el decaimiento vibracional. En los
disolventes de polaridad intermedia (THF, CHCl3 y DCM) se observó un
comportamiento similar al entorno polar aprótico, con la particularidad de que
los rendimientos cuánticos de fluorescencia para PF, DA y PA fueron iguales o
mayores. En general, PA presentó los valores de rendimiento cuántico mayores con
respecto a los otros análogos heterocíclicos del Prodan sintetizados en este
trabajo.
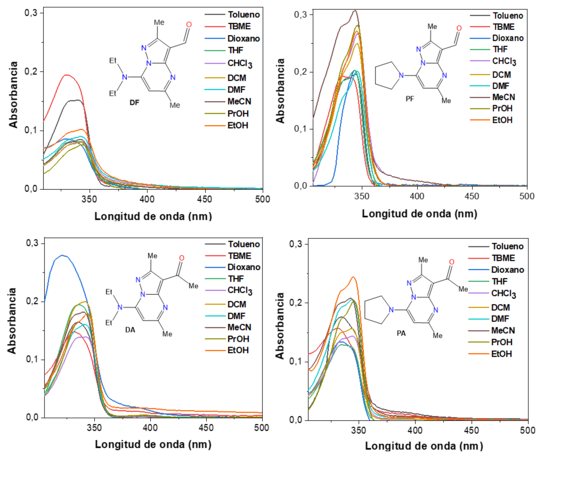
Espectros de absorción de los compuestos DF, PF, DA y PA medidos en diferentes disolventes a una concentración de 10 µM en 20 °C.
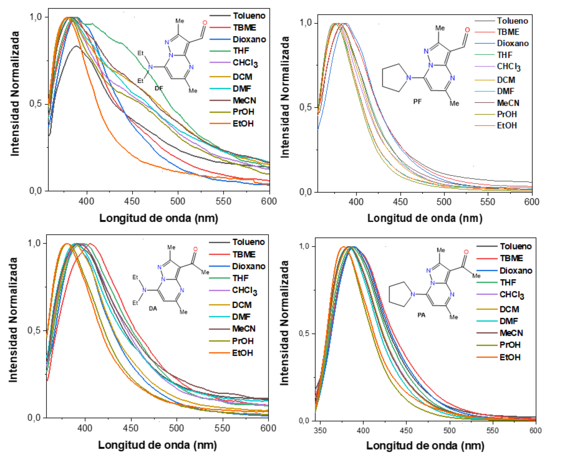
Espectros de emisión de las pirazolo[1,5- a]pirimidinas (DF, PF, DA y PA) a una concentración 10 µM en diferentes disolventes a 20 °C.
Conclusões
La ruta sintética estudiada permitió obtener los productos deseados DF, PF, DA y
PA como análogos estructurales del Prodan, con buenos a excelentes rendimientos y
mediante reacciones versátiles. En todos los casos, los rendimientos globales
fueron mayores que para el Prodan. De acuerdo con el estudio de sus propiedades
fotofísicas, los compuestos PF, DA y PA presentaron mejores valores de coeficiente
de absortividad molar respecto a los obtenidos para el Prodan, encontrando que,
para esta propiedad, la rigidez del sustituyente rico en electrones tiene un
efecto importante. Como consecuencia de un pequeño cambio entre el momento dipolar
en el estado excitado y el estado fundamental, los valores de corrimiento de
Stokes son más pequeños que para el Prodan en los mimos disolventes. Además,
presentaron un comportamiento solvatofluorocrómico negativo opuesto a lo que
ocurre con el Prodan, como consecuencia de que estos compuestos tienen un momento
dipolar mayor en el estado basal que en el estado excitado. Finalmente, las
interacciones soluto-disolvente son un factor importante si se quiere mejorar el
rendimiento cuántico de las sondas moleculares.
Agradecimentos
Queremos agradecer al Departamento de Química y a la Vicerrectoría de
Investigaciones de la Universidad de Los Andes por el apoyo financiero. Además
reconocemos el apoyo de la facultad de ciencias de la misma Universidad.
Referências
ARANZAZU, Sandra-l e colab. BF3‑Mediated Acetylation of Pyrazolo[1,5‑a]pyrimidines and Other π‑Excedent (N‑Hetero)arenes. The Journal of Organic Chemistry, v. 87, n. 15, p. 9839–9850, 2022.
BOSCH, Paula e colab. Fluorescent probes for sensing processes in polymers. Chemistry - A European Journal, v. 11, n. 15, p. 4314–4325, 2005.
CATALAN, Javier. Toward a Generalized Treatment of the Solvent Effect Based on Four Empirical Scales : Dipolarity ( SdP , a New Scale ), Polarizability ( SP ), Acidity ( SA ), and Basicity ( SB ) of the medium. Journal of Physical Chemistry B, v. 113, p. 5951–5960, 2009.
EVERETT, Renata K e NGUYEN, H A Ashley e ABELT, Christopher J. Does PRODAN Possess an O-TICT Excited State ? Synthesis and Properties of Two Constrained Derivatives. Journal of Physical Chemistry A, v. 114, n. 14, p. 4946–4950, 2010.
GODUGU, Kumar e colab. Solid state thiazole-based fluorophores : Promising materials for white organic light emitting devices. Dyes and Pigments, v. 187, n. July 2020, p. 109077, 2021.
GONZÁLEZ-VERA, Juan A. e colab. Unusual spectroscopic and photophysical properties of solvatochromic BODIPY analogues of Prodan. Dyes and Pigments, v. 182, n. February, p. 108510, 2020.
KIM, Soon Young e colab. Fluorescent probe for detection of fluoride in water and bioimaging in A549 human lung carcinoma cells. Chemical Communications, n. 31, p. 4735–4737, 2009.
KUCHERAK, Oleksandr A e colab. Fluorene Analogues of Prodan with Superior Fluorescence Brightness and Solvatochromism. Journal of Physical Chemistry Letters, v. 1, n. 3, p. 616–620, 2010.
PARISIO, Giulia e colab. Polarity-sensitive fluorescent probes in lipid bilayers: Bridging spectroscopic behavior and microenvironment properties. Journal of Physical Chemistry B, v. 115, n. 33, p. 9980–9989, 2011.
TAYLOR, Publisher e colab. ALTERNATE SYNTHESES OF PRODAN AND ACRYLODAN. Organic Preparations and Procedures International : The New Journal for Organic Synthesis, v. 37, n. 6, p. 37–41, 2014.
TIGREROS, Alexis e MACÍAS, Mario e PORTILLA, Jaime. Photophysical and crystallographic study of three integrated pyrazolo[1,5-a]pyrimidine–triphenylamine systems. Dyes and Pigments, v. 184, n. June 2020, 2021.
WÜRTH, Christian e colab. Relative and absolute determination of fluorescence quantum yields of transparent samples. Nature protocols, v. 8, n. 8, p. 1535–1550, 2013.
ZHANG, Jianjian e colab. Naked-Eye and Near-Infrared Fluorescence Probe for Hydrazine and Its Applications in In Vitro and in Vivo Bioimaging. Analytical Chemistry, v. 87, n. 17, p. 9101–9107, 2015.
















