Autores
Liborio Barreiros, M. (UFS) ; Aparecida dos Santos, T. (UFS) ; Alves Costa, C.R. (UFS) ; Bacelar S Barreiros, A.L. (UFS)
Resumo
Este trabalho tem como objetivo realizar a síntese de neoflavonóides e avaliar sua
atividade antioxidante. As substâncias foram sintetizadas através da metodologia
descrita por TALAPRA e purificados através de métodos cromatográficos. As
substâncias foram identificadas através da análise dos dados espectrométricos de
RMN de 1H e 13C e CG-EM. Foram sintetizados 3 neoflavonóides: a neoflavanona 1, 7-
hidróxi-neoflavanona 2 e a 7,8-di-hidróxi-neoflavanona 3.
Palavras chaves
Síntese; Flavonóides; Atividade Antioxidante
Introdução
Os flavonóides são uma das classes de metabólitos secundários mais abundantes no
reino vegetal. Eles são encontrados em frutas, flores, vegetais em geral e em
alguns alimentos como vinho, chá e chocolate. E podem ser encontrados com uma
grande diversidade de estruturas na forma livre (aglicoma) ou conjugado com
açúcares (heterosídeos). Os flavonóides são de grande interesse para a indústria
farmacêutica por seus potenciais na prevenção de câncer e de doenças
cardiovasculares devido às suas propriedades antioxidantes. Com a finalidade na
busca de flavonóides bioativos foram selecionados para realizar a síntese, os
neoflavonóides.
Aos neoflavonóides são relatadas diversas atividades biológicas, como atividade
antioxidante e antitumoral (ZHANG et al, 2014, Sun et al, 2011), citotóxica
(REYES-CHILPA et al, 2004), antiplasmódica (PIERSON et al, 2010),
anticancerígena (BILLARD et al, 2008), hipoglicêmica (GUERRERO-ANALCOET al,
2007), inibição da enzima acetil Colinesterase (AWANG et al, 2010),
antimicrobial (SUN et al, 2011) e anti-Alzheimer (YUN, 2020).
Devido aos poucos estudos sobre a atividade farmacológica dos neoflavonóides
este trabalho tem como objetivo sintetizar, caracterizar e submeter essas
substâncias a testes biológicos.
Material e métodos
A metodologia utilizada para a síntese dos neoflavonóides foi a descrita por
TALAPATRA et al, (1986), por ser efetuada em uma única etapa. Essa síntese baseia-
se na condensação-ciclização de diferentes fenóis com ácido cinâmico na presença
de ácido polifosfórico (PPA). Essas substâncias foram purificadas por meios
cromatográficos e caracterizadas através da análise dos dados espectrométricos de
RMN de 1H e 13C e CG-EM. O teste atividade Antioxidante foi realizado em parceria
com o Laboratório de Síntese e Aplicação de Materiais do DQI/UFS.
Resultado e discussão
Foram sintetizados 3 neoflavonóides, a neoflavanona (77,7 % de rendimento) 7-
hidróxi-neoflavanona (24,46 % de rendimento) e a 7,8-di-hidróxi-neoflavanona
(59,43 % de rendimento).
O teste de Atividade antioxidante, por enquanto, foi realizado apenas para a 7-
hidróxi-neoflavanona. A atividade Antioxidante foi avaliada pelo método de
voltametria cíclica e voltametria de pulso diferencial. Essa substância
apresentou potencial de oxidação de 0,672 V em VPD e 0,72 V em VC,
respectivamente. Esses dados são preliminares, posteriormente iremos estudar a
influência da velocidade de variação de potencial (ʋ), influência do pH para que
seja possível fazer uma análise melhor do resultado obtido. A substância 7,8-
di-hidróxi-neoflavanona será enviada para teste de avaliação antioxidante
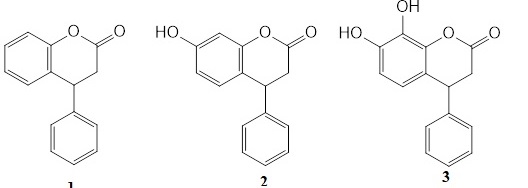
Neoflavonóides sintetizados
Conclusões
Todas as sínteses propostas foram concretizadas e apresentaram um bom rendimento,
entretanto, a 7-hidróxi-neoflavanona foi a que presentou o rendimento mais baixo
do que o esperado. A síntese para essa substância será repetida para otimizar as
condições da reação e tentar melhorar o rendimento. A substância 7-hidróxi-
neoflavanona não apresentou uma boa atividade antioxidante pelo método analisado,
mas isso já era esperado pois só possui uma hidroxila fenólica e essa hidroxila
está conjugada apenas com o anel A.
Agradecimentos
A UFS pelo apoio financeiro e ao CBA (Centro de Biotecnologia da Amazônia) pela
realização dos espectros.
Referências
AWANG, K.; CHAN, G.; LITAUDON, M.; ISMAIL, N. H.; MARTIN, MARIE-THÉRESE. Biooganic & Medicinal Chemistry, v. 18, 7873-7877, 2010.
BILLARD, C.; MENASRIA, F.; QUINEY, C.; FAUSSAT, ANNE-MARIE.; FINET, JEAN-PIERRE.; COMBES, S.; KOLB, JEAN-PIERRE. Experimental Hematology, v. 36, 1625-1633, 2008.
GUERRERO-ANALCO, J.; MEDINA-CAMPOS, O.; BRINDIS, F.; BYE, R.; PEDRAZA-CHAVERRI, J.; NAVARRETE, A.;MATA, R. Phytochemistry, v. 68, 2087-2095, 2007.
PIERSON, JEAN-THOMAS.; DUMÈTRE, A.; HUTTER, S.; DELMAS, F.; LAGET, M.; FINET, JEAN-PIERRE.; AZAS, N.;COMBES, S. European Journal of Medicinal Chemistry, v. 45, 864-869, 2010.
REYES-CHILPA, R.; ESTRADA-MUÑEZ, E.; APAN, T. R.; AMEKRAZ, B.; AUMELAS, A.; JANKOWSKI, C. K.; VÁZQUEZ-TORRES, M. Life Science, v. 75, 1635-1647, 2004.
SUN, J.; DING, W. X.; ZHANG, K. Y.; ZOU, Y. Chinese Chemical Letters, v. 22, 667-670, 2011.
TALAPATRA, B.; DEB, T.; TALAPRATA, S. Indian Journal of Chemistry, v. 25B, 1122-1125, 1986.
YUN, Y.; Y. J.; MIAO, Y.; WANG, X.; SUN, J. Bioorganic & Medicinal Chemistry Letters, v. 30, no 4, 126900, 2020.
ZHANG, K.; DING, W.; SUN, J.; Zhang, B.; LU, F.; LAI, R.; ZOU, Y.; YEDID, G. Biochimie, v. 107, part B, 203-210, 2014.
















