Autores
Santos, D.G. (UFF) ; Freitas, R.H.C.N. (UFF) ; da Rocha, D.R. (UFF) ; da Silva, F.C. (UFF)
Resumo
Neste trabalho foram sintetizados 12 ésteres contendo o núcleo 1H-1,2,3-triazol
via reação click de cicloadição 1,3-dipolar, oxidação total e esterificação de
Fischer. Os produtos foram obtidos com rendimentos moderados a bons e foram
caracterizados por espectroscopia de infravermelho, ressonância magnética de
hidrogênio e carbono. Todas as substâncias preparadas nesse trabalho serão
enviadas para grupos de pesquisa na área de farmacologia e serão avaliadas quanto
ao seu potencial antichagásico.
Palavras chaves
1,2,3-triazol; Reação Click; Esterificação de Fischer
Introdução
Os heterociclos de cinco membros estão muito presentes na natureza e no aporte
terapêutico disponível para tratar diversas doenças (EICHER; HAUPTMANN;
SPEICHER, 2003). Dentre eles, os ciclos contendo nitrogênio são os mais
abundantes, desempenhando papéis importantes em vários processos bioquímicos
(FERREIRA et al, 2013).
Os 1,2,4 e 1,2,3-triazóis são isômeros de uma classe única de heterociclos
nitrogenados que já demonstraram importantes atividades biológicas, incluindo
anti-HIV, anti-inflamatória, antimicrobiana e antifúngica (DA SILVA et al, 2009;
SHAFI et al, 2012; SUMANGALA, 2010; LIMA-NETO et al, 2012).
O 1,2,3-triazol não é um produto natural e tem sido associado a importantes
atividades biológicas e, por esse motivo, ele aparece como o componente
principal do grupo dos triazóis sintéticos (MURUMKAR; CHIKHALE, 2018).
Além disso, o interesse nesse núcleo aumentou após a publicação de uma
metodologia sintética que ocorre sob condições brandas, com ou sem solventes, e
que leva a altos rendimentos. Essa metodologia consiste em uma cicloadição 1,3
dipolar envolvendo um alcino e uma azida como reagentes, gerando seletivamente
os 1,2,3-triazóis (KOLB; SHARPLESS, 2003).
O fato dos triazóis apresentarem diversas funções biológicas têm ocasionado o
amplo estudo dessas substâncias e, nesse cenário, o objetivo desse trabalho é a
síntese de novas substâncias contendo anéis 1,2,3-triazólicos funcionalizados na
posição 4, com potencial atividade anti-chagásica baseados em protótipos
bioativos sintetizados anteriormente pelo grupo.
Material e métodos
Os produtos foram obtidos por meio de uma síntese linear em 4 etapas, conforme
ilustrado pela Figura 1.
A obtenção das substâncias planejadas teve seu início a partir da reação de
diazotação de anilinas funcionalizadas (1) usando nitrito de sódio e azida de
sódio em meio ácido, levando às azidas correspondentes (2) (BARRAL; MOORHOUSE,
MOSES, 2007), que foram purificadas por coluna cromatográfica em sílica
utilizando Hexano como eluente, com rendimento de 85-92%.
Em seguida, as azidas e o álcool propargílico reagem em uma cicloadição azida-
alcino catalisada por cobre (CuAAC) para gerar exclusivamente o isômero 1,4-
dissubstituído do anel 1,2,3-triazol com o álcool primário (3) em tert-butanol e
água a 80 ºC (KOLB; SHARPLESS, 2003) e purificados por recristalização, levando
a 80-98% de rendimento.
Posteriormente, de posse dos intermediários álcoois, é realizada uma oxidação
total de 3 utilizando permanganato de potássio em tert-butanol e solução de NaOH
0,1M, levando ao ácido carboxílico correspondente (4) (TOJO; FERNÁNDEZ, 2007),
foi utilizada uma extração ácido-base como método de purificação das
substâncias, gerando rendimentos de 60-90%.
Como etapa final, reações entre os ácidos carboxílicos sintetizados e álcoois
comerciais (5) são realizadas para gerar ésteres triazólicos por meio de
esterificação de Fischer sob irradiação de micro-ondas a 150 ºC utilizando ácido
sulfúrico como catalisador e purificados por coluna cromatográfica utilizando
hexano e acetato de sódio (30%) como eluentes, levando aos ésteres (6a-d, 7a-d e
8a-d) em 50-79% de rendimento (LIDSTRÖM et al, 2001).
Resultado e discussão
Os rendimentos obtidos na síntese de todos os produtos preparados, no âmbito
deste projeto, estão apresentados no Quadro 1. Os produtos foram obtidos com
rendimentos moderados a bons, variando de 50 a 79%.
A metodologia utilizada demostrou ser reprodutível, onde os melhores rendimentos
foram obtidos para as substâncias derivadas de álcoois comerciais com cadeias
carbônicas menores, o que pode ser explicado pela existência de menor
impedimento estérico.
As substâncias foram analisadas e caracterizadas através de espectroscopia na
região do infravermelho (IV), Ressonância Magnética Nuclear de Hidrogênio (RMN
1H) e Ressonância Magnética Nuclear de Carbono (RMN 13C).
A título de exemplificação, na substância 8a se observou: no espectro de IV a
banda de deformação axial em 1715 cm-1 referente a carbonila do éster. No
espectro de RMN 1H foi observado o sinal em 8,08 ppm na forma de simpleto com
integral 1, característico do hidrogênio de anel triazólico. A formação do éster
foi confirmada através do sinal em 3,81 ppm na forma de simpleto com integral 3,
referente aos hidrogênios da metila do éster.

Esquema de síntese dos ésteres contendo o núcleo 1H- 1,2,3-triazol
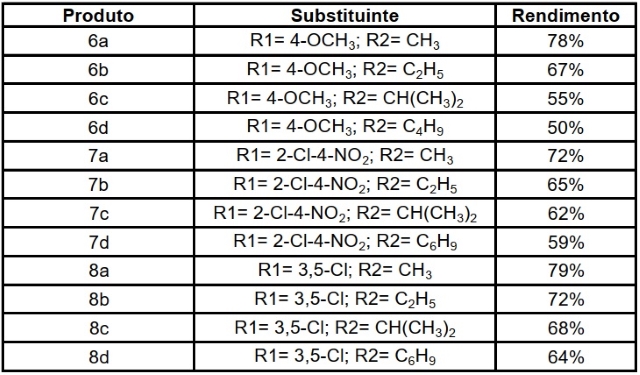
Substituintes e rendimentos dos produtos obtidos.
Conclusões
Neste trabalho, através de uma metodologia viável e reprodutível, foram
sintetizados 12 ésteres contendo o núcleo 1,2,3-triazol via reações de cicloadição
1,3-dipolar e esterificação de Fischer. As substâncias foram obtidas em
rendimentos moderados a bons e serão enviadas para avaliação de sua atividade
anti-chagas frente as formas epimastigota e tripomastigota do Trypanossoma cruzi.
Agradecimentos
Ao Programa de Pós Graduação em Química da UFF, FAPERJ, CAPES e CNPq.
Referências
BARRAL, K.; MOORHOUSE, A. D.; MOSES, J. E. Efficient Conversion of Aromatic Amines into Azides: A One-Pot Synthesis of Triazole Linkages. Organic Letters. v. 9, n. 9, p. 1809-1811, 2007.
DA SILVA, F.C.; DE SOUZA, M.C.B.V.; FRUGULHETTI, I.C.P.P.; CASTRO, H.C.; SOUZA, S.L.O.; SOUZA, T.M.L.; RODRIGUES, D.Q.; SOUZA, A.M.T.; ABREU, P.A.; PASSAMANI, F.; RODRIGUES, C.R.; FERREIRA, V.F. Synthesis, HIV-RT inhibitory activity and SAR of 1-benzyl-1H-1,2,3-triazole derivatives of carbohydrates. European Journal of Medicinal Chemistry. v. 44, n. 1, p. 373-383, 2009.
EICHER, T.; HAUPTMANN, S.; SPEICHER, A. The Chemistry of Heterocycles: Structure, Reactions Synthesis and Applications. 2nd Edition, Wiley-VCH, Weinheim. 2003.
FERREIRA, V.F.; DA ROCHA, D.R.; DA SILVA, F.C.; FERREIRA, P.G.; BOECHAT, N.A.; MAGALHÃES, J.L. Novel 1H-1,2,3-, 2H-1,2,3-, 1H-1,2,4- and 4H-1,2,4-triazole derivatives: a patent review (2008 – 2011). Expert Opinion on Therapeutic Patents. v. 23, n. 3, p. 319-331, 2013.
KOLB, H. C.; SHARPLESS, K. B. The growing impact of click chemistry on drug discovery. Drug Discovery Today. v. 8, n. 24, p. 1128-1137, 2003.
LIDSTRÖM, P.; TIERNEY, J.; WATHEY, B.; WESTMAN, J. Microwaved assisted organic synthesis – a review. Tetrahedron. v. 57, n. 45, p. 9225-9283, 2001.
LIMA-NETO, R.G.; CAVALCANTE, N.N.M.; SRIVASTAVA, R.M.; JUNIOR, F.J.B.M.; WANDERLEY, A.G.; NEVES, R.P.; ANJOS, J.V. Synthesis of 1,2,3-triazole derivatives and in vitro antifungal evaluation on Candida Strains. Molecules. v. 17, n. 5, p. 5882-5892, 2012.
MURUMKAR, P.R.; CHIKHALE, R.V. Vicinal Diaryl Triazoles and Tetrazoles in Vicinal Diaryl Substituted Heterocycles. 1st Ed. Elsevier. p. 191-219, 2018.
SHAFI, S.; ALAM, M.M.; MULAKAYALA, N.; MULAKAYALA, C.; VANAJA, G.; KALLE, A.M.; PALLU, R.; ALAM, M.S. Synthesis of novel 2-mercapto benzothiazole and 1,2,3-triazole based bis-heterocycles: their anti-inflammatory and anti-nociceptive activities. European Journal of Medicinal Chemistry. v. 49, p. 324-33, 2012.
SUMANGALA, V.; POOJARY, B.; CHIDANANDA, N.; FERNANDES, J.; KUMARI, N.S. Synthesis and antimicrobial activity of 1,2,3-triazoles containing quinoline moiety. Archives of Pharmacal Research. v. 33, n. 12, p. 1911-1918, 2010.
TOJO, G.; FERNÁNDEZ, M. Oxidation of Primary Alcohols to Carboxylic Acids: A Guide to Current Common Practice (Basic Reactions in Organic Synthesis). 1st Ed. Springer, 2007.
















