Análise da conversão eletroquímica de dióxido de carbono em hidrocarbonetos por infravermelho.
- Home
- Trabalhos
ÁREA
Química Computacional
Autores
Prioli, A.A. (INSTITUTO MAUÁ DE TECNOLOGIA) ; Silva, A.T. (INSTITUTO MAUÁ DE TECNOLOGIA) ; Palma, I. (INSTITUTO MAUÁ DE TECNOLOGIA) ; Zanone, A. (INSTITUTO MAUÁ DE TECNOLOGIA)
RESUMO
Este trabalho busca uma alternativa à captura e armazenamento geológico de CO2 para conter a sua emissão. O estudo baseou-se na conversão eletroquímica do CO2 em produtos de valor agregado. Utilizou-se como solvente monoetanolamina (MEA) 30 % em massa para melhorar a captura do CO2 e avaliou soluções de metanol e água. Para a redução eletroquímica foram testados eletrodos de cobre, aço-inox e titânio. Com base na análise dos espectros infravermelhos, o titânio não contribui para a eletrólise e o aço-inox foi o que melhor se ajustou à eletrolise, pois teve conversão similar ao cobre e apresentou menos problemas de corrosão. Também foi observado a possível formação de bicarbonato e eletrólise do solvente nos eletrodos de cobre e aço-inox.
Palavras Chaves
Dióxido de Carbono; Redução Eletroquímica; Infravermelho
Introdução
Sabe-se que os gases de efeito estufa (GEE) são um problema iminente para a atmosfera, contê-los e viabilizar uma alternativa à emissão desses gases é de grande importância para a sociedade. Os GEE mais comuns são dióxido de carbono (CO2) e metano (CH4), apesar do CO2 não ser o mais prejudicial, é o mais emitido contabilizando 76 % das emissões mundiais, segundo dados da Convenção-Quadro das Nações Unidas sobre a Mudança do Clima (UNFCCC). Enquanto o metano, considerado mais prejudicial, representa 16 % e o óxido nitroso 6 % dos GEE liberados na atmosfera. No Brasil, de acordo com o Sistema de Estimativas de Emissões e Remoções de Gases de Efeito Estufa (SEEG), o CO2 representa 64 % das emissões, o CH4 26 % e o NO 9 % de um total de 2176 Mton CO2 equivalente. Esse aumento dos GEE é responsável por dois terços do desequilíbrio energético total, elevando a temperatura média da Terra (LINDSEY, 2020). A fim de reduzir a emissão de CO2, indústrias começaram a capturar e armazenar esse gás proveniente de seus processos. Em 2020, cerca de 40 milhões de toneladas de CO2 foram capturadas, podendo chegar a 140 milhões de toneladas se as 30 instalações de captura de carbono planejadas em todo o mundo entrassem em operação, mesmo que minúsculo em comparação com as emissões globais anuais atuais de cerca de 35 bilhões de toneladas (SERVICE, 2021). A remoção do CO2 dos gases industriais pode ser feita por absorção utilizando aminas, sendo este método o mais eficiente para correntes gasosas diluídas, comercialmente viável e ocorrendo em condições de temperatura e pressão atmosférica. Ela é amplamente utilizada em indústrias de petróleo e de gás natural (KHOL e NIELSEN, 1997; RAO, 2002). Uma alternativa para o armazenamento desse gás é o sequestro geológico de carbono, o qual consiste no armazenamento do carbono em formações geológicas. No entanto, esta tecnologia consome muita energia e é cara, além de possuir risco de vazamentos (ZHU, LIU e QIAO, 2016). A conversão do CO2 capturado em outros compostos que possuam valor agregado se torna uma possibilidade, para isso iniciou-se o estudo da conversão de CO2 pela sua redução em um processo eletrolítico. A redução eletroquímica heterogênea do CO2 tem atraído atenção e sido bastante estudada nos últimos anos por apresentar uma síntese mais fácil, ter alta eficiência, ser menos prejudicial ao meio ambiente e ter maior potencial para aplicação em larga escala. Nesse caso a reação ocorre na interface eletrodo- eletrólito. Os processos catalíticos heterogêneos podem ser divididos em três etapas principais: (1) absorção química de CO2 na superfície do cátodo; (2) transferência de elétrons e/ou migração de prótons para romper as ligações C—O e gerar ligações C—H e (3) reorganização das espécies dos produtos seguido da dessorção da superfície do eletrodo e difusão no eletrólito (SUN et al., 2017). Como um dos grandes problemas da conversão eletroquímica de CO2 se dá pela dificuldade de solubilização do CO2 no solvente (SUN et al., 2017), utilizou-se a monoetanolamina (MEA) como solvente. Soluções aquosas 30 % em massa dessa amina é considerado o benchmark da absorção química, além de formar uma solução de eletrólitos como produto da reação de absorção. Chen et al. (2017) verificou que é possível reduzir MEA carbonatada em solução aquosa a bicarbonato. Portanto, no presente trabalho realizou-se o modelo de calibração dos espectros para a identificação do consumo de CO2 em fase líquida em solvente de monoetanolamina aquosa e alcóolico. Além de verificar possíveis reações ocorridas a partir da conversão eletroquímica deste e o comportamento dos diferentes eletrodos utilizados, cobre, titânio e aço inox.
Material e métodos
Foram preparadas soluções a fim de padronizar e construir curvas de calibração em Espectroscopia no infravermelho com transformada de Fourier (FTIR) e quantificação das amostras. Para isso, foram feitas diferentes soluções variando a concentração de monoetanolamina (MEA) em (1) Metanol, (2) água e (3) mistura metanol e água. Nas duas primeiras, em um vial de 2 ml foram preparadas, em uma balança de analítica Shimadzu modelo AY220 (Shimadzu do Brasil Comércio LTDA, São Paulo), as soluções com concentrações de MEA variando 0% a 40% em massa, em um intervalo de 5%. Já na última, as concentrações de cada componente alternaram-se entre 30%/30% e 40%/40% e 40%/20%. Para o processo de carbonatação das amostras, foram preparadas duas soluções com 30% de MEA diluído em metanol e outras duas com 30% de MEA diluído em água e com um cilindro de dióxido de carbono (Air Liquide Brasil LTDA, São Paulo) conectado a uma pedra porosa redonda, então, borbulhou-se o CO2 nas amostras simultaneamente por aproximadamente 30 minutos. Tempo suficiente para atingir o equilíbrio químico, verificado pelo fim do calor de reação. Foram retiradas amostras para titulação e análise de FTIR. Para a eletrólise foi utilizada uma célula tipo H com uma membrana de troca de íons Nafion 212 Perfluorinated membrane e eletrodos de cobre, aço-inox e titânio. O cátodo ficou submerso na solução de MEA e metanol, assim como o ânodo na amostra de MEA e água, utilizando uma diferença de potencial de 30V. Assim como foi feito nas amostras carbonatadas, foram retiradas amostras para titulação e análise de FTIR. Foi utilizado um algoritmo Python usando o módulo Scikit-Learn com o método PLS (parcial least squares), como um modelo padrão para explorar as amostras da fase líquida e identificar os principais picos e regiões representativo das espécies químicas presentes. Para assim ser possível analisar se realmente houve a conversão do CO2 capturado.
Resultado e discussão
Com a análise de FTIR foram obtidos os espectros das soluções de MEA e 30 % em
massa de MEA diluído em (1) Metanol e (2) água para fim de comparação dos
espectros das amostras 1 e 2 carbonatadas e eletrolisadas (a;b)(figuras 1 e 2).
De acordo com Richner, a banda típica de bicarbonato é fortemente sobreposta
por um estiramento carbamato em 1322 cm-1. Nas amostras carbonatadas
(a;b)(figuras 1 e 2) foi possível perceber o aumento dos picos entre 1300
cm-1 e 1600 cm-1, essa alteração é indicação da presença
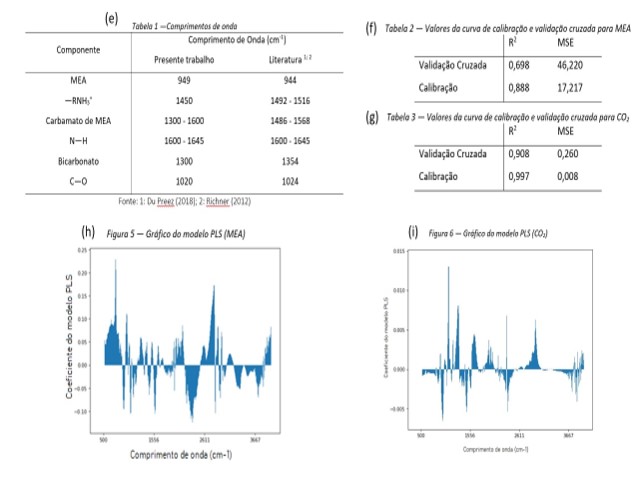
do carbamato de MEA. Os comprimentos de onda podem ser observados na Tabela 1
(e).
Na primeira eletrólise, feita na solução de MEA em metanol utilizando um
eletrodo de aço inox (a)(Figura 1), foi possível constatar que o pico de MEA,
encontrado no comprimento de onda 949 cm-1, manteve-se com a mesma
absorbância apenas mais deslocado, se comparado a amostra carbonatada. Além
disso há uma pequena diminuição do pico —RNH3+ (1450
cm-1) depois da eletrólise, indicativo da regeneração da amina, seja
pelo consumo do CO2 absorvido ou dessorção do mesmo. Houve uma
grande diminuição do pico de C—O, indicando a possibilidade de consumo de
metanol durante a eletrólise.
Já na eletrólise da solução de MEA em água com o eletrodo de cobre (b)(Figura
2) percebe-se que o pico de C—O (1020 cm-1), se comparado à amostra
carbonatada, aumenta após a eletrólise indicando a possível ocorrência de
alguma reação, como a solução ficou com tonalidade azulada além da degradação
visual do eletrodo, acredita-se que houve a formação de hidróxido de cobre na
solução. Houve também um tênue aumento na banda de 1300 cm-1 onde há
potencial formação de bicarbonato.
A segunda eletrólise foi feita utilizando o eletrodo de aço inox no cátodo e no
ânodo (c;d)(figuras 3 e 4). Na solução de MEA em metanol não houve grandes
alterações se comparado à eletrolise 1 (a)(figura 1). Já na solução de MEA em
água (d)(figura 4) é possível observar que a banda referente ao C—O, tem uma
absorbância menor com relação à eletrólise 1 com eletrodo de cobre (b)(figura
2).
Ao utilizar o eletrodo de titânio observou-se que as mudanças da amostra
carbonata para eletrolise são mínimas, mesmo utilizando uma diferença de
potencial muito maior que a necessária (30 V).
Para a criação do modelo PLS, foram utilizados os espectros das amostras
carbonatadas e não carbonatadas para o MEA e o CO2 e suas
concentrações em cada solução. A concentração do dióxido de carbono foi obtida
através de titulação potenciométrica com ácido clorídrico 0,5M.
Na (f;g) tabela 2 e 3 é possível observar os valores de R2 e do erro
médio quadrático (MSE) da curva de calibração e de validação cruzada (h)
(Figura 5).
Como o R2 tem que ser o mais próximo de 1 e o MSE de 0 não houve uma
calibração adequada para o modelo de MEA, sendo necessários ajustes para que
ele possa ser utilizado para a predição da concentração em fase líquida. Para o
intuito do estudo, foi possível utilizar esses valores para explorar o processo
e as regiões de maior importância para a identificação das espécies químicas em
fase líquida. Já o modelo de CO2 está bem ajustado podendo ser
utilizado também para quantificação das amostras.
O número de fatores foi escolhido com base no mínimo MSE e máximo
R2, no caso da MEA foram utilizados 8 fatores e, para o dióxido de
carbono 10.
No modelo PLS é gerado um gráfico dos coeficientes pelo comprimento de onda
(h;i) (Figuras 5 e 6), através deste é possível obter a concentração, sua
contribuição e a representatividade de cada pico do MEA e CO2, onde
a concentração é diretamente proporcional ao tamanho do pico do comprimento de
onda.

Conclusões
A partir dos espectros analisados conclui-se que há possíveis reações ocorrendo na eletrólise do CO2 na presença de eletrodos de cobre e aço inox, como a provável formação de bicarbonato além da possível eletrólise do solvente. Portanto, percebe-se que em geral as amostras com eletrodo de cobre e aço-inox obtiveram comportamentos semelhantes, contudo, o aço-inox apesar de possuir um menor problema de corrosão comparado ao cobre, confere um comportamento mais brando em relação aos picos observados. Já, pelas amostras utilizando o eletrodo de titânio, conclui-se que não há transformação aparente na fase líquida, indicando que mesmo em situações mais extremas não é possível realizar reação eletroquímica. O modelo PLS gerado para MEA, apesar de não estar bem ajustado, pode ser utilizado de forma qualitativa, auxiliando na identificação dos comprimentos de ondas absorvidos por essas moléculas. Isso pode ser constatado pela comparação dos dados da Tabela 1 com a Figura 9, onde o maior pico do modelo de MEA é o mesmo encontrado na literatura (944 cm-1). Já o modelo PLS de CO2, por ter sido bem ajustado pode ser utilizado para fins quantitativos e qualitativos, validando a análise inicial dos picos identificados como carbamato de MEA.
Agradecimentos
Agradecimentos ao Instituto Mauá de Tecnologia pela infraestrutura disponibilizada para execução dos experimentos.
Referências
CHEN, L.; FENGWANG, L.; ZHANG, Y.; BENTLEY, C. L.; HORNE, M.; BOND, A. M.; ZHANG, J. Electrochemical Reduction of Carbon Dioxide in a Monoethanolamine Capture Medium. ChemSusChem, v. 10, p. 4109-4118, 2017.
DU PREEZ, J.; CALLANAN, L. ; KNOETZE, H. An in situ Fourier transform infrared spectroscopy method for collecting realtime data for the liquid-phase reaction of CO2 and mono-ethanolamine in alcoholic solvent systems. Elsevier, Stellenbosch, Africa do Sul, p. 25–33, Agosto 2018.
IPCC. Special Report on Carbon Dioxide Capture and Storage. In: Preparado pelo Grupo de trabalho 3 do Painel Intergovernamental de Mudanças Climáticas (Metz, B., Davidson, O., Coninck, H., Loos, M., Meyer, L.). Cambridge, UK: [s.n.]. 2007.
IUPAC. Materials for CO2 Capture. IUPAC.org, 2019. Disponível em: https://iupac.org/materialschemistryedu/environmental/materials-for-co2-capture/. Acesso em: 28 abril 2021.
Khol, A. L.; Nielsen, R. B. Gas purification. Gulf Publishing Company, Texas, 5 edição, p. 1414, 1997
KUHL, K. P.; CAVE, E. R.; ABRAM, D. N.; JARAMILLO, T. F. New insights into the electrochemical reduction of carbon dioxide on metallic copper surfaces. Energy & Environmental Science, Maio 2012.
LINDSEY, R. Climate Change: Atmospheric Carbon Dioxide. Climate.gov, 2020. Disponível em: https://www.climate.gov/news-features/understanding-climate/climate-change-atmospheric-carbon-dixide. Acesso em: Abril 2021.
Rao, A. B.; Rubin, E. S. A technical, economic, and environmental assessment Of Amine-based CO2 capture technology for power plant greenhouse gas control. Environmental Science & Technology, v. 36, no 20, p. 4467-4475, 2002.
RICHNER, G.; PUXTY,. Assessing the Chemical Speciation during CO2 Absorption by Aqueous Amines Using in Situ FTIR. Industrial Engineering Chemistry Research, Newcastle, Australia, v. 51, p. 14317 a 14324, Outubro 2012.
SERVICE, F. New generation of carbon dioxide traps could make carbon capture practical. Science, v. 372, Março 2021. Disponível em: https://www.sciencemag.org/news/2021/03/new-generation-carbon-dioxide-traps-could-make-carbon-capture-practical.
SUN, Z.; MA, TAO; FAN; HAN, B. Fundamentals and Challenges of Electrochemical CO2 Reduction Using Two-Dimensional Materials. Chem. Elsevier Inc., Chicago, n. 3, p. 560-587, Outubro 2017.
ZHU, D. D.; LIU, J. L.; QIAO, S. Z. Recent Advances in Inorganic Heterogeneous Electrocatalysts for Reduction of Carbon Dioxide. Advenced Materials, Weinheim, Alemanha , p. 3423-3452, 2016.


