DISCRIMINAÇÃO DE VINHOS POR VOLTAMETRIA DE PULSO DIFERENCIAL E ESPECTROFOTOMETRIA MOLECULAR
- Home
- Trabalhos
ÁREA
Química Analítica
Autores
Ferreira, G.F. (UNIVERSIDADE ESTADUAL DO OESTE DO PARANA) ; Bessegato, G.G. (UNIVERSIDADE ESTADUAL DO OESTE DO PARANA) ; Lindino, C.A. (UNIVERSIDADE ESTADUAL DO OESTE DO PARANA)
RESUMO
A adulteração de vinhos vai além da substituição de rótulos de marcas de alto valor agregado, afetando vinhos de todas as procedências, com a substituição de constituintes originais por outros componentes e que causam extensos prejuízos econômicos afetando também a saúde do consumidor. Este trabalho utilizou a voltametria de pulso diferencial e a espectrofotometria molecular como variáveis na Análise de Componentes Principais para discriminação de vinhos de diferentes procedências. Os resultados mostraram que é possível diferenciar vinhos de diferentes produtores, inclusive aqueles de procedência duvidosa, e esta metodologia utiliza mínima quantidade de amostra, com mínima geração de resíduos, sendo rápida, portátil e de baixo custo, facilitando a detecção de adulterações.
Palavras Chaves
alimentos; quimiometria; adulteração
Introdução
Vinho é a bebida obtida a partir da fermentação alcoólica de mosto simples de uva sã, fresca e madura. Os vinhos podem ser agrupados em vinhos de mesa, finos e nobres. Há também classificações quanto à cor (tinto, rosado ou rosé e branco) e quanto ao teor de açúcar (seco, meio doce ou meio seco e suave ou doce) (BRASIL, 2018). De acordo com o Instituto Brasileiro de Geografia e Estatística (BRASIL, 2020) o Brasil em 2019 possuía 75.731 hectares de área de uva destinados a colheita, que proporciono a produção de 1.445.705 toneladas de uvas, sendo 48,28% para a elaboração de vinhos, sucos e outros derivados e 51,72% de uvas de mesa. A produção de vinho no Brasil em 2019 atingiu a marca de 182.245.159 litros de vinho, sendo 144.629.737 litros de vinho de mesa e 37.615.422 litros de vinhos finos. No mesmo ano, a quantidade de vinho exportada sofreu redução de 18,23% e o vinho nacional foi vendido ao preço médio de US$ 1,88 o litro, abaixo dos preços praticados em 2018 (US$ 1,94) e em 2017 (US$ 2,47) (MELLO; MACHADO, 2020). A vitivinicultura brasileira se apresenta como importante atividade econômica para as regiões produtoras de uva, em especial no que diz respeito à agricultura familiar e propriedades de médio e pequeno porte. Essa atividade tem contribuído com a sustentabilidade da vitivinicultura na geração de empregos e renda (HOECKEL; FREITAS; FEISTEL, 2017). Segundo Miele et al. (2010), através da tipicidade e de melhorias na qualidade é possível alcançar uma maior competitividade dos vinhos nacionais e evitar a desvalorização da indústria vinícola brasileira frente aos produtos importados. Assim, o Brasil contaria com potencial de promover aumento de produção, do consumo e da rentabilidade por meio do aprimoramento da qualidade do produto final (MELLO, 2017). A qualidade do produto final no que diz respeito ao sabor, aroma, consistência e aparência possui relação direta com os constituintes químicos ali presentes, além de suas interações e quantidades. A preocupação também abrange pontos como a origem dos produtos, a responsabilidade com a segurança alimentar, a preservação ambiental e a certificação da produção (CAMARGO; TONIETTO; HOFFMANN, 2011). Outra preocupação do setor são fraudes ou adulterações que prejudicam os produtores e os consumidores. A fraude alimentar representa um grande problema econômico e de saúde pública para toda a cadeia alimentícia. A fraude pode ser definida como o ato intencional de adulterar alimentos ou documentações associadas objetivando ganho econômico. Pode ter consequências graves para os consumidores, causando doença ou até mesmo morte. Além do prejuízo de imagem e, consequentemente, financeiro, de empresas, produtores e países envolvidos essas situações (GRACE, 2019). As fraudes são favorecidas por diversos fatores, como as diferenças de legislação alimentar entre países, obsolescência do controle, falta de rastreabilidade, facilidade de adulterar alimentos e dificuldades no monitoramento e detecção de fraudes (VAN RUTH; HUISMAN; LUNING, 2017). A questão da adulteração de vinhos é histórica. Os tipos de adulterantes e adulterações têm evoluído com o passar dos anos. Dentre eles, produção de vinhos com uvas secas ou mesmo produtos químicos, etiquetagem falsa, diluição com água, adição de etanol ou açúcar, coloração artificial, uso de conservantes, dentre outros, têm sido relatados ao longo dos anos (STANZIANI, 2009). A descoberta de fraudes em alimentos se apresenta como um desafio constante, dada a variedade de alimentos que podem ser adulterados, alterados ou rotulados incorretamente. Grande parte dos métodos analíticos existentes são classificados como métodos targets, ou seja, que têm como alvo um analito pré-selecionado. Objetivam verificar a existência de marcadores específicos e se suas concentrações se encontram acima dos limites estabelecidos, porém, os fraudadores de alimentos geralmente possuem conhecimento prévio sobre os marcadores, os ensaios e como evitar a detecção ou reduzir a presença dos adulterantes para níveis abaixo do limite de detecção (MCGRATH et al., 2018). Em contra partida as análises conhecidas como non-targets traçam o perfil detalhado (espectros, cromatogramas, fingerprints, etc) de amostras em análise e possibilitam a comparação desse perfil com outros provenientes de bancos de dados. Esses perfis devem ser categorizados como pertencentes a específicas classes e assim realizada a análise discriminante (RODIONOVA; POMERANTSEV, 2020). As estratégias atuais de análises de adulterantes estão mudando de metodologias voltadas à detecção de compostos específicos para metodologias capazes de identificar padrões e simultaneamente um amplo espectro de substâncias, juntamente com testes de reconhecimento de padrões para avaliar marcadores (CETÓ et al., 2020). Este trabalho teve objetivo de estudar metodologias voltamétricas e espectrofotométricas na região do visível como ferramentas em métodos non- target em vinhos utilizando métodos quimiométricos
Material e métodos
Todos os reagentes utilizados foram de alto grau de pureza para análise. A água utilizada para o preparo de soluções do eletrólito ou diluições de amostras foi destilada e purificada pelo sistema Milli-Q Simplicity da Millipore (resistência de 18 MΩ cm-1, a 25 °C). As amostras, no total de treze, foram obtidas de vinícola localizada na Região Oeste do Paraná, do comércio local e algumas amostras foram obtidas de comercio informal. Os vinhos obtidos da vinícola foram o tipo Isabel tinto seco, Bordô tinto seco, tinto suave (uvas Bordô e Isabel); Niágara branco seco, Lorena branco seco e Niágara branco suave. As amostras coletadas no comercio local foram de vinho seco Bordô, Isabel, Malbec e Carbenet Sauvignon. As amostras obtidas de comércio informal foram vinho tinto colonial seco e suave. As amostras de vinho foram diluídas a 10% v/v em eletrólito de KCl 0,1 mol L-1 com volume total de 10 mL em célula eletroquímica utilizando Ag/AgCl, KCl 3 mol L-1 como eletrodo de referência; placa de aço inox com 8 cm² como contra eletrodo, e eletrodo de trabalho de grafite (obtido de pilha AA, limpo com ácido clorídrico concentrado em banho de ultrassom) com área de 4,0 cm². Antes da medida em cada amostra, a solução foi borbulhada com N2 (White Martins, 99,999 %) por cinco minutos. Primeiramente realizou-se a limpeza do eletrodo realizando três ciclos de voltametria cíclica entre −0,5 V a +1,5 V, seguido por voltametria cíclica entre 0,0 a 1,0 V (para checar se há presença de algum pico de contaminante persistente) e por fim o branco da voltametria de pulso diferencial (DPV). Cada amostra foi analisada em triplicata e entre cada replicata a solução foi borbulhada por 10 s com N2 para homogeneização. Os parâmetros da voltametria de pulso diferencial foram: passo de 0,005 V, amplitude de modulação de 0,1 V, tempo de modulação de 0,05 s e intervalo de tempo de 0,5 s, na faixa de potencial de 0,0 a 1,0 V. Utilizou-se o potenciostato Metrohm Autolab Pgstat 101. As soluções das amostras de vinho na diluição de 10% v/v com KCl 0,1 mol L-1 foram também caracterizadas por espectrofotometria na região do UV-visível em espectrofotômetro Shimadzu 1800 PC com o uso de cubetas de quartzo de caminho ótico de 1,0 cm e varredura nos comprimentos de onda de 210 a 1100 nm. Para a análise quimiometrica, selecionou-se quatro valores de potencial eletroquímico a partir dos principais picos voltamétricos obtidos e selecionou-se três comprimentos de onda no espectro UV-visível em 420, 520 e 620 nm. A partir destes calcularam-se a Intensidade de cor (somatória das absorvancias nos três comprimentos de onda); a densidade de cor (somatória das absorvancias em 420 e 520 nm) e tonalidade (razão absorvancias 420/520 nm). Utilizou-se a Análise de componentes Principais (PCA) e Análise de Grupos Hierárquicos (HCA), utilizando neste último o método Ward para formação dos clusters e a distância Euclidiana entre os grupos por meio do software Action for Excel.
Resultado e discussão
A Figura 1 mostra a resposta das medidas de voltametria de pulso diferencial
para alguns dos vinhos branco e tinto estudados. A curva em preto se refere
ao vinho seco de uva Isabel; a curva em vermelho se refere ao vinho seco de
uva Bordô; a curva em azul se refere ao vinho tinto suave; a curva em verde
se refere ao vinho seco branco de uva Niágara; a curva em marrom se refere
ao vinho seco branco de uva Lorena e a curva em roxo se refere ao vinho
branco de uva Niágara suave.
Observa-se na voltametria de pulso diferencial (DPV) a diferença no perfil
eletroquímico (potencial e corrente) dependendo do tipo de vinho estudado.
Os vinhos são alimentos complexos com grande quantidade de substancias que
dependem de diversos fatores como o tipo de uva, localização geográfica,
processo de fermentação etc. No intervalo de potencial estudado, os picos
observados representam sobreposições de diferentes espécies oxidáveis
presentes nos vinho, sendo que na região 0,15 a 0,17 V e em 0,56 a 0,6 V
correspondem a duas partes independentes da molécula de catequina,
respectivamente as configurações orto e meta de grupo OH. Picos observados
nos potenciais entre 0,76 e 0,80 V podem ser atribuídos à espécies menos
reativas à oxidação, que incluem as monohidroxiladas (ALCALDE et al., 2019).
Chiorcea-Paquim et al. (2020) também atribuem os picos em torno de 0,1 V a
hidroquinonas, facilmente oxidáveis, em 0,2 V atribui-se ao catecol, e picos
em 0,6 V ao resorcinol. De qualquer maneira, os picos representam
sobreposições de diferentes espécies oxidáveis presentes nas diferentes
amostras dos vinhos.
Os espectros obtidos para os vinhos diluídos a 10% v/v mostraram que os
vinhos brancos apresentam picos ou bandas de absorção somente na região do
ultravioleta, com destaque para picos em 280 nm, associado aos fenólicos
totais e em 320 nm, associados à substancia hidroxicinamol. Os vinhos tintos
apresentam picos de absorção nos mesmos comprimentos de onda que os vinhos
brancos e também picos de absorção na região do visível, próximos ao
comprimento de onda de 420 nm, referente a pigmentos marrom amarelados e
520, referente à presença de antocianinas. A intensidade de absorção depende
muito dos componentes químicos das uvas dos quais os vinhos se originam, mas
é possível discriminar também entre os tipos de vinhos pelos espectros
obtidos.
Os dados selecionados dos potenciais obtidos na DPV de cada amostra de
vinho, juntamente com os resultados dos cálculos de intensidade, densidade e
tonalidade de cor foram inseridos em matriz para o reconhecimento de
padrões.
A análise de componentes principais permite a discriminação das amostras de
vinhos brancos e de vinhos tintos, como esperado, bem como das amostras de
vinho de melhor e de pior qualidade, sendo que o PC1 explica 76,10% das
variáveis dos dados e o PC2 explica 20,05%. A Figura 2 mostra o dendograma
obtido destes resultados, evidenciando a separação das amostras de vinho
branco (NS, N e L), de vinho de boa qualidade (TS, IS, M, B, I) de baixa
qualidade (BL, AP, BM, CS e CSV), e do grupo formado por amostras de vinho
de procedência duvidosa ou desconhecida (CS e CSV) são de, mostrando que é
possível discriminar grupos de vinhos por meio das técnicas adotadas.
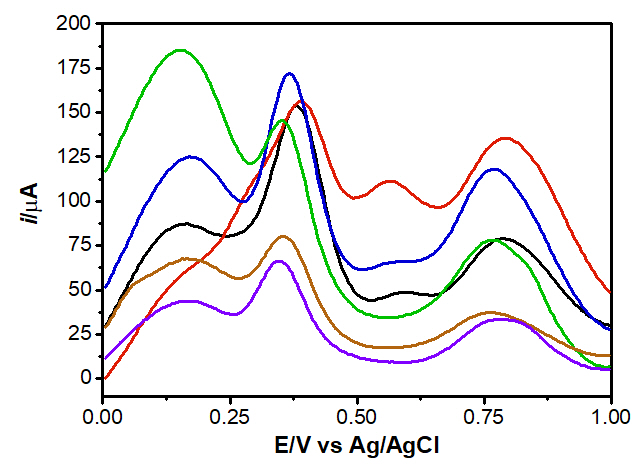
Voltamogramas de pulso diferencial para seis amostras de vinhos (primeira replicata) na concentração de 10% v/v em KCl 0,1 mol L-1. Temp. de 25 °C.

Dendograma amostras vinícola certificada: NS, N, L, B, I, M, IS e TS; amostras menor qualidade: BM, BL e AP; amostras de origem duvidosa: CS e CSV.
Conclusões
As técnicas de voltametria de pulso diferencial e a espectrofotometria molecular mostraram-se importantes para identificar diferentes vinhos com o uso de ferramentas quimiometricas. O PCA e o HCA foram capazes de discriminar entre diferentes vinhos incluindo aqueles sem indicação de procedência e tipo de uva, podendo assim, qualificar estes vinhos. Esta metodologia tem o mérito de necessitar de mínima quantidade de amostra, com mínima geração de resíduos, sendo rápida e de baixo custo comparada à outras técnicas, podendo ser utilizada em equipamentos portáteis, facilitando a fiscalização para detecção de adulterações.
Agradecimentos
A CAPES pelo apoio financeiro (PROAP)
Referências
ALCALDE, B.; GRANADOS, M.; SAURINA, J. Exploring the Antioxidant Features of Polyphenols by Spectroscopic and Electrochemical Methods. Antioxidants, 8, 523, 2019.
BRASIL. IBGE. Levantamento Sistemático da Produção Agrícola 2020. Disponível em: <https://sidra.ibge.gov. br/home/lspa/brasil>. Acesso em: julho de 2021.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento (MAPA). INSTRUÇÃO NORMATIVA N° 14, DE 8 DE FEVEREIRO DE 2018. Disponível em: https://www.in.gov.br/materia/-/asset_publisher/kujrw0tzc2mb/content/id/5809096/do1-2018-03-09-instrucao-normativa-n-14-de-8-de-fevereiro-de-2018-5809092. Acesso em 14 de setembro de 2021.
CAMARGO, U. A.; TONIETTO, J.; HOFFMANN, A. Progressos na viticultura brasileira. Revista Brasileira de Fruticultura, v.33, p.144-149, 2011.
CETÓ, X.; SÁNCHEZ, C.; SERRANO, N.; DÍAZ-CRUZ, J. M.; NÚÑEZ, O. Authentication of paprika using HPLC-UV fingerprints. Lebensmittel-Wissenschaft und-Technologie-Food Science and Technology, 124, 109153, 2020.
CHIORCEA-PAQUIM, A-M.; ENACHE, T. A.; GIL, E. S.; OLIVEIRA-BRETT, A. M. Natural phenolic antioxidants electrochemistry: Towards a new food science methodology. Comprehensive reviews in food science and food safety, 19, 1680–1726, 2020.
GRACE, D. Food fraud. Encyclopedia of Food Security and Sustainability, 1, 238–248, 2019.
HODSON, G.; WILKES, E.; AZEVEDO, S.; BATTAGLENE, T. Methanol in wine. 40th world congress of vine and wine. BIO Web of Conferences, 9, Article 02028, 2017.
HOECKEL, P. H. O.; FREITAS, C. A.; FEISTEL, P. R. A política comercial brasileira e sua influência no setor vitivinícola. Revista Perspectiva Econômica, v.13, n.1,p.24-43, 2017.
KOLICHESKI, M. B. Fraudes em Alimentos. Boletim do Centro de Pesquisa de Processamento de Alimentos, v. 12, n. 1. Curitiba, 1994.
MCGRATH, T. F.; HAUGHEY, S. A.; PATTERSON, J.; FAUHL-HASSEK, C.; DONARSKI, J.; ALEWIJN, M. What are the scientific challenges in moving from targeted to nontargeted methods for food testing and how can they be addresses? – spectroscopy case study. Trends in Food Science & Technology, 76, 38–55, 2018.
MELLO, L. M. R. Vitivinicultura brasileira: panorama 2017. Comunicado técnico da Empresa Brasileira de Pesquisa Agropecuária (Embrapa), n. 207, p. 9, out. 2018.
MELLO, L. M. R.; MACHADO, C. A. E. Vitivinicultura brasileira: panorama. Embrapa Uva e Vinho - Comunicado Técnico (infoteca-e): EMBRAPA, 2020. Disponível em: https://www.infoteca.cnptia.embrapa.br/infoteca/handle/doc/1124189. Acesso em julho de 2021.
MIELE A.; RIZZON L. A.; ZANUS M.C. Discrimination of Brazilian red wines according to the viticultural region, varietal, and winery origin. Cienc Tecnol Aliment., 30 (1): 268-75, 2010.
RODIONOVA, O. Y.; POMERANTSEV, A. L. Chemometric tools for food fraud detection: The role of target class in nontargeted analysis. Food Chemistry, 317, 126448, 2020.
STANZIANI, A. Information, quality and legal rules: Wine adulteration in nineteenth century France. Business History, 51:2, 268-291, 2009.
VAN RUTH, S. M.; HUISMAN, W.; LUNING, P. A. Food fraud vulnerability and its key factors. Trends in Food Science & Technology, 67, 70–75, 2017.


