Estudo da solubilidade do cocristal de Norfloxacino e Nicotinamida.
- Home
- Trabalhos
ÁREA
Química Analítica
Autores
Costa, G.P. (UNESP BAURU) ; Ferreira, P.O. (UNESP BAURU) ; de Almeida, A.C. (UNESP BAURU) ; Ferreira, L.T. (UNESP ARARAQUARA) ; Ekawa, B. (UNESP ARARAQUARA) ; Caires, F.J. (UNESP BAURU)
RESUMO
O Norfloxacino (NOR) é um antibiótico de amplo espectro classificado com baixa solubilidade aquosa no Sistema de Classificação Biofarmacêutica (BCS), assim o objetivo deste trabalho é utilizar a cocristalização farmacêutica como uma estratégia de melhora da solubilidade aquosa sem modificar a propriedade terapêutica do fármaco. Neste estudo, a cocristalização foi realizada através do liquid assisted grinding utilizando como coformador a Nicotinamida (NA). A formação do cocristal foi evidenciada através do estudo do diagrama de fases binário e do DRXP, e a avaliação da solubilidade foi realizada através do método shake-flask, mostrando que a cocristalização farmacêutica do Norfloxacino utilizando Nicotinamida não foi eficiente para a melhora da solubilidade aquosa do fármaco.
Palavras Chaves
COCRISTAL; NORFLOXACINO; SOLUBILIDADE
Introdução
A formação de cocristais farmacêuticos para a melhora das propriedades físico-químicas dos fármacos é de grande destaque para a indústria farmacêutica, bem como para a pesquisa científica e para o desenvolvimento tecnológico (BREDA et al., 2009; JAYRAM; SUDHEER, 2020). Isto por que, esta abordagem permite a modificação físico-químicas em propriedades carentes, conservando o efeito terapêutico do fármaco (KARIMI-JAFARI et al., 2018; SATHISARAN; DALVI, 2018). Os cocristais são formas sólidas cristalinas multicomponentes, formadas através da interação intermolecular não covalente de um insumo farmacêutico ativo (IFA) e um coformador (molécula com status GRAS) através de uma estequiometria definida (CHERUKUVADA; ROW, 2014; DE ALMEIDA et al., 2020). Dentre as vantagens desta abordagem destaca-se a formação de synthons supramoleculares e a contribuição de forma positiva nas propriedades físico-químicas - como solubilidade e taxa de dissolução -, que irão resultar no aumento da absorção no organismo e por consequência irá reduzir os efeitos adversos ao paciente, devido ao menor período e quantidade de fármaco administrado (BREDA et al., 2009; ROCHA et al., 2016; SUROV et al., 2019). O Norfloxacino (NOR) é um antibiótico de amplo espectro utilizado no tratamento de doenças infecciosas e infecções do trato gastrointestinal e do trato urinário (BARBAS; PROHENS; PUIGJANER, 2007; FERREIRA et al., 2020). Entretanto, o NOR é classificado na classe IV do sistema de Biopharmaceutical classification System, devido sua baixa solubilidade aquosa e baixa permeabilidade (BASAVOJU; BOSTRÖM; VELAGA, 2006; P. FERREIRA et al., 2019). Em vista disso, entende-se a abordagem da cocristalização farmacêutica uma estratégia promissora para o aperfeiçoamento das propriedades do NOR.
Material e métodos
A síntese do cocristal foi realizada pelo método mecanoquímico, utilizando moinho de bolas vibratório da RETSCH, modelo MM 400, com emprego de solvente (liquid assisted grinding - LAG). Após a síntese os sistemas foram colocados em estufa com circulação e renovação de ar para a eliminação do solvente residual. Para a caracterização do sistema foi elaborado um diagrama binário de fases utilizando os dados obtidos através da análise de Calorimetria Exploratória Diferencial (DSC) utilizando o equipamento DSC 1 STARe System da METTLER TOLEDO, razão de aquecimento de 10 °C min-1, atmosfera de ar sintético com vazão de 50 mL min-1; e a Difratometria de Raios X do Pó (DRXP) no difratômetro da RIGAKU, Modelo MiniFlex, utilizando tubo de cobre, submetido a 40 kV, corrente de 15 mA, Cu κα, λ = 1,54056 Å, 5 ≤ 2θ ≤ 50, no modo de varredura contínuo, com velocidade de 4°min-1. Para o estudo da solubilidade foi utilizado o método do shake-flask em uma incubadora shaker da Marconi, modelo MA 410 com leituras em triplicata no comprimento de onda em 277 nm em um espectrofotômetro UV-VIS da Agilent Technologies, modelo Cary 8454 utilizando a metodologia de quantificação do NOR validada no UV- Vis (CHIERENTIN; SALGADO, 2014).
Resultado e discussão
O diagrama de fases binário do sistema NOR-NA (Figura 1 (a)) apresenta
formato de “W” característico da formação de cocristal (CHERUKUVADA; ROW,
2014; SATHISARAN; DALVI, 2018). Este também aponta que a estequiometria do
cocristal é na razão molar 1:1 (ALMEIDA et al., 2019b). Além disso, observa-
se a formação de duas misturas eutéticas entre o coformador e o cocristal na
fração molar de 0,1 (126,65 °C) e também entre o cocristal e o IFA na fração
molar de 0,7 (185,55 °C). No difratograma do sistema NOR-NA (Figura 1 (b))
nota-se que houve a formação de um novo padrão difratométrico, através da
formação de novos picos de difração, o que aponta a formação de uma nova
forma sólida cristalina. Em concordância com os dados termoanalíticos
conclui-se que houve a formação do cocristal NOR-NA. O cocristal NOR-NA
formado, foi submetido ao estudo da solubilidade, o resultado obtido (Figura
2 (a)), foi colocado em comparação com os dados do NOR isolado e mostrou uma
redução de 1,8 vezes na solubilidade (Figura 2 (b)), evidenciando que a
cocristalização farmacêutica não atingiu o objetivo de melhorar a
solubilidade do fármaco.

(a) Diagrama binário de fases e (b) DRXP do sistema NOR-NA e seus percursores.
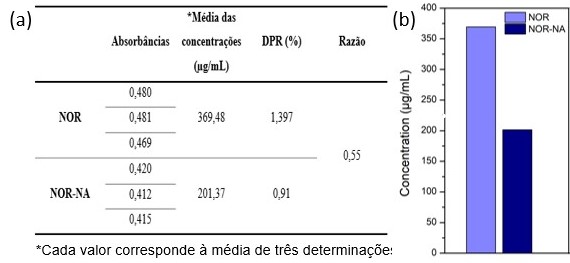
(a)Valores de absorbâncias, média de concentrações, DPR e razão e (b) Gráfico das concentrações do NOR e do cocristal NOR-NA em sistema aquoso.
Conclusões
Um novo cocristal foi sintetizado, confirmado pela presença do “W” no diagrama binário de fases e pela presença de um novo padrão de difração. No entanto, o estudo da solubilidade mostrou-se desfavorável, visto que o cocristal NOR-NA possui menor solubilidade aquosa que o NOR, situação que pode ser aplicável para cocristais de pesticidas, explosivos ou outros produtos, mas não é interessante para a indústria farmacêutica. Os resultados mostram então, que com o uso deste coformador a abordagem da cocristalização farmacêutica não atingiu o objetivo de melhorar a solubilidade desse fármaco.
Agradecimentos
FAPESP: Proc. 2017/14936-9, 2018/12463-9, 2020/07724-8 CNPq: Proc. 143246/2017-8 CAPES PrInt: Proc. 88887.582123/2020-00 CAPES: Proc. 88887.495141/2020-00
Referências
BARBAS, R.; PROHENS, R.; PUIGJANER, C. A new polymorph of Norfloxacin. Journal of Thermal Analysis and Calorimetry, [s. l.], v. 89, n. 3, p. 687–692, 2007. Disponível em: <http://scripts.iucr.org/cgi-bin/paper?S1600536807016455>
BASAVOJU, S.; BOSTRÖM, D.; VELAGA, S. P. Pharmaceutical Cocrystal and Salts of Norfloxacin. Crystal Growth & Design, [s. l.], v. 6, n. 12, p. 2699–2708, 2006. Disponível em: <https://pubs.acs.org/doi/10.1021/cg060327x>
BREDA, S. A.; JIMENEZ-KAIRUZ, A. F.; MANZO, R. H.; OLIVERA, M. E. Solubility behavior and biopharmaceutical classification of novel high-solubility ciprofloxacin and norfloxacin pharmaceutical derivatives. International Journal of Pharmaceutics, [s. l.], v. 371, n. 1–2, p. 106–113, 2009. Disponível em: <https://linkinghub.elsevier.com/retrieve/pii/S0378517308008600>
CHERUKUVADA, S.; ROW, T. N. G. Comprehending the Formation of Eutectics and Cocrystals in Terms of Design and Their Structural Interrelationships. Crystal Growth & Design, [s. l.], v. 14, p. 4187–4198, 2014.
CHIERENTIN, L.; SALGADO, H. R. N. Performance Characteristics of UV and Visible Spectrophotometry Methods for Quantitative Determination of Norfloxacin in Tablets. Journal of Scientific Research, [s. l.], p. 12, 2014.
DE ALMEIDA, A. C.; FERREIRA, P. O.; TORQUETTI, C.; EKAWA, B.; CARVALHO, A. C. S.; DOS SANTOS, E. C.; CAIRES, F. J. Mechanochemical synthesis, characterization and thermal study of new cocrystals of ciprofloxacin with pyrazinoic acid and p-aminobenzoic acid. Journal of Thermal Analysis and Calorimetry, [s. l.], v. 140, n. 5, p. 2293–2303, 2020. Disponível em: <https://doi.org/10.1007/s10973-019-08958-3>
FERREIRA, P. O.; DE ALMEIDA, A. C.; DOS SANTOS, É. C.; DROPPA, R.; FERREIRA, F. F.; KOGAWA, A. C.; CAIRES, F. J. A norfloxacin-nicotinic acid cocrystal: Mechanochemical synthesis, thermal and structural characterization and solubility assays. Thermochimica Acta, [s. l.], v. 694, n. September, p. 178782, 2020. Disponível em: <https://linkinghub.elsevier.com/retrieve/pii/S0040603120306973>
JAYRAM, P.; SUDHEER, P. Pharmaceutical co-crystals : a systematic review. International Journal of Pharmaceutics, [s. l.], v. 10, n. 3, p. 246–252, 2020.
KARIMI-JAFARI, M.; PADRELA, L.; WALKER, G. M.; CROKER, D. M. Creating Cocrystals: A Review of Pharmaceutical Cocrystal Preparation Routes and Applications. Crystal Growth & Design, [s. l.], v. 18, n. 10, p. 6370–6387, 2018. Disponível em: <https://pubs.acs.org/doi/10.1021/acs.cgd.8b00933>
P. FERREIRA, P. O.; TORQUETTI, C.; ALMEIDA, A. C. De; CARVALHO, É. Thermoanalytical study of a new norfloxacin solvate. Brasilian Journal of Thermal Analysis, [s. l.], p. 1–7, 2019.
ROCHA, A. B. O.; KUMINEK, G.; MACHADO, T. C.; ROSA, J.; RAUBER, G. S.; BORBA, P. A.; SIEDLER, S.; STULZER, H. K.; CUFFINI, S. L.; RODRIGUEZ-HORNEDO, N.; CARDOSO, S. G. Cocristais: uma estratégia promissora na área farmacêutica. Química Nova, [s. l.], v. 39, n. 9, p. 1112–1125, 2016. Disponível em: <http://quimicanova.sbq.org.br/audiencia_pdf.asp?aid2=6497&nomeArquivo=RV20160069.pdf>
SATHISARAN, I.; DALVI, S. Engineering Cocrystals of Poorly Water-Soluble Drugs to Enhance Dissolution in Aqueous Medium. Pharmaceutics, [s. l.], v. 10, n. 3, p. 108, 2018. Disponível em: <http://www.mdpi.com/1999-4923/10/3/108>
SUROV, A. O.; MANIN, A. N.; VORONIN, A. P.; BOYCOV, D. E.; MAGDYSYUK, O. V.; PERLOVICH, G. L. New Pharmaceutical Cocrystal Forms of Flurbiprofen: Structural, Physicochemical, and Thermodynamic Characterization. Crystal Growth and Design, [s. l.], v. 19, n. 10, p. 5751–5761, 2019.


