Oxidação de etanol, etilenoglicol e glicerol catalisadas por Ni-Ag suportados em óxido de grafeno reduzido. Uma atualização do estudo
- Home
- Trabalhos
ÁREA
Físico-Química
Autores
dos Santos, J.R.N. (UFMA) ; Alves, I.C.B. (UFMA) ; Marques, A.L.B. (UFMA) ; Marques, E.P. (UFMA)
RESUMO
Compósitos Ni-Ag suportados em óxido de grafeno reduzido (rGO) foram preparados e investigados como eletrocatalisadores para oxidação de etanol, etilenoglicol e glicerol. Difratogramas de raios X obtidos para os compósitos Ni-Ag/rGO apresentaram picos característicos da estrutura cúbica de face centrada da Ag. A técnica de voltametria cíclica revelou que o Ni-Ag/rGO apresenta uma melhor atividade eletrocatalítica em comparação ao Ni/rGO monometálico, além disso, o catalisador sintetizado na composição atômica 66:34 (Ni:Ag) apresentou o melhor desempenho. Acredita-se que o catalisador Ni66Ag34/rGO seja uma alternativa econômica e promissora para a reação de eletro-oxidação de etanol, etilenoglicol e glicerol.
Palavras Chaves
Oxidação de álcoois; Eletrocatalisadores; Óxido de grafeno reduzido
Introdução
Nos últimos 50 anos houve um crescimento contínuo da população mundial, o que levou a um grande aumento no consumo de energia. Atualmente, os combustíveis fósseis (carvão mineral, gás natural e petróleo) atendem a cerca de 80% da demanda de energia primária consumida no mundo (IEA, 2019). Os subprodutos da combustão de combustíveis fósseis tais como material particulado, hidrocarbonetos policíclicos aromáticos, dióxido de nitrogênio e dióxido de carbono representam uma grave ameaça à saúde humana e ao meio ambiente. Além disso, a exploração excessiva e pouco eficiente dos combustíveis fósseis está diminuindo rapidamente as reservas destes recursos, algumas projeções sugerem que as reservas mundiais de petróleo e gás acabarão em meados deste século e o carvão sessenta anos depois (MUSA et al., 2018). Portanto, existe a necessidade de desenvolver fontes alternativas de energia que sejam renováveis, sustentáveis, eficientes, economicamente viáveis e menos nocivas ao meio ambiente. Entre as fontes alternativas disponíveis, as células a combustível são consideradas uma opção promissora para a produção sustentável de energia. Estes dispositivos têm a capacidade de converter a energia química de um combustível em energia elétrica através de reações de oxirredução, com baixos níveis de liberação de poluentes e alta eficiência. Estas características fazem com que as células a combustível sejam consideradas as fontes de geração de energia do futuro, com benefícios econômicos e ambientais a longo prazo (BADWAL et al., 2015). A células a combustível que oxidam diretamente álcoois (Direct Alcohol Fuel Cells – DAFCs) tem despertado o interesse dos pesquisadores (SIWAL et al., 2019), devido à alta densidade de energia dos álcoois, configuração compacta, recarga instantânea e facilidade de armazenamento e transporte dos combustíveis. Por outro lado, algumas limitações ainda dificultam a aplicação em larga escala das DAFCs. Uma das maiores dificuldades são os altos custos dos eletrocatalisadores, geralmente constituídos de metais nobres principalmente platina (AKHAIRI; KAMARUDIN, 2016). Uma das alternativas possíveis para reduzir os preços e impulsionar a comercialização é a utilização de catalisadores a base de metais de menor custo como Ni, Fe, Cu, Pd, etc. Diferentes eletrocatalisadores a base de metais não nobres têm sido investigados como catalisadores alternativos, entre os quais o níquel tem sido apontado como um candidato importante a ser utilizado para a eletro-oxidação de álcoois devido a sua excelente atividade eletrocatalítica em meio alcalino, baixo custo e baixa toxicidade (YU et al., 2019). Por outro lado, os eletrocatalisadores de Ni apresentam alguns inconvenientes como o alto potencial de início, o que tem levado os pesquisadores a desenvolver diferentes estratégias para aprimorar o desempenho dos materiais baseados em Ni (ABDELKAREEM et al., 2020). Uma das formas utilizadas para otimizar o desempenho catalítico do Ni é seu uso combinado com outros elementos metálicos (BARAKAT et al., 2014) e óxidos metálicos (HASSAN et al., 2016). Outra estratégia adotada para melhorar o desempenho dos catalisadores a base de Ni é a utilização de diferentes tipos de suporte tais como nanotubos de carbono e grafeno (WANG et al., 2013). O uso desses suportes pode acrescentar uma série de características favoráveis aos catalisadores como aumento da área superficial, melhor dispersão de nanopartículas e transferência de carga eficiente. Nos últimos anos o grafeno tem sido um material bastante explorado como suporte em eletrocatalisadores devido suas excelentes propriedades como grande área superficial, alta mobilidade eletrônica a temperatura ambiente, elevada condutividade térmica, alto módulo de elasticidade e força intrínseca (LIU et al., 2018). O grafeno pode ser fabricado por diferentes métodos os quais incluem a esfoliação mecânica, remoção de fase líquida, método oxidação-redução, deposição de vapor químico etc. Atualmente o método de oxidação-redução é um dos mais amplamente utilizados por ser menos complicado, apresentar custo reduzido, ser altamente processável em comparação com outros métodos e produzir grande quantidade de folhas semelhantes ao grafeno denominadas óxido de grafeno reduzido (rGO) (TANISELASS et al., 2019). Tendo em vista todas as vantagens relacionadas a utilização de suportes a base de grafeno em eletrocatalisadores metálicos, bem como o bom desempenho eletrocatalítico de materiais a base de níquel para a oxidação de pequenas moléculas orgânicas em meios alcalinos, o presente trabalho teve como tema principal a investigação da atividade eletrocatalítica de nanopartículas Ni-Ag suportadas em óxido de grafeno reduzido para a eletro-oxidação de etanol, etilenoglicol e glicerol.
Material e métodos
Os reagentes (todos de grau analítico) utilizados neste trabalho foram: nitrato de níquel hexahidratado (Isofar), nitrato de prata (Qhemis), borohidreto de sódio (Merck), etanol (Dinâmica), etilenoglicol (Merck), glicerol (Aldrich), hidróxido de sódio (Merck), grafite sintético em pó (Aldrich), ácido sulfúrico (Aldrich), permanganato de potássio (Aldrich), ácido clorídrico (Aldrich) e peróxido de hidrogênio (Merck). O óxido de grafite (GO) foi preparado de acordo com o método proposto por Hummers e Offeman (1958) com modificações (DU et al., 2010). Para a síntese do compósito Ni50Ag50/rGO, inicialmente 40 mg de GO foram dispersos em 30 mL de água por ultrasonicação durante 1 h. Subsequentemente, 0,15 mmol de NiNO3.6H2O e 0,15 mmol de AgNO3 (razão molar de Ag:Ni = 1:1) foram dissolvidos em 10 mL de água e depois gradualmente adicionados à dispersão de GO. A mistura resultante foi agitada magneticamente durante 10 minutos e N2 foi passado para purgar para fora todo o oxigênio dissolvido. Depois, 8 mL de uma solução de NaBH4 1,0 M foi adicionado gota a gota à mistura reacional à temperatura ambiente e agitou-se durante 30 minutos. Em seguida a mistura resultante foi refluxada a 110°C durante 2,5 h. O produto preto resultante foi filtrado, lavado com água durante três vezes e depois seco num forno a 50°C. Um esquema semelhante foi aplicado para a síntese das amostras de Ni/rGO, Ni75Ag25/rGO, Ni66Ag34/rGO e Ag/RGO, ajustando as relações molares dos precursores de Ag e Ni (DHANDA; KIDWAI, 2015). Espectros de infravermelho dos materiais (GO, Ni-Ag/rGO) foram obtidos com o espectrômetro Shimadzu IR Prestige-21 na região de 400 a 4000 cm-1, com amostras preparadas em pastilhas de KBr (1%). Análises de difração de raios X foram realizadas em um difratômetro Bruker D8 Advance usando radiação Cu-Kα no intervalo de ângulo 2θ entre 5 e 65°. Os experimentos eletroquímicos foram realizados em uma célula convencional de três eletrodos utilizando um potenciostato modelo PGSTAT 302 da Metrohm. Um eletrodo de carbono vítreo, AgǀAgClǀKClsat e um fio de platina, foram utilizados como eletrodos de trabalho, referência e auxiliar, respectivamente. Para a preparação do eletrodo de trabalho, primeiramente 5 mg do catalisador, 980 µL de isopropanol e 20 µL de solução de Nafion (5%) foram misturados e dispersos por sonicação durante 40 min. Em seguida, 20 µL da suspensão foram depositados diretamente na superfície do eletrodo de carbono vítreo polido. O eletrodo foi então levado ao dessecador para secagem a vácuo. As densidades de correntes apresentadas neste trabalho foram calculadas utilizando a área geométrica do eletrodo de trabalho (0,196 cm2).
Resultado e discussão
A Figura 1(A) apresenta os espectros de infravermelho registrados entre 400 a
4000 cm-1, para as amostras GO, Ni/rGO, Ni75Ag25/rGO, Ni66Ag34/rGO,
Ni50Ag50/rGO e Ag/rGO. O espectro obtido para o GO exibe uma série de bandas
atribuídas a diferentes tipos de grupos funcionais oxigenados, resultantes do
processo de oxidação. A presença destes grupos é confirmada em: 3340 cm-1
(relacionada a vibração de estiramento de O-H), 1725 cm-1 (vibração de
estiramento C=O), 1398 cm-1 (C-O carboxílico), 1221 cm-1 (vibração de
estiramento C-OH) e 1050 cm-1 (vibração de estiramento C-O). A banda em 1617
cm-1 pode ser atribuída à presença de H2O adsorvido ou a domínios grafíticos
não-oxidados correspondentes a ligações C=C de anéis benzênicos (SHEN et al.,
2012). Para os compósitos Ni/rGO, Ni75Ag25/rGO, Ni66Ag34/rGO, Ni50Ag50/rGO e
Ag/rGO observa-se uma redução na intensidade das bandas atribuídas as
vibrações de estiramento O-H observadas por volta de 3450 cm-1. A banda em
1725 cm-1 desaparece indicando a remoção de C=O. A ausência do pico em 1617
cm-1 indica remoção de moléculas de água adsorvida nas folhas do GO durante a
síntese dos nanocompósitos. Este resultado mostra que muitos grupos contendo
oxigênio foram removidos e confirma o sucesso da redução do óxido de grafeno.
Além disso, picos centralizados em 2978 e 2880 cm-1 podem ser atribuídos a
vibrações de estiramento -CH2 das folhas de grafeno. Também é observada a
formação de uma nova banda a 1540 cm-1 correspondente as vibrações de
esqueleto de rGO, o que está de acordo com relatos anteriores (DHANDA; KIDWAI,
2015; SATHEESH; JAYAVEL, 2013).
A Figura 1B mostra os padrões de DRX obtidos para as diferentes amostras. O
difratograma obtido para o GO apresentou picos de difração em 9,98 e 42,4˚ que
correspondem aos planos (001) e (002) do GO, respectivamente. No entanto,
esses picos de DRX não foram observados nos compósitos com suporte de rGO,
indicando a redução de GO para rGO. O padrão de difração da amostra Ag/RGO
exibe três picos característicos centrados em 38,0; 44,1 e 64,3˚
correspondentes aos planos (111), (200) e (220) de estruturas cúbicas de face
centrada (CFC) da Ag. Da mesma forma, as ligas Ni-Ag suportadas por rGO também
exibem três picos característicos de estruturas CFC da Ag. Para diferentes
composições de ligas, nenhum pico foi observado em 2θ = 52,15˚ correspondendo
ao plano (200) do metal Ni CFC que elimina toda a possibilidade de NPs de Ni
heterogêneos. A semelhança com a estrutura CFC da Ag e ausência de um pico de
Ni característico indica que os átomos de Ni crescem apenas dentro da rede Ag
e formam uma solução sólida. Os difratogramas de DRX do Ni-Ag/rGO também
apresentam alguns picos de impureza correspondentes a Ni(OH)2 que pode ser
devido à oxidação de um excesso de átomos de metal Ni que não foram acomodados
pela rede da Ag (CHANDEL et al., 2019; DHANDA et al., 2015). O difratograma do
Ni/rGO exibe um pico centrado em 24,0˚ que corresponde a reflexão (002) do
rGO. Essa reflexão não foi claramente vista para as amostras Ag/rGO e
AgXNi100-X/rGO, provavelmente devido a picos de Ag intensos sobre as
nanofolhas de rGO. Os picos em 33,8 e 59,8˚ são correspondentes aos planos
cristalinos (100) e (110) do Ni(OH)2, o pico em 43,2˚ é característico do
plano (200) do NiO (BHOWMIK et al., 2014). Nenhum pico correspondente ao Ni
metálico foi observado no espectro de DRX de Ni/rGO puro. A partir dos
resultados discutidos acima, pode-se concluir que os átomos de Ni(0) não são
estáveis na ausência de uma rede Ag e se oxidam facilmente, no entanto, a
presença de Ag estabiliza os átomos de Ni(0) fornecendo locais de nucleação e,
portanto, evita oxidação (DHANDA et al., 2015).
A atividade eletrocatalítica dos materiais sintetizados foi investigada para a
oxidação do etanol, etilenoglicol e glicerol por voltametria cíclica. Os
resultados obtidos para o Ni/rGO, Ni75Ag25/rGO, Ni66Ag34/rGO, Ni50Ag50/rGO e
Ag/rGO em solução de NaOH 1,0 mol L-1, na presença de etanol, etilenoglicol e
glicerol (0,10 M) são mostrados nas Figuras 2A, 2B e 2C, respectivamente. O
compósito Ag/rGO não apresentou atividade eletrocatalítica para a oxidação dos
álcoois estudados (curvas verdes, Figuras 2A, 2B e 2C). Entretanto, a presença
das nanopartículas de Ag no Ni75Ag25/rGO, Ni66Ag34/rGO e Ni50Ag50/rGO promoveu
uma melhora na atividade catalítica para oxidação de etanol, etilenoglicol e
glicerol. Isto pode ser observado comparando as respostas dos catalisadores
NiXAg100-X/rGO com Ni/rGO. Os catalisadores bimetálicos exibiram densidades de
corrente do pico de oxidação maiores que o Ni/rGO monometálico para os três
álcoois avaliados, conforme mostrado na Figura 2D. Além disso, verificou-se
que o Ni66Ag34/rGO apresenta maiores densidades de corrente catalítica para
oxidação de etanol, etilenoglicol e glicerol em relação as outras amostras. As
densidades de corrente de pico obtidas no Ni66Ag34/rGO associadas a eletro-
oxidação de etanol, etilenoglicol e glicerol foram, respectivamente, 43,3;
60,6 e 62,9 mA cm-2. Esses valores são 1,7; 1,8 e 1,5 vezes mais elevados em
comparação ao obtidos com o Ni/rGO (25,3; 33,9 e 41,4 mA cm-2). As densidades
de corrente para oxidação dos álcoois aumentaram na ordem Ni/rGO <
Ni50Ag50/rGO < Ni75Ag25/rGO < Ni66Ag34/rGO. Os resultados encontrados estão de
acordo com estudos anteriores que relatam um excelente desempenho catalítico
de materiais contendo Ni e Ag para eletro-oxidação de diferentes moléculas
orgânicas (JIN et al., 2009; LI et al., 2016; YI et al., 2010; YU et al.,
2017). A atividade eletrocalítica aprimorada dos compósitos Ni-Ag/rGO pode ser
explicada pelos seguintes fatores: 1) boa condutividade da Ag; 2) a maior área
superficial específica fornecida pelas nanopartículas de Ag; 3) o efeito
sinérgico das nanopartículas Ni-Ag e o rGO.
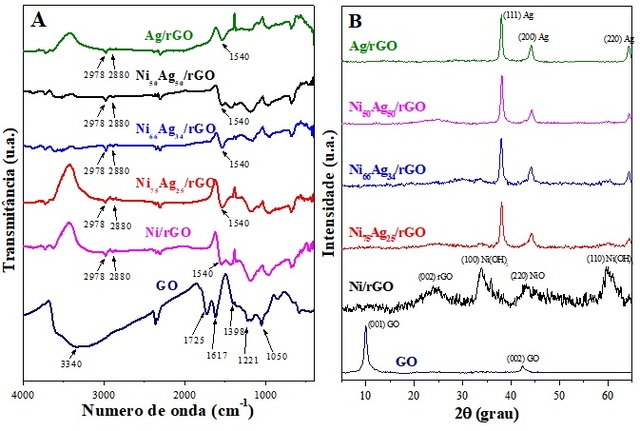
Análises de (A) FTIR e (B) DRX realizadas para o OG, Ni/rGO, Ni75Ag25/rGO, Ni66Ag34/rGO, Ni50Ag50/rGO e Ag/rGO.
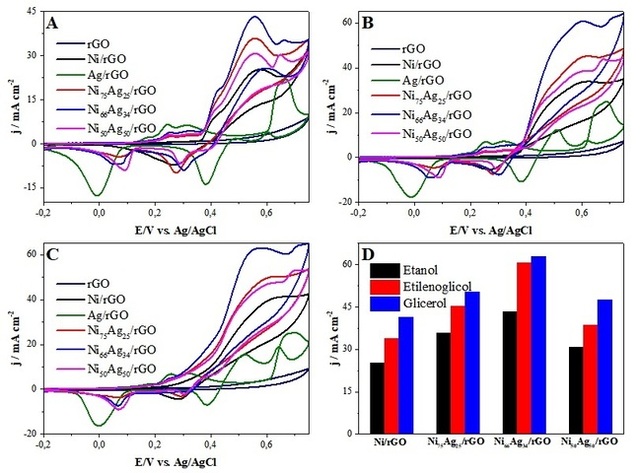
Voltamogramas cíclicos da oxidação de (A) etanol (B) etilenoglicol e (C) glicerol (0,1 M) com diferentes catalisadores. (D) Densidades de corrente.
Conclusões
No presente estudo, compósitos Ni-Ag suportados em óxido de grafeno reduzido (rGO) foram sintetizadas pelo método de redução química com borohidreto de sódio e a atividade catalítica destes materiais para eletro-oxidação de etanol, etilenoglicol e glicerol foi avaliada. Os catalisadores NiXAg100-X/rGO apresentaram uma atividade catalítica mais alta para a eletro-oxidação de etanol, etilenoglicol e glicerol do que o catalisador Ni/rGO em solução alcalina. Dentre os catalisadores preparados, o Ni66Ag34/rGO revelou a maior atividade eletrocatalítica para oxidação destes álcoois, como evidenciado pelas maiores densidades de corrente obtidas nos experimentos voltamétricos. Portanto, o catalisador Ni66Ag34/rGO é considerado uma alternativa econômica e promissora para a reação de oxidação de etanol, etilenoglicol e glicerol.
Agradecimentos
CAPES (PROCAD-AM / SCBA 450 88887.200615 / 2018-00], CNPq [PQ 2017, Proc. 310664 / 2017-9], ANP [1.029 / 2016-ANP-007.639] e FAPEMA (UNIVERSAL-01136/17).
Referências
ABDELKAREEM, M. A.; SAYED, E. T.; MOHAMED, H. O.; OBAID, M.; REZK, H.; CHAE, K. J. Nonprecious anodic catalysts for low-molecular-hydrocarbon fuel cells: Theoretical consideration and current progress. Progress in Energy and Combustion Science, v. 77, p. 100805, 2020.
AKHAIRI, M. A. F.; KAMARUDIN, S. K. Catalysts in direct ethanol fuel cell (DEFC): An overview. International Journal of Hydrogen Energy, v. 41, p. 4214-4228, 2016.
BADWAL, S. P. S.; GIDDEY, S.; KULKARNI, A.; GOEL, J.; BASU, S. Direct ethanol fuel cells for transport and stationary applications – A comprehensive review. Applied Energy, v. 145, p. 80-103, 2015.
BARAKAT, N. A.; MOTLAK, M.; ELZATAHRY, A. A.; KHALIL, K. A.; ABDELGHANI, E. A. NixCo1−x alloy nanoparticle-doped carbon nanofibers as effective non-precious catalyst for ethanol oxidation. International Journal of Hydrogen Energy, v. 39, p. 305-316, 2014.
BHOWMIK, K.; MUKHERJEE, A.; MISHRA, M. K.; DE, G. Stable Ni nanoparticle–reduced graphene oxide composites for the reduction of highly toxic aqueous Cr(VI) at room temperature. Langmuir, v. 30, n. 11, p. 3209-3216, 2014.
CHANDEL, M.; MAKKAR, P.; GHOSH, N. N. Ag–Ni nanoparticle anchored reduced graphene oxide nanocomposite as advanced electrode material for supercapacitor application. ACS Applied Electronic Materials, v. 1, n. 7, p. 1215-1224, 2019.
DHANDA, R.; KIDWAI, M. Reduced graphene oxide supported AgxNi100−x alloy nanoparticles: a highly active and reusable catalyst for the reduction of nitroarenes. Journal of Materials Chemistry A, v. 3, p. 19563-19574, 2015.
DU, Q.; ZHENG, M.; ZHANG, L.; WANG, Y.; CHEN, J.; XUE, L.; DAI, W.; JI, G.; CAO, J. Preparation of functionalized graphene sheets by a low-temperature thermal exfoliation approach and their electrochemical supercapacitive behaviors. Electrochimica Acta, v. 55, p. 3897-3903, 2010.
HASSAN, H. B.; HAMID, Z. A.; EL-SHERIF, R. M. Electrooxidation of methanol and ethanol on carbon electrodeposited Ni–MgO nanocomposite. Chinese Journal of Catalysis, v. 37, p. 616-627, 2016.
HUMMERS JR, W. S.; OFFEMAN, R. E. Preparation of graphitic oxide. Journal of the American Chemical Society, v. 80, p. 1339-1339, 1958.
IEA. International Energy Agency. Key World energy Statistics, 2019.
JIN, G. P.; BARON, R.; REES, N. V.; XIAO, L.; COMPTON, R. G. Magnetically moveable bimetallic (nickel/silver) nanoparticle/carbon nanotube composites for methanol oxidation. New Journal of Chemistry, v. 33, n. 1, p. 107-111, 2009.
LI, W.; OUYANG, R.; ZHANG, W.; ZHOU, S.; YANG, Y.; JI, Y.; MIAO, Y. Single walled carbon nanotube sandwiched Ni-Ag hybrid nanoparticle layers for the extraordinary electrocatalysis toward glucose oxidation. Electrochimica Acta, v. 188, p. 197-209, 2016.
LIU, J.; CHOI, H. J.; MENG, L. Y. A review of approaches for the design of high-performance metal/graphene electrocatalysts for fuel cell applications. Journal of Industrial and Engineering Chemistry, v. 64, p. 1-15, 2018.
MUSA, S. D.; ZHONGHUA, T.; IBRAHIM, A. O.; HABIB, M. China's energy status: a critical look at fossils and renewable options. Renewable and Sustainable Energy Reviews, v. 81, p. 2281-2290, 2018.
SATHEESH, K.; JAYAVEL, R. Synthesis and electrochemical properties of reduced graphene oxide via chemical reduction using thiourea as a reducing agent. Materials Letters, v. 113, p. 5-8, 2013.
SHEN, J.; LI, T.; LONG, Y.; SHI, M.; LI, N.; YE, M. One-step solid state preparation of reduced graphene oxide. Carbon, v. 50, n. 6, p. 2134-2140, 2012.
TANISELASS, S.; ARSHAD, M. M.; GOPINATH, S. C. Graphene-based electrochemical biosensors for monitoring noncommunicable disease biomarkers. Biosensors and Bioelectronics, 2019.
WANG, Z.; DU, Y.; ZHANG, F.; ZHENG, Z.; ZHANG, Y.; WANG, C. High electrocatalytic activity of non-noble Ni-Co/graphene catalyst for direct ethanol fuel cells. Journal of Solid State Electrochemistry, v. 17, p. 99-107, 2013.
YI, Q.; LI, L.; YU, W.; LIU, X.; ZHOU, Z.; NIE, H. Novel nanoporous binary Ag-Ni electrocatalysts for hydrazine oxidation. Rare Metals, v. 29, p. 26-31, 2010.
YU, Y.; CHENG, Y.; GUO, M.; LI, C.; HU, J. Ag nanoparticles supported on nickel foam: a flexible 3D electrode for methanol electrocatalytic oxidation. RSC advances, v. 7, n. 63, p. 39539-39545, 2017.
YU, Y.; ZHAI, M.; HU, J. Electrocatalytic oxidation of ethanol and ethylene glycol on bimetallic Ni and Ti nanoparticle-modified indium tin oxide electrode in alkaline solution. Progress in Natural Science: Materials International, v. 29, p. 511-516, 2019.


