Estudo da interação da glucosamina com o ácido acético e íon acetato
- Home
- Trabalhos
ÁREA
Físico-Química
Autores
Miritz Müller, J. (FACULDADE VENDA NOVA DO IMIGRANTE) ; C.s. Junior, H. (UNIVERSIDADE FEDERAL FLUMINENSE) ; Schmitt, M. (UNIVERSIDADE LUTERANA DO BRASIL) ; Santiago, F. (UNIVERSIDADE LUTERANA DO BRASIL) ; Schuck Figueiredo, D. (UNIVERSIDADE LUTERANA DO BRASIL) ; Pighinelli, L. (BIOMATTER)
RESUMO
Esse trabalho como objetivo estudar como que o ácido acético e o íon acetato interagem com a glucosamina. Para isso, foram utilizados os softwares GFN2-xTB e ORCA 4.2.1, na qual os sistemas foram submetidos a cálculos de química computacional. Os resultados mostraram que o sistema com glucosamina e íon acetato é mais instável, e que o ácido e o íon acetato interagem diferente com a molécula orgânica. As zonas de ataque eletrofílico e nucleofílico de cada sistema foram diferentes e glucosamina interage com os solventes somente através de ligação de hidrogênio e interação de Van Der Waals. O estudo foi validado com base na comparação dos espectros computacional e experimental da glucosamina, onde os espectros computacionais e teóricos tiveram um alto nível de coincidência.
Palavras Chaves
Glucosamina; Solventes ácidos; Química computacional
Introdução
A glucosamina é um monossacarídeo que pode ser obtido comercialmente através da desacetilação da quitina (CAMARGO; CAMARGO, 2019). Devido a propriedades relevantes, como biocompatibilidade e caráter atóxico, a glucosamina demostra crescente importância no mercado e em áreas da ciência, como biomedicina, tratamentos de biorremediação e tecnologias farmacêuticas (RODYGIN; VORONIN; LEDOVSKAYA, 2020). A glucosamina (monômero da quitosana) possui grupos em sua estrutura que lhe confere características únicas, onde um grupo amina no carbono 3, quatro hidroxilas e um oxigênio como heteroátomo são responsáveis pela reatividade e propriedades físico-químicas da molécula (WEN, 2019). Para podermos utilizar e manipular a quitosana e a glucosamina, é necessário dissolver as moléculas em ácido, uma vez que em pH inferior a 6 a quitosana e a glucosamina são solúveis em água, o que facilita o manuseio dessas substâncias. Vários são os ácidos que são utilizados para a dissolução da quitosana e da glucosamina, contudo, os ácidos mais utilizados são o ácido acético e o ácido clorídrico (ZHANG et al., 2019). Uma vez que a quitosana e a glucosamina podem ser dissolvidas em diversos ácidos, a escolha do solvente é importante ao passo que cada dissolução apresenta propriedades diferentes. Em um estudo para observar a aplicação foliar de quitosana dissolvida em diferentes ácidos orgânicos no tomate, foram testados os ácidos cítrico, ascórbico, acético e málico. Para a tarefa, as dissoluções que melhor executaram a função de proteger a fruta foram as com ácido ascórbico e cítrico devido às diferentes interações que cada ácido assume com a quitosana e a glucosamina (ATTIA et al., 2021). Métodos de química computacional e modelagem molecular são ferramentas que auxiliam na compreensão de sistemas químicos através de cálculos executados por computadores que utilizam aproximações da equação de Schrödinger, funcional de densidade e dados empíricos (MCARDLE et al., 2020). A química computacional possui caráter previsível, uma vez que podemos conhecer propriedades experimentais de um sistema molecular a priori (GOH; HODAS; VISHNU, 2017). A simulação computacional química revela o comportamento quântico e mecânico de átomos, moléculas e sistemas químicos. Informações quanto propriedades termoquímicas, eletrônicas e fenômenos quânticos que ocorrem nos sistemas moleculares podem ser calculados através de softwares específicos e os resultados podem ser comparados com dados experimentais ou utilizados para explicar eventos e fenômenos que ocorrem com a molécula (SOLÀ; DE PROFT; BICKELHAUPT, 2019). Tendo em vista a ampla aplicação da química computacional, sobretudo sua função de prever fenômenos que podem ocorrer em laboratórios e também os explicar, trabalhos que envolvem química teórica enriquecem o conhecimento e abrem portas para o desenvolvimento tecnológico, como o exemplo da nanotecnologia. Desse modo, esse trabalho se justifica pelo fomento à importância de conhecer melhor os sistemas químicos que são estudados. Com base nisso, esse trabalho pretende estudar, via química computacional, como que a glucosamina interage com o ácido acético e com o íon acetato, uma vez que, devido o ácido acético possui baixa constante de acidez (pKa), a glucosamina terá contato com as duas espécies em um laboratório experimental.
Material e métodos
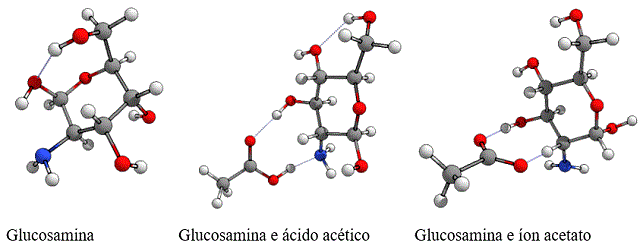
Para estudar a interação entre a glucosamina, e ácido acético e o íon acetato, foram modeladas com o software Avogadro os sistemas com a glucosamina, glucosamina com ácido acético e glucosamina com íon acetato. Após análise conformacional realizada com o software GFN2-xTB, as moléculas foram submetidas à otimização geométrica e posteriormente ao cálculo de single point com o auxílio do ORCA 4.2.1, utilizando o funcional híbrido wB97X-D3, função de base def2-SVP e base auxiliar def2/J. Para visualizar os resultados gráficos foram utilizados os softwares Chemcraft e Mocalc. Os orbitais HOMO e LUMO foram obtidos através do cálculo de single point realizado com o software ORCA 4.2.1. Foi utilizado para todos os sistemas o funcional híbrido Wb97-D3, conjunto de base def2-SVP e base auxiliar Def2/J. Os orbitais localizados servem para termos a visão de onde a molécula receberá ataques eletrofílicos e nucleofílicos e são baseados nos orbitais HOMO e LUMO. Para obter os orbitais localizados dos sistemas, o arquivo de output do cálculo de single point foi aberto no software MoCalc e foi solicitado a plotagem gráfica dos mapas. Os mapas de interações não-covalentes foram obtidos abrindo o arquivo de output de cálculo de single point no software MoCalc e solicitando que o programa plotasse o mapa NCI. Os diagramas de energia molecular para descobrir a reatividade dos sistemas através do GAP dos orbitais HOMO e LUMO foram obtidos através dos cálculos de single point realizados no software ORCA 4.2.1 e os resultados foram lidos no software Chemcraft. Ao fim, o espectro computacional infravermelho da glucosamina foi comparado com espectro experimental de (GUIMARÃES et al., 2020) para validar o estudo.
Resultado e discussão
As geometrias foram otimizadas e os cálculos convergiram com sucesso. Os
comprimentos de ligação, assim como ângulos de ligação e torsão da glucosamina
nos três sistemas estudados se mostraram praticamente iguais após a otimização
geométrica, mesmo quando a glucosamina interagiu com o ácido acético e o íon
acetado. Essa avaliação foi feita observando os comprimentos e ângulos de
ligação entre cada átomo da glucosamina nos sistemas, onde a variação entre
essas informações foi insignificante.
Os orbitais HOMO e LUMO foram obtidos através do cálculo de single point
realizado com o software ORCA 4.2.1. Foi utilizado para todos os sistemas o
funcional híbrido Wb97-D3, conjunto de base def2-SVP e base auxiliar Def2/J.
Os resultados gráficos foram observados com o auxílio do software Chemcraft,
tendo em vista que em vermelho é o orbital ligante e em azul temos o orbital
antiligante.
Foi possível observar no sistema somente com a glucosamina que o orbital
molecular HOMO ocupa quase todo o volume da molécula, enquanto o orbital LUMO
possui sua área restrita a um local da molécula. Devido o orbital LUMO ter uma
região com alta densidade do orbital antiligante sobre os hidrogênios, isso
faz com que o local fique instável, fazendo com que o próximo elétron queira
ocupar outro local mais estável, ou seja, próximo do grupo amina.
No sistema com a glucosamina e o ácido acético é possível visualizar que o
orbital HOMO está localizado no grupo amina, enquanto o orbital LUMO está
localizado sobre o ácido acético. Já no sistema com a glucosamina e o íon
acetato, o orbital HOMO está presente em torno do grupo amina e do íon
acetato, enquanto o orbital LUMO está localizado sobre a amina e a hidroxila.
Devido ao orbital antiligante LUMO estar em cima da hidroxila, é provável que
a região mais estável para receber um elétron seja a do grupo amina.
O mapa de suscetibilidade eletrofílica da glucosamina mostra que espécies
pobres em elétrons vão atacar a hidroxila da glucosamina, enquanto espécies
ricas em elétrons terão preferência em atacar o grupo amina. As zonas mais
azuis indicam maior intensidade da molécula ser atacada.
O mapa de suscetibilidade eletrofílica da glucosamina com o ácido acético
permite observar que um eletrófilo irá atacar o oxigênio do acetato presente
na glucosamina. Por outro lado, o ácido acético será atacado por um
nucleófilo. O mapa de suscetibilidade eletrofílica da glucosamina com o íon
acetato mostra que o grupo amina será atacado por espécies pobres em elétrons,
enquanto o hidrogênio ligado a hidroxila será atacado por espécies
nucleofílicas.
No mapa NCI (Interações não-covalentes) da glucosamina, é possível observar
que no centro da molécula ocorrem interações repulsivas, o que explica o
motivo pela qual as outras espécies químicas interagem com os átomos mais
externos da molécula. No sistema com a glucosamina e o ácido, é possível
observar que o ácido acético interage com a glucosamina através de ligação de
hidrogênio nas extremidades do grupo amina e da hidroxila. As forças
repulsivas também são observadas no centro da molécula. O mapa NCI da
glucosamina com o íon acetato mostra o íon interagindo com a glucosamina
através de ligação de hidrogênio com a hidroxila e com o hidrogênio próximo ao
grupo amina. Na interação entre o íon acetato e a glucosamina também é
possível observar interações de Van der Waals. As forças repulsivas estão
presentes no centro da molécula.
Nos sistemas em que a glucosamina interage com o ácido acético e o íon
acetato, ambas espécies interagem com a glucosamina também através de
interações de Van der Waals, contudo, a interação da glucosamina com o íon
acetato é mais forte pois o íon está mais próximo da glucosamina por não ter o
oxigênio na extremidade próxima da interação.
O HOMO-LUMO GAP que nos mostra a reatividade do sistema mostrou que, a
glucosamina, a glucosamina com ácido acético e glucosamina com íon acetato
possuem GAP de 10.704 eV, 10.416 eV e 8.062 eV, respectivamente.
A fim de validar o estudo, foi comparado o espectro infravermelho
computacional da glucosamina com o espectro experimental de um estudo
realizado com o intuito de observar as propriedades físico-químicas da
quitosana nanocristalina (glucosamina), onde as substâncias foram submetidas
ao ensaio de FTIR (Infravermelho por Transformada de Fourier) a fim de
confirmar suas estruturas.
Em primeiro instante, de modo visual com o espectro IR computacional, e
através de um ajuste manual com o software SpectraGryph, foi gerada a correção
do gráfico computacional, com fator de correção de 0,77 obtido através da
correlação de Pearson.

Conclusões
Os sistemas estudados foram submetidos a cálculos de química computacional para comparar suas estruturas e observar as mudanças que acontecem quando a molécula de glucosamina é exposta ao ácido acético protonado e desprotonado em solvatação explícita. A escolha por utilizar o ácido acético e o íon acetato ocorre devido à espécie ácida possuir baixo pKa, não ionizando-se por completo. Com a otimização geométrica, foi possível notar que as estruturas da glucosamina tiveram pouca variação em sua geometria, uma vez que os comprimentos e ângulos das ligações tiveram alterações insignificantes. O HOMO-LUMO GAP das moléculas mostrou que o sistema da glucosamina e o íon acetato são mais instáveis quando comparados a outros sistemas, o que sugere que, experimentalmente, é mais viável realizar uma reação química quando o ácido acético foi ionizado. Em todos os sistemas, o centro da molécula de glucosamina tem repulsão estérica e as moléculas de ácido interagem com a glucosamina por meio de ligações de hidrogênio. Além disso, as espécies solventes interagem com a glucosamina também através de interação de Van Der Waals. A comparação entre os espectros infravermelhos computacionais e experimentais da glucosamina validaram o estudo desse trabalho, uma vez que os possuem padrão semelhantes e fator de correção de 0,77 para o espectro da glucosamina. Por fim, esse trabalho se mostrou útil, uma vez que com esse estudo, é possível de fato saber o que ocorre em laboratório quando manipulamos a glucosamina com os solventes ácido acético e íon acetato, tornando mais rico o conhecimento de quem estuda as propriedades da molécula.
Agradecimentos
Referências
ATTIA, Mohamed S. et al. Impact of Foliar Application of Chitosan Dissolved in Different Organic Acids on Isozymes, Protein Patterns and Physio-Biochemical Characteristics of Tomato Grown under Salinity Stress. Plants, v. 10, n. 2, p. 388, 18 fev. 2021. Disponível em: <https://www.mdpi.com/2223-7747/10/2/388>.
CAMARGO, L T F M ;; CAMARGO, A J. Estudos Teóricos Sobre a Glucosamina: Uma Revisão Sistemática Theoretical Studies on the Glucosamine: A Systematic Review. Rev. Virtual Quim, n. 6, p. 1835–1852, 2019. Disponível em: <http://rvq.sbq.org.br>.
GOH, Garrett B.; HODAS, Nathan O.; VISHNU, Abhinav. Deep learning for computational chemistry. Journal of Computational Chemistry, v. 38, n. 16, p. 1291–1307, 15 jun. 2017. Disponível em: <http://doi.wiley.com/10.1002/jcc.24764>.
GUIMARÃES, M. F. et al. Chemical and physical properties of nanocrystalline chitosan by the method: Modified nanochitosan complex and process of obtaining modified nanochitosan. Carbohydrate Research, v. 493, p. 108035, 1 jul. 2020.
MCARDLE, Sam et al. Quantum computational chemistry. Reviews of Modern Physics, v. 92, n. 1, p. 15003, 2020. Disponível em: <https://doi.org/10.1103/RevModPhys.92.015003>.
RODYGIN, K. S.; VORONIN, V. V.; LEDOVSKAYA, M. S. Synthesis of glucosamine vinyl ether derivative and its deuterated analog. Russian Chemical Bulletin, v. 69, n. 7, p. 1401–1404, 1 jul. 2020. Disponível em: <https://link.springer.com/article/10.1007/s11172-020-2915-3>.
SOLÀ, Miquel; DE PROFT, Frank; BICKELHAUPT, F. Matthias. Special Collection: Computational Chemistry. ChemistryOpen. [S.l.]: Wiley-VCH Verlag. Disponível em: </pmc/articles/PMC6604232/>.
WEN, Zhao. Application and research progress of glucosamine. 7 jun. 2019, [S.l.]: American Institute of Physics Inc., 7 jun. 2019. p. 020050. Disponível em: <http://aip.scitation.org/doi/abs/10.1063/1.5110844>.
ZHANG, Yu et al. Preparation, Structure and Properties of Acid Aqueous Solution Plasticized Thermoplastic Chitosan. Polymers, v. 11, n. 5, p. 818, 7 maio 2019. Disponível em: <https://www.mdpi.com/2073-4360/11/5/818>.


