Estudos in silico do Complexo Inorgânico [Zn(AT)2](CH3COO)2, onde AT = Ácido Tânico.
- Home
- Trabalhos
ÁREA
Química Inorgânica
Autores
Braga, J.L. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Almeida, B.N. (UNIVERSIDADE ESTADUAL DE CAMPINAS- UNICAMP) ; Silva, W.M.B. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Alves, D.R. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Marinho, M.M. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Morais, S.M. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Marinho, E.S. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Pinheiro, S.O. (UNIVERSIDADE ESTADUAL DO CEARÁ)
RESUMO
O Ácido Tânico (AT) é uma substância fenólica que apresenta atividades farmacológicas. O íon zinco (Zn2+) é encontrado em todas as formas de vida. O complexo formado [Zn(AT)2](CH3COO)2 foi sintetizado utilizando uma proporção de 2:1 do ligante ácido tânico e o sal Zn(CH3COO)2, respectivamente. A caracterização foi realizada por espectroscopia na região do ultravioleta e visível (UV-Vis) e na região do infravermelho (IV). A coordenação do ácido tânico ao íon Zn2+ se deu de forma bidentada por grupamentos fenólicos. Os estudos in silico, as propriedades moleculares sugerem o complexo [Zn(AT)2](CH3COO)2 como molécula grande, lipofílica e polar para ser fármaco de via oral e cutânea, sendo necessária a avaliação deste composto em testes in vitro e in vivo como outras formas de administração.
Palavras Chaves
Ácido Tânico; Zinco; Complexo Inorgânico
Introdução
O ácido tânico (AT) é usado como matéria prima para a produção de ácido gálico a partir de sua hidrólise, que por sua vez, o ácido gálico é utilizado como matéria prima de conservantes alimentares, medicamentos antimicrobianos, além de exercer atividade antioxidante e também apresenta a capacidade citotóxica contra células cancerígenas sem prejudicar as células normais (BAJPAI; PATIL, 2008). O ácido tânico é capaz de produzir distintos efeitos farmacológico tanto em in vitro que possui atividade anticoagulante, como em in vivo que não modifica a fragilidade das hemácias ou na homeostase sanguínea (MEDEIROS et al., 1988). Pesquisadores perceberam que o ácido tânico, os taninos, são ótimos para atividades anticorrosivas e fácil de se complexar com metais de transições, pois age como revestimentos anticorrosivos e são altamente confiáveis (CASTRO; RODRÍGUEZ, 2012). Outro aspecto importante do ácido tânico é que atua como um ligante quando complexado a metais de transição, estudos apontam por conta de sua estabilidade e propriedades farmacológica, demonstra resultados importantes na medicina tradicional, além de proporcionar uma rápida cicatrização de queimadura, como também evitar a infecção dos ferimentos (PANSERA et al., 2003). A molécula do ácido tânico é principalmente formada por compostos fenólicos, cujo estudos demonstram a eficiência e aplicações dos compostos fenólicos em tratamento de doenças cardiovasculares, assim como a proteção dos tecidos a partir de sua atividade antioxidante (ARAÚJO et al., 2013). O íon zinco é um dos íons mais importante e essenciais encontrado em todas formas de vida, pois está envolvido em atividades regulatória dentro do corpo que inclui o crescimento e desenvolvimento no corpo, cérebro e expressões génicas. O íon zinco desempenha papel vital e previne muitas doenças como por exemplo, cânceres, pneumonia e malária (REHMAN; IKRAM; SUBHAN, 2015).O íon em sua forma Zn2+, desempenha diversos fatores biológicos junto a compostos orgânicos, na formação de complexos, atua como anticancerígenos e antidiabéticos (VILLENA; SOTA; RIGHI, 2012). O objetivo deste trabalho tem como fundamento os estudos in silico do complexo [Zn(AT)2](CH3COO)2 conforme a prospecção da síntese e caracterização do complexo.
Material e métodos
Para a elaboração deste trabalho, foram utilizados na síntese do complexo, o sal acetato de zinco (II) diidratado, Zn(CH3COO)2.2H2O (MERCK) e o ligante ácido tânico (VETEC), os solventes utilizados foram dimetilsulfóxido (DMSO), trietilamina (MERCK) e água destilada. Na preparação do complexo [Zn(AT)2](CH3COO)2 foi dissolvido 0,03 g de acetato de zinco (II) em 10 mL de água e adicionado a uma solução de ácido tânico 0,464 g dissolvido em água sob agitação por 15 minutos, após, adicionou-se 3 gotas de trietilamina onde manteve-se sob agitação por 3 horas. Ao fim da reação ocorreu a formação do sal complexo. O complexo [Zn(AT)2](CH3COO)2 foi filtrado em funil de placa porosa e estocado em dessecador. Foi realizado teste de solubilidade do composto em solventes diferentes (água destilada, metanol, diclorometano, etanol, éter e dimetilsulfóxido). Para a caracterização do complexo, foi utilizado o espectrofotômetro (SHIMADZU UV-1800), e o composto em solução de DMSO em concentração de 1x10-3 mol/L, na faixa de estudo de 200 a 790 nm de comprimento de onda. Os espectros vibracionais na região do infravermelho (FT-IR) foram obtidos utilizando um espectrofotômetro de modelo (NICOLET iS5) da Thermo Scientific. As amostras foram preparadas na forma de partilhas de KBr na proporção de 1:20 (m/m) (amostra:KBr) e os espectros registrados no intervalo de 4000 a 400 cm-1, empregando-se 32 scans e resolução de 4 cm- 1.Para os estudos in silico, a estrutura bidimensional do complexo [Zn(AT)2](CH3COO)2 foi desenhado no software MarvinSketch version 21.12, ChemAxon (https://chemaxon.com/products/marvin) para ser exportado em formato SDF e código SMILES para os servidores PreADMET (https://preadmet.bmdrc.kr/adme/) e pkCSM (http://biosig.unimelb.edu.au/pkcsm/) para cálculo dos descritores moleculares de tamanho (MW), lipofilicidade (AlogP) e polaridade (TPSA), aplicados aos critérios de CNS MPO (Central Nervous System Multiparameter Optimization) da Pfizer (WAGER et al., 2016), bem como para estimativa dos parâmetros farmacocinéticos de permeabilidade aparente (Papp) e volume de distribuição (VD). Para condução da triagem virtual de bioatividade, o composto foi submetido ao teste de similaridade dos compostos 2D do conjunto de dados da ChEMBL, embutido no servidor online SwissTargetPrediction (http://www.swisstargetprediction.ch/) para a previsão da probabilidade de modulação da atividade de classes de alvos biológicos humanos. As contribuições estruturais para os end-points de toxicidade foram avaliados pelos modelos de QSAR (Quantitative Structure-Activity Relationship) dos servidores Pred-hERG 4.2 (http://predherg.labmol.com.br/) e eMolTox (http://xundrug.cn/moltox), em predição consensual com os modelos de toxicidade do servidor pkCSM (http://biosig.unimelb.edu.au/pkcsm/), para estimativa dos efeitos tóxicos por administração oral do complexo [Zn(AT)2](CH3COO)2.
Resultado e discussão
Síntese do Complexo: Durante os 15 minutos de síntese do composto [Zn(AT)2](CH3COO)2, a solução apresentou uma
coloração alaranjada devido à presença do ligante ácido tânico, contudo, após a adição de trietilamina o composto
passou a ter uma coloração branca leitosa e se manteve até o final da reação. O complexo formado não foi solúvel
nos solventes como a água destilada, metanol, diclorometano, etanol e éter, entretanto, completamente solúvel em
dimetilsulfóxido (DMSO). Caracterização do Complexo- Espectroscopia Região do Ultravioleta e Visível (Uv-vis): A
mudança de cor durante a síntese do complexo demonstra que a coordenação se processou após a adição da base
trietilamina. De acordo com os dados da espectroscopia eletrônica na região do ultravioleta e visível, observaram-
se duas bandas no espectro do ligante ácido tânico livre de coordenação, em 212 e 276 nm. No espectro do sal
Zn(CH3COO)2 observou-se apenas duas bandas 284 e 345 nm. Para o complexo formado, as bandas de absorção foram
observadas nos comprimentos 245 e 284 nm o que demostra uma alteração significativa em comparação com os
precursores, indicativo de mudança eletrônica após a coordenação. Espectroscopia Vibracional na Região do
Infravermelho (IV): Os dados obtidos pela espectroscopia na região do infravermelho, mostraram um deslocamento
para uma região maior correspondente ao νO-H, de 3396 cm-1 observado no ligante livre de coordenação para 3403 cm-
1 no complexo, sugerindo a coordenação pelos grupamentos fenólicos, de forma bidentanda. A coordenação também não
influenciou o deslocamento do νC=O (carbonila) de 1710 cm-1 observada no ligante ácido tânico livre de coordenação
para 1712 cm-1 no complexo, esses dados demostram a coordenação não se deu pelo grupamento da carbonila. Na região
entre 1034 a 654 cm-1 observada no espectro vibracional na região do infravermelho do ácido tânico, observa-se os
estiramentos das ligações νC-Csp2 dos anéis aromáticos, na mesma região observada no complexo [Zn(AT)2](CH3COO)2
houve deslocamentos para 1037 a 760 cm-1. Tomando-se por base estes resultados, sugeriu-se a estrutura do complexo
conforme a Figura 01. Estudos in silico: Os filtros de drug-likeness para análise do espaço físico-químico
favorável aos atributos de absorção, distribuição, metabolismo e excreção (ADME), como: alta permeabilidade, baixo
efluxo passivo e baixa depuração metabólica, bem como os critérios de segurança de administração oral, têm sido
aperfeiçoados para aumentar a eficiência na descoberta de novos medicamentos nos últimos anos (WAGER et al.,
2010a, 2010b). A técnica de Central Nervous System Multiparameter Optimization (CNS MPO), ou simplesmente regra da
Pfizer, resultou em um progresso significativo no processo de disponibilidade de compostos dentro do espectro
favorável e de baixo risco (baixo logP e alto TPSA) (WAGER et al., 2016). Com molecular weight avaliado em 3463,77
Da, o complexo complexo [Zn(AT)2](CH3COO)2, com predominância de subunidades de catechol and esters goups, está
distante do valor médio definido pelo conjunto de drug candidates da Pfizer (MW = 360,4 Da) e, portanto, é
relativamente maior do que o ideal definido pelo filtro da CNS MPO (WAGER et al., 2016). Este valor evidencia que
a substância está fora do espaço físico-químico de tamanho molecular esperado para uma boa permeabilidade e
difusão através das diversas membranas biológicas. Compostos com baixo logP e alto TPSA possuem uma tendência
físico-química a serem mais limpos do que tóxicos, enquanto a análise inversa consiste em compostos mais tóxicos
do que limpos, ou seja, com alto logP e baixo TPSA (HUGHES et al., 2008). O gráfico da Figura 02(A) mostra que a
substância [Zn(AT)2](CH3COO)2 está distante da região abundante de drogas, drug candidates and CNS drug candidates
da Pfizer, sugerindo que a substância pode não atender aos atributos de ADME: alta permeabilidade, baixo risco de
efluxo passivo e baixa depuração metabólica. Contudo, as proporções que regem os parâmetros de baixo logP relativo
(10.22) a alto TPSA (1511.96 Ų), com o somatório das superfícies polares formadas pelas hidroxilas das
subunidades de catechol e dos grupos esters, sugere que a substância, apesar de pouco biodisponível, has been
passed in the Pfizer rule, o que significa que apresenta baixo risco tóxico (WAGER et al., 2016). Os parâmetros
farmacocinéticos que relacionam os descritores moleculares abordados com permeabilidade e volume de distribuição
sistêmica foram obtidos do teste consensual dos valores in vitro de permeabilidade aparente (Papp) dos modelos
celulares de adenocarcinoma colorretal (Caco-2) e células renais caninas Madin-Darby (MDCK) do servidor online
PreADMET, bem como o conjunto de dados in vitro de volume de distribuição (VD) e coeficiente do produto
permeability-surface area (logPS) do servidor online pkCSM. Os modelos in vitro de células Caco-2 e MDCK têm sido
aperfeiçoado ao longo dos anos para facilitar o processo de decoberta de novas drogas. A otimização dos
coeficientes de Papp (in 10⁻⁶ cm/s) para estes modelos celulares são fundamentais na estimativa da permeabilidade
intestinal passiva e acesso ao CNS pela permeabilidade na barreira hematoecefálica. Em estudos, valores de Papp >
10×10⁻⁶ cm/s do modelo Caco-2 cells estão associados a substâncias com alta permeabilidade intestinal passiva,
enquanto valores de Papp > 3.0×10⁻⁶ cm/s do modelo MDCK cells garantem o acesso de uma substância ao CNS (SEVIN et
al., 2013; WANG et al., 2005). Evidências mostram que a subunidade de TA possui atividade terapêutica baseada em
uma biodisponibilidade oral limitada devido ao seu grande tamanho e alto grau de afinidade com as proteínas
plasmáticas, atuando localmente no epitélio intestinal (LE et al., 2018). O valor estimado de Papp Caco-2 na ordem
de 4,52×10⁻⁷ cm/s indica uma baixa permeabilidade em células intestinais do [Zn(AT)2](CH3COO)2, o que resulta em
uma limitação no volume de distribuição da substância na circulação sistêmica, em uma ordem de concentração de
0,01 L/kg. Além disso, a substância é substrato da P-glycoprotein (P-gp), o que significa que a fração absorvida
sofre efluxo de volta para o fluido do trato gastrointestinal. Desta forma, o valor estimado de Papp MDCK na ordem
de 1,80×10⁻⁹ cm/s reflete a incapacidade do complexo de penetrar a BBB, ao mesmo tempo em que o logPS de -16,51
sugere a superfície polar é uma propriedade limitante da sua permeabilidade, com concentração (Cbrain/Cblood) de
apenas 0.03 em função da sua alta afinidade com proteínas plasmáticas (100%). Os resultados percentuais da
atividade moduladora da [Zn(AT)2](CH3COO)2 por classes de alvos biológicos humanos é mostrada na Figura 02(B).
Nesta predição, foi possível observar uma estimativa de 26,7% das interações do complexo [Zn(AT)2](CH3COO)2 com
enzimas, nas quais foram detectadas padrões de similaridade com 8 compostos do conjunto de dados da ChEMBL com
atividade inibidora das enzimas Squalene monooxygenase (SQLE) e 2 compostos com atividade inibidora da Aldose
reductase (AKR1B1). A substância também é constituída de 13,3% de sua atividade moduladora de proteases, onde foi
possível detectar 3 compostos similares com atividade inibidora de Beta-secretase 1 (BACE1) e 3 compostos com
atividade inibidora de Thrombin and coagulation factor X (F10) do conjunto de dados da ChEMBL. Com os resultados
mostrados na Figura 02(C), é possível observar que as subunidades de digallic acid da estrutura do TA apresentam
contribuições negativas para o hERG blockage associadas aos fragmentos moleculares de catechol e os diversos
esters groups, assim como previsto no teste consensual dos servidores eMolTox e pkCSM, com forte contribuição dos
grupos carbonilas. Apesar das contribuições positivas dos carbonos dos polifenóis e dos fragmentos de glicose, a
unidade de TA pode apresentar risco cardiotóxico, avaliado em fraco ou moderado, com grau de confiabilidade de 60%
(Figura 02(C)).

Representação estrutural do complexo [Zn(AT)2] (CH3COO)2. Fonte: Próprios autores.
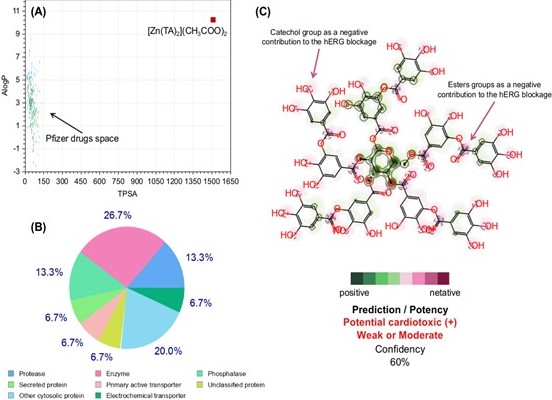
Estudos in silico. Fonte: Próprios autores.
Conclusões
De acordo com os resultados descritos nesse trabalho, houve coordenação da molécula ácido tânico ao centro metálico do íon Zn2+ de forma bidentada pelos grupamentos fenólicos. Nos estudos in silico, a substância é pouco permeável em células intestinais, resultando em um decréscimo em sua biodisponibilidade devido ao seu grande tamanho e alta afinidade com proteínas plasmáticas, constituindo um potencial agente terapêutico local com baixo risco toxicológico humano.
Agradecimentos
Laboratório de Química de Produtos Naturais (LQPN), Laboratório de Química Inorgânica (LQUIN), Universidade Estadual do Ceará (UECE).
Referências
ARAÚJO, A. A.; SILVA, T. M.; VILLELA, M. L. P.; ALCÂNTARA, A. F. C.; PINTO, N. A. V. D. Total antioxidant capacity, total phenolic content and mineral elements in the fruit peel of Myrciaria cauliflora. Braz. J. Food Technol, Campinas, v. 16, n. 4, p. 301-309, 2013.
BAJPAI, B.; PATIL, S. A New Approach to Microbial Production of Gallic Acid. Brazilian Journal of Microbiology, v. 39, p. 708-711, 2008.
CASTRO, M. A. P.; RODRÍGUEZ, H. G. Study by Infraed Spectroscopy and Thermogravimetric Analysis of Tannins and Tannic Acid. Rev. Latinoamer, Quím., v. 39, n. 3, 2001.
HUGHES, J. D. et al. Physiochemical drug properties associated with in vivo toxicological outcomes. Bioorganic and Medicinal Chemistry Letters, v. 18, n. 17, p. 4872–4875, 2008.
LE, Z. et al. Hydrogen-Bonded Tannic Acid-Based Anticancer Nanoparticle for Enhancement of Oral Chemotherapy. ACS applied materials & interfaces, v. 10, n. 49, p. 42186–42197, 2018.
MEDEIROS, Y. S.; MORATO, G. S.; MOTATO, E. F.; VALLE, R. M. R.; LIMA, T. C. M.; RAE, G, A.; CALIXTO, J, B. Ações Farmacológicas do Ácido Tânico. Análises em Outros Modelos Experimentais, v. 1, p.157-170, 1988.
PANSERA, M. R.; SANTOS, A. C. A.; PAESE, K.; WASU, R.; ROSSATO, M.; ROTA, L, D.; PAULETTI, G, F.; SERAFINI, L, A. Análise de Taninos Totais em Plantas Aromáticas e Medicinais Cultivadas no Rio Grande do Sul. Rev. Bras. Farmacogn, v.13, n.1, 2003.
REHMAN, S.; IKRAM, M.; SUBHAN, F. Synthesis of New Dicoumarol Based Zinc Compounds and their Invitro Antimicrobial Studies. J. Mex. Chem. Soc., v. 59, n. 2, p. 137-142, 2015.
SEVIN, E. et al. Accelerated Caco-2 cell permeability model for drug discovery. Journal of Pharmacological and Toxicological Methods, v. 68, n. 3, p. 334–339, 2013.
VILLENA, Z. M.; De La SOTA, N. A.; RIGORIGHI, C. G.; Zinc complexes as potential antidiabetic metallopharmaceuticals: recent advances in its development and molecular mechanism of action. Rev. Soc. Quím. Perú, v. 78, n. 4, p. 277-295, 2012.
WAGER, T. T. et al. Central Nervous System Multiparameter Optimization Desirability: Application in Drug Discovery. ACS Chemical Neuroscience, v. 7, n. 6, p. 767–775, 2016.
WAGER, T. T. et al. Defining desirable central nervous system drug space through the alignment of molecular properties, in vitro ADME, and safety attributes. ACS Chemical Neuroscience, v. 1, n. 6, p. 420–434, 2010b.
WAGER, T. T. et al. Moving beyond rules: The development of a central nervous system multiparameter optimization (CNS MPO) approach to enable alignment of druglike properties. ACS Chemical Neuroscience, v. 1, n. 6, p. 435–449, 2010a.
WANG, Q. et al. Evaluation of the MDR-MDCK cell line as a permeability screen for the blood-brain barrier. International Journal of Pharmaceutics, v. 288, n. 2, p. 349–359, 2005.


