Síntese hidrotérmica alcalina de materiais à base de Titânio aplicados na remoção de corantes
- Home
- Trabalhos
ÁREA
Química de Materiais
Autores
R. S. Barbosa, L. (INSTITUTO DE CIÊNCIAS E TECNOLOGIA, UFVJM) ; P. Cota, V.E. (INSTITUTO DE CIÊNCIAS E TECNOLOGIA, UFVJM) ; J. Martins, N. (PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA, UFVJM) ; S. Rodrigues, P.N. (PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA, UFVJM) ; Malagutti, A.R. (DEPARTAMENTO DE FARMÁCIA (DEFAR), UFVJM) ; J. L. Mourão, H.A. (PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA, UFVJM)
RESUMO
Este estudo investigou a propriedade fotocatalítica e de adsorção de materiais à base de Ti sintetizados pelo método hidrotérmico alcalino, em diferentes concentrações de hidróxido de potássio KOH (10^-5 e 10^-2, 1 e 5 mol/L). Os materiais sintetizados foram aplicados na remoção de corantes com diferentes características, o azul de metileno (MB) e índigo de carmim (IC). As caracterizações realizadas indicaram a formação de titanatos de potássio para os materiais sintetizados em soluções mais alcalinas (1 e 5 mol/L) e TiO2 anatase nas soluções menos concentradas (10^-5 e 10^-2 mol/L). Os materiais caracterizados como titanatos de potássio apresentaram maior desempenho na adsorção de corantes, assim como no processo fotocatalítico.
Palavras Chaves
Titanatos; Síntese hidrotérmica; Fotocatálise
Introdução
Os corantes descartados no meio aquático de forma incorreta acarretam diversos problemas à fauna e flora local, consequentemente atingindo as atividades humanas e os recursos naturais. Devido a própria característica dessas moléculas de colorir, pequenas quantidades de corante podem mudar a coloração de rios (GUARATINI; ZANONI, 1999). A mudança da coloração das águas dificulta a penetração da luz solar na água, impedindo que os processos fotossintéticos dos organismos vivos ocorram de maneira adequada, consequentemente, há diminuição dos níveis de oxigênio na água, diminuindo sua qualidade, visto que além do efeito da coloração, alguns corantes, são tóxicos e mutagênicos (LALNUNHLIMI; KRISHNASWAMY, 2016). Essas moléculas apresentam estruturas orgânicas complexas e estáveis o que dificulta sua remoção por métodos tradicionais de tratamento de efluentes. Neste sentido, é necessário o desenvolvimento de materiais e/ou tecnologia que consigam remover e mineralizar micropoluentes como os corantes do meio ambiente. Alguns materiais apresentam a capacidade de remover poluentes através do processo físico-químico de adsorção superficial. Nesse processo as moléculas dispersas no meio (liquido ou gás) são atraídas pelo material adsorvente e ficam retidas por ligações ou interações na superfície do sólido removendo assim o poluente do efluente. Além da adsorção do poluente é necessário fazer a disposição final deste, e a fotocatálise heterogênea como processo oxidativo avançado já se mostrou eficiente na mineralização de diversas moléculas orgânicas. Essa tecnologia é baseada na absorção de fótons que viabilizam a geração de portadores de cargas (como radicais) formando espécies químicas altamente reativas que promovem a fotodegradação. Uma característica comum do adsorvente e do fotocatalisador é a influência da área superficial na eficiência de ambos os processos. Assim, se faz necessário o desenvolvimento de materiais que permitam a combinação das duas técnicas no tratamento dos efluentes contaminados com corantes e outros poluentes (MOURÃO et al., 2009). O dióxido de titânio (TiO2) é um dos materiais mais aplicados em fotocatálise na literatura devido a sua alta atividade fotocatalítica sob luz ultravioleta (UV) (NOGUEIRA e JARDIM, 1998). E similar a esse semicondutor tem se destacado os titanatos lamelares, que são um exemplo de material à base de Ti que podem ser aplicados em processos fotocatalíticos. Esses materiais costumam apresentar área superficial especifica maior que a do semicondutor TiO2 na fase anatase. Normalmente esses materiais apresentam forma molecular M2TinO2n+1, onde 2 ≤ n ≤ 8 e M pode ser um metal como sódio (Na), lítio (Li) e potássio (K) ou, também, pelo hidrogênio (H) (CHIBA, KIJIMA, et al., 2008; CATTI, PINUS e SCHERILLO, 2013). E na literatura já foram relatadas que as propriedades desses materiais tem relação direta com a metodologia de síntese empregada e dentre os metódos já citados temos a anodização e o hidrotérmico que é o método investigado neste trabalho. (MACAK, TSUCHIYA, et al., 2007; DAWSON, CHEN, et al., 2010). Diante do exposto temos que neste trabalho foi realizada a síntese de materiais à base de Ti pelo método hidrotérmico alcalino variando-se a concentração do hidróxido de potássio (KOH). Os materiais sintetizados foram caracterizados quanto sua estrutura cristalina, por espectroscopia de infra-vermelho e aplicados na remoção dos corantes azul de metileno (MB) e índigo de carmim (IC) em solução aquosa. Foram avaliadas tanto a capacidade adsortiva quanto a ativiadade fotocatalítica sob radiação UV dos materais sintetizados na remoção e degradação desses corantes.
Material e métodos
A metodologia deste trabalho consistiu na obtenção de materiais à base de Ti por método hidrotérmico utilizando o isopropóxido de Ti (C12H28O4Ti, 97 %, Sigma- Aldric) como reagente percursor em solução alcalina de KOH (CRQ) com diferentes concentrações (10^-5, 10^-2, 1 e 5 mol/L). Desta forma, quatro amostras foram preparadas: AM1 (10^-5 mol/L), AM2 (10^-2 mol/L), AM3 (1 mol/L) e AM4 (5 mol/L). Para cada amostra foram utilizados 500 mg de C12H28O4Ti em pó hidrolisado e 80 mL de solução de KOH nas diferentes concentrações. Os reagentes foram adicionados em uma autoclave de teflon e submetidos ao tratamento hidrotérmico a 200 °C por 2 horas. Após o tratamento o precipitado foi centrifugado, lavado com água deionizada e álcool isopropílico (C3H8O, Ls Chemicals) e seco a aproximadamente 75°C obtendo-se então um pó fino. Os pós obtidos foram caracterizados pelas técnicas de difração de raios-X (DRX), espectroscopia de infravermelho com transformada de Fourier (FTIR) e Fluorescência de raios X por energia dispersiva (EDX-RS). As medidas de DRX foram realizadas em um difratômetro Shimadzu XRD 6000 (radiação Cu-K α) disponível no laboratório GEQAm da UFVJM, as fases dos difratogramas foram identificadas no software Search-Match. Os espectros FTIR foram realizados pelo método ATR na faixa de 400 a 4000 cm-1 utilizando o espectrômetro da marca VARIAN (640 IR), modelo GLAD ATR disponível no laboratório multiusuário do CPPTEQ. A composição elementar de metais (Ti e K) das amostras foi realizada no Equipamento EDX-720 SHIMADZU, disponível no laboratório LIPEMVALE da UFVJM. A capacidade adsortiva e a fotoatividade das amostras foram avaliadas nos ensaios com os corantes MB e IC e a concentração dos corantes foram monitoradas utilizando-se o espectrofotômetro da marca Shimadzu, modelo UV 6300PC Double Beam, no DeFar/UFVJM. O teste de adsorção foi conduzido no escuro em diferentes tempos até que a o sistema atingisse o equilíbrio. As isotermas de adsorção foram montadas para os dois corantes de natureza distinta sendo um deles catiônico (MB) e o outro aniônico (IC). Cada amostra foi testada separadamente com uma solução contendo o corante MB (10 mg/L) e outra contendo o IC (30 mg/L). Foi adicionado 10 mg das amostras (AM1, AM2, AM3 e AM4) em um béquer contendo 20 mL de solução de corante. Em seguida foram analisadas as concentrações do corante por espectrofotometria por método direto em uma sequência de intervalos de tempos até que o equilibro de adsorção fosse alcançado. O teste de fotodegradação foi realizado sob luz UV utilizando seis lâmpadas UVC (PHILIPS, 5W máximo de emissão a 254 nm). Neste teste também foi preparado béqueres contendo 10 mg de cada amostra com 20 mL de solução de corante MB ou IC. Essa solução permaneceu em repouso no escuro por aproximadamente 12 horas para que atingisse o equilíbrio e posteriormente se iniciou o teste. A concentração do corante foi monitorada por espectroscopia UV-Vis nos intervalos de tempos de 15, 30, 60, 120 min.
Resultado e discussão
As amostras sintetizadas foram caracterizadas por DRX visando à identificação
das fases formadas. Os difratogramas (a) e (b), indicam que houve a formação de
TiO2 anatase (Ficha 4-477) conforme indicados pelos picos de difração nas
posições 2θ = 25°, 37°, 48°, 55°, 62°, 68°, 70° e 75°. Por outro lado, o aumento
da concentração da base na síntese provocou alterações nas estruturas
cristalinas dos materiais sintetizados e essas alterações foram observadas nos
difratogramas (c, 1 mol/L) e (d, 5 mol/L). Através dessa técnica é possível
inferir uma possível formação de titanato de potássio lamelar visto que o pico
alargado em aproximadamente 10° (identificado por *) está relacionado à difração
entre as lamelas (MORGAN et al., 2008). O perfil dos picos sugere provavelmente
a formação do titanato K2Ti8O17 monoclínico (Ficha 41.1100). Já a identificação
dos picos do difratograma (d) é mais difícil especialmente por conta da
intensidade dos picos e do sinal ruído, sendo provável a formação de duas fases
de titanatos, K6Ti4O11 (Ficha 41-491) e K2TiO3 (Ficha 1-1016).
As amostras foram analisadas por EDX-RS para se avaliar o percentual presente
dos elementos Ti e K em cada amostra. A relação de Ti/K na tabela 1 pode
sugerir a formação das fases que foram indicadas pelo DRX. À medida que houve o
aumento da concentração da base durante a síntese ocorreu também a variação dos
teores de K e Ti nas amostras, conforme indicado na análise elementar. Na
concentração de base 10-5 mol/L não foi detectada a presença de K, o que mostra
que em baixas concentrações não há formação de titanatos de potássio e prevalece
a formação do TiO2 anatase. Com o aumento da alcalinidade da solução, é esperado
a formação de materiais lamelares de Ti com um aumento significativo da área
superficial especifica, sendo que normalmente são formado os titanatos de
potássio (KAPUSUZ et al., 2015), conforme já indicado pelo DRX. O aumento das
quantidades de K observado corrobora com esta tendência.
Tabela 1 - Análise elementar de elementos metálicos por EDX-RS
Amostra AM1-K(% m)=0;Ti(%m)=99,649;Outros(% m)=0,351; #Ti/K=*.
Amostra AM2-K(% m)=1,784;Ti(%m)=97,661;Outros(% m)=0,554; #Ti/K=55.
Amostra AM3-K(% m)=25,706;Ti(%m)=73,491;Outros(% m)=0,802; #Ti/K=3.
Amostra AM4-K(% m)=64,271;Ti(%m)=35,322;Outros(% m)=0,407; #Ti/K=0,6.
* Não se aplica
# outros referem-se às possíveis impurezas e/ou metais dentro da faixa de
incerteza da medida. Elementos leves (ex: H, O, N e C) não foram analisados.
Através da espectroscopia na região do infravermelho com transformada de
Fourier, foi possível a identificação dos tipos de ligações e grupos funcionais
presentes nas amostras. Na Figura 1.e nos comprimentos de onda de 450-900 cm-1
estão localizados alguns picos que podem estar associados ao modo de vibração de
alongamento de Ti-O (BURGOS; LANGLET., 1999; HINOJOSA-REYESA et al., 2019). Os
espectros de FTIR indicam a presença de grupos hidroxila (OH) e/ou água nas
amostras AM2, AM3 e AM4, devido à presença da banda larga entre 3000 e 3600 cm-
1(DARZI; MAHJOUB; BAYAT, 2016). Esta faixa larga é atribuída a vibrações
fundamentais de alongamento de diferentes grupos O-H (SANTHIA et al., 2020). Já
foi reportado que os grupos superfície-OH desempenham um papel essencial na
fotodegradação de poluentes orgânicos, especialmente se o radical hidroxila for
a espécie ativa dominante do processo (MOURÃO et al., 2009).
Outros sinais no espectro podem estar relacionados à deformação angular da água
como em 1362 e 1440 cm-1 na amostra AM4 e menos intenso na AM3 (OLIVEIRA et al.,
2019) e em torno de 1645 cm-1 que pode ser associado a vibração de H–O–H por
causa das suas ligações estruturais nos materiais lamelares ou adsorção física
de umidade nas superfícies da amostra (HINOJOSA-REYESA, 2019). Entretanto esse
sinal em 1645 cm-1 já foi associado aos estiramentos do C=C (sinal fraco entre
1680-1620 cm-1) e/ou C=O (sinal forte entre 1850 -1630 cm-1) e considerando a
composição química dos precursores poderiam sugerir resíduos do isopropóxido nos
materiais sintetizados, especialmente para as amostras obtidas a 1 e 5 mol/L de
KOH (BURGOS; LANGLET, 1999). Outros sinais no espectro indicam ligações entre o
elemento carbono, como o sinal em torno de 1362 cm-1 pode estar relacionado com
os estiramentos do C-O ou C-C (sinal de difícil interpretação ao redor de 1200
cm-1) ou ainda ao dobramento C-H (sinal médio ao redor de 1340 cm-1) (PAVIA et
al., 2010). O sinal que aparece em 1060 cm-1 pode indicar a presença de
vibrações do tipo C-O (LI et al., 2017). Isto indica que o aumento da
concentração de base estaria contribuindo para retenção de resíduos do
precursor, provavelmente entre as esperadas estruturas lamelares destes
materiais. No entanto, vale a pena destacar que, embora os sinais estejam em uma
região de sinais característicos do carbono, a origem destes ainda não está
totalmente esclarecida, sendo que análises adicionais precisam ser executadas
para se confirmar a origem destes sinais.
As amostras sintetizadas foram aplicadas em testes de adsorção e fotodegradação
de corantes. As curvas de adsorção estão apresentadas na Figura 2. A figura 2a
apresenta as isotermas de adsorção do MB com as amostras AM1, AM2, AM3 e AM4 e
pode se observar que o equilíbrio foi atingido quando as concentrações foram 70,
78, 12 e 58%, respectivamente para cada amostra. Nesse sentido, infere-se que a
amostra AM3 foi a melhor na adsorção do MB, removendo aproximadamente 90% desse
corante da solução após 100 minutos de contato, esse resultado pode ser
observado também a olho nu, pois a solução teve uma grande mudança na coloração.
Entretanto esses materiais não tiveram a mesma eficiência adsortiva no
tratamento do corante IC, como mostrado na figura 2b nenhum dos adsorventes
testados apresentou mais de 30 % de remoção do corante do meio.
Esse resultado diferente para cada corante se dá devido as suas diferentes
propriedades, o que o leva a interagir de forma diferente com a superfície do
adsorvente. O corante MB possui caráter catiônico enquanto que o IC possui
caráter aniônico pertencente ao grupo dos indigóides, logo as cargas presentes
na superfície das amostras podem atrair as moléculas do corante facilitando o
processo de adsorção (FRANCA, OLIVEIRA e FERREIRA, 2009; CHAVES, MONTEIRO, et
al., 2008). A baixa adsorção do IC evidencia a pouca afinidade química pelos
sítios ativos das amostras sintetizadas. Nesse sentido, supomos que nas
condições testadas e conhecendo as características dos corantes que os materiais
sintetizados possuem uma carga superficial negativa. O que levou a maior
capacidade adsortiva do corante MB pelas amostras, destacando a AM3.
Outra premissa para justificar a melhor adsorção da amostra AM3 e AM4 é a área
superficial especifica, já se sabe que a área dos titanatos lamelares é maior em
relação ao TiO2 (MA, WANG, et al., 2019) e como indicado pelo DRX as amostras
AM3 e AM4 são possíveis titanatos de potássio lamelares. Logo, esses materiais
se mostraram promissores no tratamento de remoção de moléculas catiônicas.
As curvas de degradação dos materiais na Figura 2.c indicam que as amostras AM3
e AM4, sintetizadas com KOH 1 e 5 M apresentaram a melhor atividade
fotocatalítica para remoção do MB, enquanto que as amostras AM1 e AM2,
sintetizadas com menores concentrações de KOH apresentaram menor atividade
fotocatalítica. As curvas de degradação do IC com os materiais na Figura 2.d não
indicaram muita diferença entre as atividades fotocatalíticas das amostras AM1 e
AM2 e entre as amostras AM3 e AM4 houve pouca diferença, porém, comparando-se as
amostras sintetizadas em soluções mais alcalinas com as em menos alcalinas é
possível perceber uma melhor atividade para as amostras de 1 e 5 mol/L, e
observar que a amostra AM4, sintetizada com 5 mol/L, removeu 100% da cor (e
absorbância) do IC.
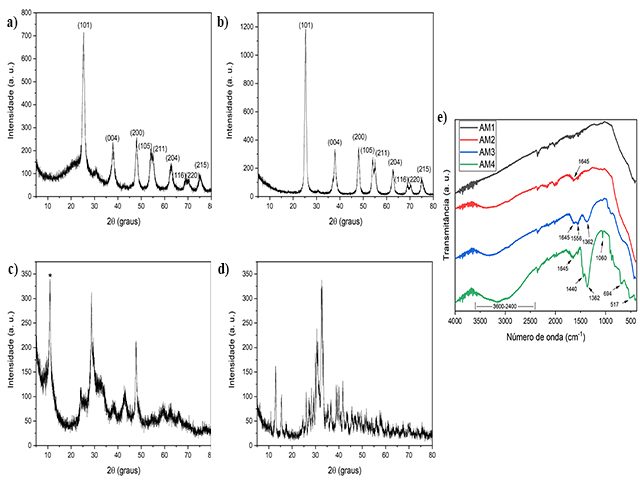
Difratogramas de raios-X (a) AM1, (b) AM2, (c) AM3 e (d) AM4 e (e) Espectros de FTIR das amostras.

(a) Curvas de adsorção do MB e do (b) IC pelas amostras à base de Ti e curvas de degradação do(C)MB e (d) IC com luz UVC.
Conclusões
O método hidrotérmico alcalino demostrou ser uma via simples e eficiente de produção de materiais à base de Ti com diferentes características e propriedades de adsorção e fotocatalítica. Dentre os materiais sintetizados, os obtidos a 1 e 5 mol/L (formados por titanatos de potássio) apresentaram melhor adsorção do MB provavelmente devido às suas maiores áreas superficiais e também devido às interações eletrostáticas favoráveis. Estes materiais se destacaram também na fotodegradação dos corantes (especialmente MB), sendo que a elevada quantidade de grupos hidroxilas também pode ter contribuído positivamente para a eficiência neste processo. Desta forma, o método empregado para síntese neste trabalho mostrou ser eficiente para obter materiais com boa capacidade adsortiva e fotocatalítica. Os resultados obtidos apontam que esses materiais são promissores para remoção de corantes e fonte de estudo para outras aplicações, como adsorção de outros tipos de contaminantes visando a purificação da água. No entanto, vale apena destacar que os resultados são preliminares e necessita-se maiores estudos estruturais e sobre as diferenças nas capacidades de adsorção e fotodegradação das amostras sintetizadas.
Agradecimentos
Os autores agradecem às agências financiadoras: CNPq, FAPEMIG e UFVJM pelo apoio financeiro na concessão das bolsas. Agradecem também ao Departamento de Farmácia (DeFar) da UFVJM por disponibilizar o laboratório para a pesquisa.
Referências
BURGOS, M.; LANGLET, M. The sol-gel transformation of TIPT coatings: a FTIR study. Thin Solid Films, v. 349, n. 1-2, p. 19-23, 1999.
CATTI, M.; PINUS, I.; SCHERILLO, A. On the crystal energy and structure of A2TinO2n+1 (A1⁄4Li, Na, K) titanates by DFT calculations and neutron diffraction. Journal of Solid State Chemistry, v. 205, p. 64-70, 2013.
CHAVES, K. O. et al. Adsorção de índigo carmim em biomassas mortas de Aspergillus niger. Eng. sanit. ambient. v. 13, n. 4, p. 351-355, 2008.
CHIBA, K. et al. Synthesis, structure, and electrochemical Li-ion intercalation properties of Li2Ti3O7 with Na2Ti3O7-type layered structure. Solid State Ionics, v. 178, n. 33-34, p. 1725-1730, 2008.
DARZI, S. J.; MAHJOUB, A. R.; BAYAT, A. Synthesis and characterization of visible light active S-doped TiO2. International Journal of Nano Dimension, v. 7, p. 33-40, 2016.
DAWSON, G. et al. A study on the effect of starting material phase on the production of trititanate nanotube. Solid State Sciences, v. 12, n. 12, p. 2170-2176, 2010.
FRANCA, A. S.; OLIVEIRA, L. S.; FERREIRA, M. E. Kinetics and equilibrium studies of methylene blue adsorption by spent coffee grounds. Desalination, v. 249, p. 267-272, 2009.
GUARATINI, C. C. I.; ZANONI, M. V. B. Corantes têxteis. Química Nova, v. 23, n. 1, p. 71- 78, 1999.
HINOJOSA-REYES, M.; CAMPOSECO-SOLIS, R.; RUIZ, F. H2Ti3O7 titanate nanotubes for highly effective adsorption of basic fuchsin dye for water purification. Microporous and Mesoporous Materials, v. 276, p. 183-191, 2019.
LALNUNHLIMI, S.; KRISHNASWAMY, V. Decolorization of azo dyes (Direct Blue 151 and Direct Red 31) by moderately alkaliphilic bacterial consortium. Brazilian Journal of Microbiology, São Paulo, v. 47, n. 1, p. 39-46, jan./mar. 2016.
MA, S. et al. Ultra-high adsorption of cationic methylene blue on two dimensional titanate nanosheets. RSC Advances, v. 9, n. 11, p. 5891-5894, 2019.
MACAK, J. M. et al. TiO2 nanotubes: Self-organized electrochemical formation, properties and applications. Current Opinion in Solid State and Materials Science, v. 11, n. 1-2, p. 3-18, 2007.MOGILEVS, G.; CHEN, Q.; KLEINHAMMES, A.; WU, Y. The structure of multilayered titania nanotubes based on delaminated anatase. Chemical Physics Letters, v.460, p.517-2, 2008.
MORGAN, D. L., ZHU, H. Y., FROST R. L., WACLAWIK. E. R.; Determination of a morphological phase diagram of Titania/Titanate nanostructures from alkaline Hydrotermal treatment of degusa P25. Chem. Mater. 2008, 20, 3800-3802.
MOURÃO, H. A. J. L. et al. Nanoestruturas em fotocatálise: uma revisão sobre estratégias de síntese de fotocatalisadores em escala nanométrica. Química Nova, v. 32, n. 8, p. 2181–2190, 2009.
NOGUEIRA, R. F. P.; JARDIM, W. F. A fotocatálise heterogênea e sua aplicação ambiental. Química Nova, v. 21, n.1, p. 69-72, 1998.
PAVIA, D. L. LAMPMAN, G. M.; KRIZ, G. S.; VYVYAN, J. R. Introdução à Espectroscopia. 4. ed. Cengage Learning, 2010.
SANTHI, K. et al. Synthesis and characterization of TiO2 nanorods by hydrothermal method with different pH conditions and their photocatalytic activity. Applied Surface Science, v. 500, 2020.
KAPUSUZ, D. et al. Synthesis and characterization of hydrothermally grown potassium titanate nanowires. Journal of Ceramic Processing Research, v. 16, n. 3, p. 291-297, 2015.


