Análise da influência do solvente na extração de antocianinas totais de resíduos vitivinícolas da Região da Campanha Gaúcha
- Home
- Trabalhos
ÁREA
Química de Alimentos
Autores
Soares, J.O. (UNIPAMPA) ; Barcellos Junior, J.T.S. (UNIPAMPA) ; Barcellos, M.G.O. (UNIPAMPA) ; Gauterio, F.G.A. (UNIPAMPA) ; Liendo, M.A. (UNIPAMPA)
RESUMO
O bagaço de uva, coproduto gerado durante a vinificação do vinho, apresenta uma elevada carga de compostos bioativos, como a antocianina. Contudo a extração das antocianinas ainda é restrita quando avaliado a estabilidade desses compostos. Sendo assim, o presente trabalho teve como objetivo avaliar a influência de solventes (água e etanol) na extração de antocianinas de cultivares de Cabernet Sauvignon e de Syrah provenientes da Campanha Gaúcha. Para determinação das antocianinas foi utilizado espectrofotômetro de UV-VIS em comprimento de onda de 520 nm. Os melhores resultados foram observados na extração com etanol, quando comparado com a extração em água. Também, as porcentagens extraídas de antocianinas estão diretamente relacionadas ao tipo de operação empregada.
Palavras Chaves
Coproduto; Bagaço de uva; Compostos bioativos
Introdução
A vitivinicultura brasileira ocupa uma área desde o extremo Sul até o extremo Norte do país, dentre as regiões destaca-se o Rio Grande do Sul como um dos principais estados produtores. Área esta que encontra-se em constante expansão com uma produção destinada ao consumo in natura ou para a elaboração de vinhos, sucos e derivados (COPELLO, 2017). Dentre as regiões do estado, a região da Campanha Gaúcha encontra-se em evidência nos últimos anos devido a sua grande variedade de cultivares e ao seu baixo índice pluviométrico, que possibilitam uma produção de uvas de alta qualidade. Segundo Mello (2019), o Rio Grande do Sul produziu em 2018 cerca de 822.68 ton de uvas e mais de 605,96 milhões de litros de vinho (TRICHES, 2020; AMARAL, 2020). O vinho, produto gerado a partir do resultado da ação biológica exercida pelas leveduras (Saccharomyces), que transformam o açúcar das uvas em álcool e gás carbônico, é um dos principais produtos alcoólicos de consumo no mundo, tendo um aumento de 22% em 2020, devido ao isolamento social provocado pelo Covid-19 (HENDERSON, 2014; OFFICE INTERNATIONAL DE LA VIGNE ET DU VIN, 2020). Contudo, a elaboração de vinhos gera uma grande quantidade de resíduos, como o bagaço (semente, casca e engaço), borras e resíduos de filtração, o que proporcionou em 2018 uma geração de cerca de 9 milhões de toneladas de rejeitos em escala mundial. Somente uma fração desses resíduos são reaproveitados, enquanto boa parte é tratada como resíduo de baixo valor agregado, sendo destinado para a alimentação de ruminantes ou como adubo de pastagens (HUERTA, 2018; MACHADO, 2018). Entretanto, o bagaço de uva é rico em compostos bioativos, como as antocianinas, tornando assim a busca por técnicas, que visem o reaproveitamento e a destinação mais nobre desse coproduto, um desafio (WEN et al., 2017). A palavra antocianina é originária do grego (anthos: flor e kianos: azul), e representa um diverso grupo de pigmentos vegetais naturais derivados do cátion Flavilium, responsáveis pelas colorações vermelha, roxa, rósea e azul de flores, vegetais e frutos. O consumo destes compostos é associado à prevenção de doenças degenerativas, tais como doenças cardíacas, câncer e do sistema imunológico. Nos últimos anos vários estudos apontam a utilização das antocianinas no desenvolvimento de alimentos funcionais e/ou do emprego em filmes inteligentes. Todavia, trata-se de compostos instáveis, podendo se degradar durante a extração ou processamento (FRANCIS; MARKAKIS, 1989; JANNA; KHAIRUL; MAZIAH, 2007; PIRES, 2020). Um dos principais fatores durante a extração desses compostos está ligado à escolha do solvente adequado, dado que a solubilidade dos compostos bioativos em um determinado solvente e/ou método influencia diretamente nas porcentagens extraídas da matriz vegetal avaliada. Entretanto, por não existir uma metodologia padronizada para extração de compostos, há o incentivo do estudo de métodos ambientalmente sustentáveis (MIRANDA, 2019). A fim disso, o presente trabalho teve como objetivo avaliar a influência de solventes (etanol e água) na extração de antocianinas de cultivares de Cabernet Sauvignon e Syrah provenientes da região da Campanha Gaúcha.
Material e métodos
Todos os reagentes utilizados foram de grau analítico, etanol (99%, v/v) ácido clorídrico (0,1% v/v) e água destilada. Os bagaços de uvas coletados foram provenientes da região da Campanha Gaúcha do Rio Grande do Sul de cultivares de Cabernet Sauvignon (BCS) e de Syrah (BSH). Após as coletas, os bagaços de uva foram armazenados separadamente em freezers (Consul) com temperaturas entre -10 e -20 ºC para posterior transformação em farinha. Para a obtenção e classificação das farinhas de bagaço de uva, o bagaço foi submetido à secagem em liofilizador (Terroni LS 3000) por um período de 48h, seguida por moagem em moinho de facas (Marconi, MA 580) e peneiramento em agitador eletromagnético (Bertel) com conjunto de peneiras granulométricas com Tyler de fundo, 16, 32, 60, 115. Posteriormente, foi realizada a extração das antocianinas totais dos bagaços in natura de BCS e BSH e das farinhas de bagaço de Carbent Sauvignon (FBCS) e de bagaço de Syrah (FBSH) utilizando solvente hidroalcoólico (70% v/v), acidificado com ácido clorídrico (0,1%) em banho metabólico (Dubnoff) à temperatura de 40ºC sob agitação durante 2 horas, de acordo com o proposto por de Stoll (2015). Também, a fim de avaliar a influência do solvente na extração realizou-se a extração com água acidificada com HCL (0,1%) em pH 1, regulado em pHmetro ( 827 pH Lab, Metrohm), conforme metodologia modificada de Capello (2020). A determinação das antocianinas totais presentes nos bagaços de uva in natura (BCS e BSH) e nas farinhas de bagaço de uva (FBCS e FBSH) foram obtidas através da metodologia proposta por Jiang et al. (2018) e Oliveira et al. (2018) utilizando-se da espectrofotometria de UV visível (em espectrofotômetro modelo UV 755B, da marca HEB), em leitura de absorbância em comprimento de onda de 520 nm. Os resultados foram obtidos em triplicata e tratados por Teste de Tukey a 5% (p < 0,05) de probabilidade, empregando o software Statistica® 6.0.
Resultado e discussão
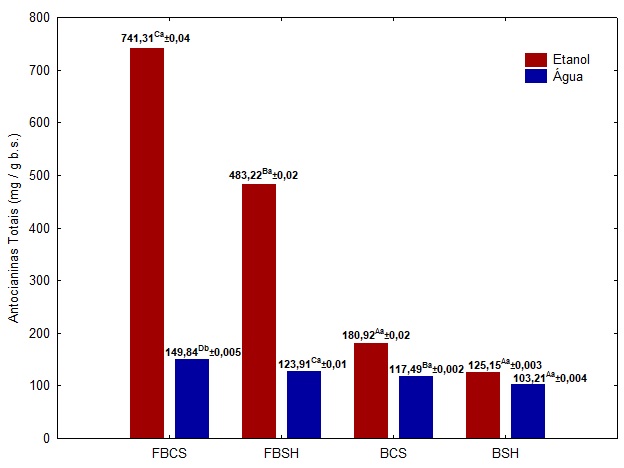
Os resultados da quantificação das antocianinas para cada amostra estão
dispostos na Figura 1. As letras minúsculas sobrescritas diferentes (a e b)
são as diferenças significativas (p<0,05) entre os cultivares em diferentes
solventes para uma mesma amostra. Letras maiúsculas sobrescritas diferentes
(A, B, C e D) são as diferenças significativas (p<0,05) entre as amostras em
um mesmo solvente, determinados pelo teste de Tukey.
Através da Figura 1 observa-se que quando comparado os solventes (etanol e
água), a melhor condição de extração foi utilizado o solvente hidroalcoólico,
com uma extração 66% mais eficiente na amostra de FBCS, sendo estatisticamente
a única amostra que apresentou diferença significativa em relação às
porcentagens de antocianina extraídas na mesma amostra água. Já as amostras de
FBSH, BCS e BSH, não apresentaram diferença significativa quando comparado à
extração nos diferentes solventes para uma mesma amostra. Na extração em
etanol, as amostras de FBCS e FBSH apresentaram diferenças significativas
entre si, e também em relação às amostras de BCS e BSH. Entretanto, avaliou-
se que não há diferença entre as amostras de bagaço in natura, mesmo nos
diferentes cultivares estudados Sendo assim, avaliou-se que na extração de
antocianinas neste solvente a granulometria está diretamente relacionada às
porcentagens extraídas do composto em estudo. Já na extração em água as
amostras de FBCS, FBSH, BCS e BSH, diferiram significativamente entre si,
comprovando que nesta extração o beneficiamento do material empregado e a
variedade do cultivar influenciaram diretamente na extração das antocianinas.
Sendo possível observar que para as amostras de farinhas, FBCS (741,31 e
149,84 mg/g) e FBSH (483,22 e 123,91 mg/g) apresentaram maiores teores de
antocianinas totais, quando comparado com os bagaços in natura, BCS (180, 92 e
117,49 mg/g) e BSH (125,15 e 103,21 mg/g), na extração com etanol e com água,
respectivamente. Tais resultados já eram esperados, pois estão diretamente
ligados à maior área superficial de contato, provocada pela operação de moagem
das amostras de bagaço durante a elaboração das farinhas. Segundo Souza
(2015), a taxa de transferência de massa é diretamente proporcional à área de
contato, ou seja, com a redução da partícula se tem o aumento da taxa de
extração. Também, a retirada de água do material proporcionou uma maior
concentração dos compostos após a operação de secagem. Quando comparado os
diferentes cultivares de uva, verifica-se que a variedade de uvas de Cabernet
Sauvignon apresentou maiores concentrações de antocianinas totais, quando
comparada com os cultivares de Syrah, o que não era esperado, visto que
Mattivi et al. (2006), quando analisou o teor de antocianinas em diferentes
cultivares observou que o cultivar de Syrah apresentou um teor de antocianinas
totais maior (234 mg/100 g), quando comparado com o cultivar de Cabernet
Sauvignon (215 mg/100 g). Entretanto, segundo Fogaça e Daudt (2015), o teor de
antocianinas pode estar diretamente ligado ao tempo de maturação do fruto,
também, conforme cultivar e as concentrações de galactose, celulose, ramanose
e xilose. Logo, por se tratar de cultivares provenientes de diferentes
vinícolas, o maior teor de antocianinas do cultivar de Cabernet Sauvignon pode
ser justificado devido às condições de maturação da uva e/ou do processamento
de vinificação do vinho.
Fonte: Autores (2021)
Conclusões
Os resultados deste trabalho demonstraram que a extração em etanol apresentou melhores resultados, com uma extração 66% mais eficiente na amostra de FBCS, quando comparado com extração em água dessa mesma amostra. Contudo, as amostras de FBSH, BCS e BSH não apresentaram diferença significativa na extração de antocianinas do bagaço de uva, quando comparados os dois solventes. O que viabiliza a utilização de métodos mais sustentáveis, como a extração em água, como uma técnica viável e barata quando objetivado à extração desses compostos. Também, observou-se que a variedade do cultivar e as operações empregadas estão diretamente ligadas às porcentagens extraídas de antocianinas da matriz vegetal.
Agradecimentos
Agradeço a Universidade Federal do Pampa (UNIPAMPA) pela oportunidade de realização deste trabalho
Referências
AMARAL, M. I. P. Campanha Gaúcha. [S. l.]: Tudo do vinho.com, 2020. Disponível em: https://tudodovinho.com/2020/07/14/i-p-campanha-gaucha.
CAPELLO, S. Desenvolvimento de biohíbrido à. base de antocianina da casca de berinjela (solanum melongena l.) e laponita®: estudo da cinética de adsorção/ dessorção, caracterização morfológica e físico-química. 2020. Dissertação (Mestrado em Engenharia de Alimentos) – Universidade Federal de Santa Catarina. Programa de Pós-Graduação em Engenharia de Alimentos, Florianópolis, 2010.
COPELLO, M. Relatório da safra: os números de 2016. Anuário Vinhos do Brasil, Bento Gonçalves/RS, p. 32-35, 2017.
FRANCIS, F. J.; MARKAKIS, P. C. Food colorants: Anthocyanins. Critical Reviews in Food Science and Nutrition, London, v. 28, n. 4, p 273-314.
FOGAÇA, A. O. & DAUDT, C. E. Potencial fenólico de uvas da variedade merlot e sua correlação com a composição fenólica dos vinhos. Colheita e Pós-Colheita. Rev. Bras. Frutic. 37 (3), 2015.
Henderson, C. M., & Block, D. E.. Examining the Role of Membrane Lipid Composition in Determining the Ethanol Tolerance of Saccharomyces cerevisiae. Applied and Environmental Microbiology, 80(10), 2966–2972, 2014.
HUERTA, M. M. Bagaço de uva: aproveitamento, avaliação e aplicação em pré-mistura para bolo. 2018. Dissertação (Mestrado em Ciência e Tecnologia de Alimentos) – Universidade Federal de Santa Maria. Programa de Pós-graduação em Ciência e Tecnologia de Alimentos, Santa Maria, 2018.
JANNA, O. A.; KHAIRUL, A. K.; MAZIAH, M., Anthocyanin stability studies in Tibouchina semidecandra L., Food Chemistry, Brussels, v. 101, p 1640-1646, 2007.
JIANG, T. et al. From ‘green’ technologies to ‘red’ antioxidant compounds extraction of purple corn: a combined ultrasound–ultrafiltration–purification approach. Journal of the Science of Food and Agriculture, Londres, v. 98, n. 13, p. 4919-4927, 2018.
MACHADO, A. M. R. Utilização da casca de uva como ingredientes no desenvolvimento de barras de cereais. 2018. Dissertação (Mestrado em Física de Materiais) – Universidade Federal de Ouro Preto. Programa de Pós-graduação em Ciência Física de Materiais, Ouro Preto, 2016.
MATTIVI, F., GUZZON, R., VRHOVSEK, U., STEFANINI, M., & VELASCO, R. Metabolite Profiling of Grape: Flavonols and Anthocyanins. Journal of Agricultural and Food Chemistry, 54(20), 7692–7702, 2006.
MIRANDA, B. M. Extração de bioativos da casca da jabuticaba: pectina e antocianinas. 2019. Dissertação (Mestrado em Ciência e Tecnologia de Alimentos) – Universidade Federal de Goiás. Programa de Pós-graduação em Ciência e Tecnologia de Alimentos, Goiânia, 2019.
OLIVEIRA, I. R. N. et al. New strategy for determination of anthocyanins, polyphenols and antioxidant capacity of Brassica oleracea liquid extract using infrared spectroscopies and multivariate regression. Spectrochimica Acta - Part A: Molecular and Biomolecular Spectroscopy, Columbia, v. 194, p. 172-180, 2018.
OIV. State of the Vitiviniculture World. Paris: Organisation Internationale de la Vigne et du Vin (International Organization of Vine and Wine), 2020.
PIRES, A. S. S. Sensores de pH baseados em antocianinas para aplicação em embalagens alimentares. 2020. Dissertação (Mestrado em Química) – Universidade do Porto. Programa de Pós-graduação em Química, Porto, 2020.
STOLL, L. Desenvolvimento e aplicação de filmes biodegradáveis com antioxidantes extraídos a partir de bagaço de uva, um resíduo da indústria vitivinícola. 2015. Dissertação (Mestrado em Ciência e Tecnologia de Alimentos) – Universidade Federal do Rio Grande do Sul. Programa de Pós-Graduação em Ciência e Tecnologia de Alimentos, Porto Alegre, 2015.
TRICHES, W. S. Avaliação agronômica e enológica da cultivar Tannat e sua interação com diferentes portaenxertos e clones em vinhedo na Campanha Gaúcha - RS. 2020. Dissertação (Mestrado em Ciência e Tecnologia de Alimentos) – Universidade Federal de Pelotas. Programa de Pós-graduação em Ciência e Tecnologia de Alimentos, Pelotas, 2020.


