influência do ultrasom na reatividade de cetonas aromáticas utilizando catalisadores metálicos tradicionais em processos de eletrocatálise
ISBN 978-85-85905-25-5
Área
Química Verde
Autores
Galvão, S. (IFPE) ; Barreto da Silva, M.E. (IFPE) ; Pereira da Silva, M.E. (IFPE) ; Duarte de Menezes, F. (IFPE) ; Selva, T.M. (IFPE) ; Vilar, M. (IFPE)
Resumo
O presente trabalho visa avaliar a influência da irradiação de ultrassom (US) em processos de (HEC) hidrogenação eletrocatalítica de cetonas aromáticas. Os dados experimentais revelam que o uso de US promove conversões da ordem de 67,5% a 79%, sendo os melhores resultados obtidos com catalisador metálico de Cu. Ademais, observa-se que o US provoca uma inesperada alteração na reatividade dos derivados da acetofenona em eletrodos metálicos convencionais como Cu, Fe, Fe:Ni e Ni. Todavia, os substratos não foram afetados pelo efeito do US ao se utilizar o catalisador de C. Neste sentido, o presente trabalho abre caminho para a utilização da sonoeletrocatálise de substratos aromáticos carbonilados com bons rendimentos e seletividades atendendo a princípios básicos da química verde.
Palavras chaves
ultrassom; carbono; hidrogenação
Introdução
A geração eletroquímica de hidrogênio “in situ” é um processo atraente na área de catálise, pois dispensa a necessidade de suprimento de gás hidrogênio, haja visto que o mesmo já é produzido sob forma ativa eliminando-se problemas de envenenamento do catalisador (COCHE; MOUTET, 1987). O método apresenta uma série de vantagens, tais como, (i) simplicidade experimental e condições mais brandas; (ii) eliminação de problemas relacionados à estocagem e transporte do hidrogênio, pois o mesmo é gerado eletroquimicamente; e (iii) a produção do hidrogênio pode ser facilmente controlada através de ajustes da voltagem e densidade de corrente aplicadas. A hidrogenação eletrocatalítica (HEC) é conhecida desde o início do século passado, quando foi sugerido que reduções eletroquímicas, realizadas em cátodos de metais de transição, deveriam envolver reações entre substratos insaturados e átomos de hidrogênio adsorvidos na superfície do eletrodo após serem gerados pela descarga eletrônica de prótons. Substratos como olefinas, aldeídos aromáticos e cetonas α,β insaturadas têm sido hidrogenados sob diversas condições eletrocatalíticas (COCHE; MOUTET, 1987). No entanto, com o aumento da hidrofobicidade dos substratos, os rendimentos reacionais tendem a diminuir, pois há uma limitação no transporte de massa entre as fases. Uma técnica alternativa e eficiente para contornar a problemática da limitação de transporte de massa até a interface eletrodo-solução é a aplicação de ultrassom (US) (PAZ et al.,2018). A aplicação de irradiação por US é uma das mais promissoras ferramentas na área de catálise heterogênea. Este processo é governado pelo fenômeno de cavitação, onde em um meio líquido, promove um efeito de ativação em reações químicas. A cavitação de bolhas próximas à superfície do catalisador é um processo assimétrico e produz um jato de alta pressão causando danos à sua superfície do eletrodo levando a um aumento do número de arestas, fendas e defeitos, expondo pontos altamente ativos da superfície que outrora eram indisponíveis. Além destes efeitos, o tratamento por US é capaz de alterar a morfologia do catalisador, o tamanho de partículas e, conforme mencionado anteriormente, melhorar a transferência de massa das espécies eletroativas em processos eletroquímicos. O método tem sido aplicado com eficiência em processos de polimerização (KRUUS et al, 1979), sonoeletrossíntese (ATOBE et al., 1999), hidrogenação sonoquímica (PAZ et al., 2018), etc. Entretanto, na área de eletrocatálise, o número de artigos que relatam o uso de US em reações de HEC é limitado. Sabe-se que a escolha do material catódico ideal não é uma tarefa fácil e geralmente é governada por fatores econômicos. Sendo a HEC um fenômeno de superfície, a natureza intrínseca dos materiais (ou seja, tamanho de partícula, morfologia, números de sítios de adsorção, etc.) pode afetar a atividade e seletividade do material catódico. Porém, o catalisador somente encontrará aplicação se for física e quimicamente estável no meio reacional, possuir condutividade elétrica adequada e, principalmente, se for seletivo (COUPER; PLETCHER; WALSH, 1990). Portanto, torna-se evidente a importância do bom entendimento da estrutura do catalisador e do seu desempenho (ou seja, atividade e seletividade). Neste sentido, o presente trabalho tem como objetivo investigar a influência do US no processo de HEC de cetonas aromáticas utilizando materiais catódicos tradicionais, tais como Fe, Cu, Ni, Fe:Ni (60:40) e C.
Material e métodos
A Acetofenona e seus derivados (o-metilacetofenona, p-metil acetofenona, m- metilacetofenona e 3,4-dimetil-acetofenona) foram adquiridos pela Sigma-Aldrich e usados sem tratamento prévio. O éter etílico (98%) foi adquirido pela Qhemis e o cloreto de amônio (99,5%),usado como eletrólito de suporte, foi adquirido pela Química Moderna. Um aparelho Autolab PGSTAT101 potenciostato/galvanostato, acoplado a um computador através de interface externa USB, utilizando o programa NOVA, foi utilizado para os processos eletrolíticos. As reações foram realizadas em uma célula de compartimento único de 30 mL de capacidade, especialmente desenhada para dissipar o calor. A cela eletroquímica encontra-se registrada junto ao INPI sob número de desenho industrial (BR 30 2017 003822 0). Para avaliação da influência do US no processo, foram utilizados diferentes materiais catódicos tradicionais, tais como barras de Fe, Ni, Cu, Fe:Ni e C (grafite) (d = 0,1 dm, A = 0.078 dm2). Ni foi utilizado como ânodo de sacrifício (d = 0,1 dm e A = 0.078 dm2). Os Eletrodos de trabalho (cátodo) foram reutilizados diversas vezes após remoção do depósito de níquel através de polimento abrasivo de sua superfície. Para a aplicação de US foi usado um equipamento Bandelin Sonopuls ultrasonic homogenizer HD 2070, o qual dispõe de uma ponteira ultrassônica cilíndrica de Ti (MS73 microtip; liga Ti- 6AI-4V) com diâmetro de 3 mm, suportando uma potência máxima de 70 W e 20KHz ± 500Hz de frequência (DA PAZ et al., 2018). O procedimento experimental consiste em preencher uma célula eletrolítica com 25mL de eletrólito de suporte NH4Cl; 0,2 molL-1 e 0,5 mmol de substrato. Em seguida, o sistema é montado de forma com que os eletrodos (cátodo e ânodo) estejam em uma distância de 2,0 cm entre si. O probe foi submerso 3,0 cm na solução e a uma distância de 0,5 cm dos eletrodos. Todas as reações foram realizadas em duplicata, a fim de se garantir um menor erro experimental. As reações foram realizadas com a passagem de uma densidade de corrente constante de 350mAdm-2, mediada por 14W de US em modo contínuo até o consumo total de 2 F mol-1, ou seja, aproximadamente 59 minutos de reação. Nestas condições, o potencial da cela eletroquímica variou entre -1,81 V e -1,95V. Ao término da reação, a solução aquosa foi extraída com éter etílico. Os rendimentos foram determinados através da análise por cromatografia gasosa (CG), utilizando um equipamento Varian 3380 GC, equipado com uma coluna capilar de 30 m × 0.25 mm DB5 (HP). A programação do equipamento iniciou com temperatura de 40 °C por 2 min seguida de uma rampa de 10 °C min-1 até a temperatura de 220 °C onde foi mantida até o fim por 2 min. Tolueno (0.067 mmol) foi utilizado como padrão interno para quantificação dos produtos. Análises de CG com espectrômetro de massas foram realizadas em equipamento Shimadzu CG/MS modelo GC17A, 70 eV ion trap.
Resultado e discussão
Moléculas contendo um sistema conjugado, entre um grupo carbonila e o anel
aromático, podem ser seletivamente hidrogenadas ao álcool aromático correspondente
haja vista que o anel aromático requer muito mais energia para hidrogenação que a
carbonila. Substâncias como acetofenona e seus derivados não fogem a esta regra. Por
exemplo, a hidrogenação da p-isobutil-acetofenona conduz ao 1-(p-
isobutilfenil)etanol em uma etapa fundamental na síntese do Ibuprofeno®, uma droga
anti-inflamatória não esteróidal (Moss et al., 1991). Diante do exposto, a Figura 1
apresenta os resultados, em termos de rendimento, do processo de HEC da acetofenona
e seus derivados metilados. Em primeira análise, podemos observar que os melhores
resultados de hidrogenação para os substratos estudados (79%, em média) foram
obtidos com o cátodo de Cu. Comparativamente aos demais materiais catódicos
testados, observa-se que a reatividade obedece a seguinte ordem: Cu (79%) > Ni (73%)
> Fe:Ni (72%) C (68,5%) > Fe (67,5%). Este comportamento esta em consonância com
outros dados descritos na literatura. Liu et al. (2017), por exemplo, observaram que
para a HEC do furfural, em termo de seletividade e eficiência de corrente, os
melhores materiais catódicos foram: Cu > Pb > Ni > Fe > Ti > C > Pt. De fato, a mais
importante classe de metais dotados de atividade catalítica são aqueles do Grupo 8-
11 da Tabela Periódica, isto é, os grupos do Fe, Co, Ni e Cu (V.Ponec; G.C. Bond,
1995). Os metais dos Grupos 8-10 pertencem à série de transição e se distinguem dos
outros metais por terem um orbital (n-1)d parcialmente ocupado. Os elétrons d
desemparelhados nestes elementos são responsáveis pela atividade catalítica nas
reações de hidrogenação. Metais como Ag e Au possuem orbitais d completamente
preenchidos (4d10 e 5d10, respectivamente), o que explica a
baixa atividade catalítica (MÄKI-ARVELA et al., 2005). Na família do Co ([Ar]
3d7 4s2) (... Rh e Ir), a diferença de energia entre os
orbitais s e d dificulta a re-hibridização dos elétrons de valência
s. Estes orbitais causam a chamada Repulsão de Pauli, isto é, uma repulsão
entre os elétrons do orbital s do metal e o elétron do orbital s do
hidrogênio ou com os elétrons da ligação do substrato insaturado (MÄKI-ARVELA et
al., 2005). Porém, metais como Ni, Pt e Pd possuem orbitais d e s
próximos, permitindo por conseguinte a re-hibridização dos elétrons s levando
à quimissorção de ambos hidrogênio e molécula orgânica insaturada (MASEL, 1996).
Sabe-se que a HEC da acetofenona é mais difícil do que a do benzaldeído (VILAR;
OLIVEIRA; NAVARRO, 2010) e isto se deve principalmente ao efeito estérico causado
pelo grupo metila anexado ao grupo carbonila, mas também ao seu efeito doador de
elétrons. Os resultados descritos por Vilar, Oliveira e Navarro (2010), revelam que
a inserção de um grupo metila na posições orto e para da acetofenona
diminui a eficiência eletroquímica e os rendimentos reacionais, sendo este efeito
mais pronunciado para o grupo metila na posição orto em decorrência de
efeitos estéricos do substituinte. Entretanto, quando se aplica US no processo de
HEC da acetofenona e seus substratos, observou-se um comportamento distinto daqueles
descritos na literatura para os catalisadores de Fe, Fe:Ni, Cu e Ni. De acordo com
a Figura 1, para os catalisadores citados, verifica-se que a facilidade de
hidrogenação da ligação C=O diminui na seguinte ordem: acetofenona > m-metil-
acetofenona > o-metil-acetofenona > p-metil-acetofenona > 3,4-dimetil-
acetofenona. Em contrapartida, para o eletrodo de C, observa-se um comportamento
condizente com aqueles descritos na literatura (VILAR; OLIVEIRA; NAVARRO, 2010), ou
seja, a facilidade de hidrogenação da ligação C=O diminui na seguinte ordem:
acetofenona > p-metil-acetofenona > m-metil-acetofenona > o-
metil-acetofenona ≅ 3,4-dimetil-acetofenona. Este fato pode estar relacionado com a
estrutura amorfa do carbono e com a forma interna dos poros da sua estrutura
catalítica, haja visto que a estrutura de poros governa os processos de transporte
de reagentes e produtos para a superfície e determina o tamanho da área de
superfície ativa. A Figura 2 mostra a morfologia (tamanho, homogeneidade e forma) da
superfície dos catalisadores de Cu (melhores resultados, 79%, em média) e C (685%,
em média). A microscopia eletrônica de varredura dos eletrodos de Cu (Figura 2A)
revelou depósitos de níquel irregulares de dimensões nanométricas, revelando que a
estrutura de um cluster de níquel difere daquele formado no catalisador de C
(Figura 2B). Neste catalisador, as partículas são menores quando comparadas àquelas
formadas no eletrodo de Cu. Desta feita, o US, além de aumentar a transferência de
massa do substrato até a superfície do catalisador, altera o tamanho das partículas
de níquel depositas no catalisador de C. Esta modificação da superfície aumenta o
número de arestas, dobras e faces disponíveis no catalisador para adsorção do
substrato e a uma consequente elevação da eficiência no processo de hidrogenação.
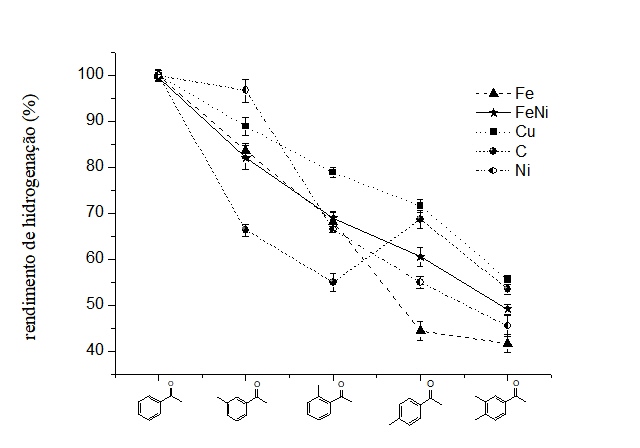
Rendimentos de HEC mediada por US da acetofenona e derivados metilados.

Microscopia eletrônica de varredura dos catalisadores de Cu (A) e C (B).
Conclusões
Diante dos resultados, fica evidente que a irradiação de US provoca, em certas condições experimentais, uma alteração no comportamento adsortivo do substrato na superfície dos catalisadores metálicos de Fe, Cu, Fe:Ni e Ni fazendo com que uma inesperada tendência fosse observada. Em média, os melhores resultados de hidrogenação foram obtidos com o catalisador metálico de Cu, seguidos dos catalisadores de Ni, Fe:Ni, C e Fe. O catalisador de C mostrou-se ativo para as condições estudadas e não sofre influência do US capaz de alterar a reatividade química das substâncias no processo eletroquímico. Vale ressaltar que apesar dos raros efeitos estereoquímicos presentes na sonoeletroquímica, várias hipóteses podem ser empregadas para explicar o comportamento observado para os catalisadores metálicos estudados, tais como tipo de US, intensidade, temperatura da solução, tipo de catalisador, pressão de gases etc. Assim, uma interpretação razoável em direção a explicar o fato observado no presente trabalho é prematura e, portanto, requer maiores investigações. Por fim, o presente estudo abre caminho para a utilização da sonoeletrocatálise de substratos aromáticos carbonilados com bons rendimentos e seletividades.
Agradecimentos
Os autores agradecem ao IFPE e ao CNPq pelo apoio financeiro.
Referências
ATOBE, M., TONOI, T., NONAKA, T.. Electrochem. Commun., 1999, 1, 593596.COCHE, Liliane; MOUTET, Jean Claude. Electrocatalytic hydrogenation of organic compounds on carbon electrodes modified by precious metal microparticles in redox active polymer films. Journal Of The American Chemical Society, [s.l.], v. 109, n. 22, p.6887-6889, out. 1987. American Chemical Society (ACS). http://dx.doi.org/10.1021/ja00256a072.COUPER, A. Mottram; PLETCHER, Derek; WALSH, Frank C.. Electrode materials for electrosynthesis. Chemical Reviews, [s.l.], v. 90, n. 5, p.837-865, jul. 1990. American Chemical Society (ACS). http://dx.doi.org/10.1021/cr00103a010. DONALDSON D.J., FARRINGTON M.D., KRUUS P.. J. Phys. Chem., 1979, 83, 31303135 ELANGO, V., MURPHY, M.A., SMITH, B.L., DEVENPORT, K.G., MOTT, G.N., MOSS, G.L., US Patent 4, 981–995 (1991), to Hoechst Celanese Corp. LIU, Lichao et al. Mechanism and kinetics of the electrocatalytic hydrogenation of furfural to furfuryl alcohol. Journal Of Electroanalytical Chemistry, [s.l.], v. 804, p.248-253, nov. 2017. Elsevier BV. http://dx.doi.org/10.1016/j.jelechem.2017.09.021. MAKI-ARVELA, P.; HÁJEK, J.; SALMI, T.; YU MURZIN, D., Appl. Catal. A: Gen. 292 (2005) 1–49 MASEL, R. I., Principles of Adsorption and Reaction on Solid Surfaces, Wiley, New York, 1996, pp. 193–197. PAZ, Josinete Angela da et al. Ultrasound-assisted electrocatalytic hydrogenation in water. Applied Catalysis A: General, [s.l.], v. 550, p.245-255, jan. 2018. Elsevier BV. http://dx.doi.org/10.1016/j.apcata.2017.11.013. PONEC, V.; BOND, G.C. in: Catalysis by Metal and Alloys, Series Surf. Sci. and Catal., vol. 96, Elsevier, Amsterdam, 1995, pp. 35-48.
VILAR, Márcio; OLIVEIRA, Jadson L.; NAVARRO, Marcelo. Investigation of the hydrogenation reactivity of some organic substrates using an electrocatalytic method. Applied Catalysis A: General, [s.l.], v. 372, n. 1, p.1-7, 5 jan. 2010. Elsevier BV. http://dx.doi.org/10.1016/j.apcata.2009.09.041.









