Avaliação de atividade antifúngica do extrato do Cocos Nucifera L. (PALMAE) frente ao fungo Lasiodiplodia Theobromae (Pat.) e sua toxicidade frente Artemia Salina.
ISBN 978-85-85905-25-5
Área
Produtos Naturais
Autores
Matos, D.M.A. (UECE - UNIVERSIDADE ESTADUAL DO CEARÁ) ; Sampaio, M.S.F. (UECE - UNIVERSIDADE ESTADUAL DO CEARA) ; Silva, A.L.B. (UECE - UNIVERSIDADE ESTADUAL DO CEARA) ; Maia, S.S.V. (UECE - UNIVERSIDADE ESTADUAL DO CEARA) ; Oliveira, M.R.F. (UECE - UNIVERSIDADE ESTADUAL DO CEARA) ; Romão, A.L.E. (UECE - UNIVERSIDADE ESTADUAL DO CEARA) ; Araujo, F.S.A. (EMBRAPA) ; Alves, C.R. (UECE - UNIVERSIDADE ESTADUAL DO CEARA) ; Weller, O.B. (EMBRAPA)
Resumo
A casca do coco verde, devido a alta demanda de consumo, não consegue ser propriamente tratado contribuindo para a formação de gases de efeito estufa e causam proliferação de doenças. Buscando investigar os potenciais bioativos do extrato etérico da casca do coco verde, realizou-se no trabalho a quantificação de fenóis totais, a avaliação do potencial antifúngico no controle do fitopatógeno Lasiodiplodia theobromae e sua toxicidade. Para o teste antifúngico o extrato foi emulsionado em DMSO e foi feito o preparo de soluções do extrato nas concentrações 200, 500, 800, 1100, e 1400 µg/mL. O extrato não apresentou toxicidade frente Artemia Salina. Observou-se inibição de até 72,13% do fungo, indicando sua predisposição para uso como possível precursor de defensivos agrícolas.
Palavras chaves
Cocos Nucifera L.; Antifúngico; Toxicidade
Introdução
A Cocoicultura, comercialização do Cocos Nucifera L. (PALMAE) é uma das mais rentáveis no Nordeste do Brasil. Devido a sua facilidade de reprodução e adaptação ao clima tropical, aliado as suas múltiplas aplicações desde o uso nutricional até a área medicinal, essa é uma espécie mundialmente comercializada. (DEBMANDAL et al., 2011; FIGUEIRA et al., 2013) Sua cultura tem elevada importância socioeconômica e cultural, pois além de gerar empregos e renda para milhares de agricultores e comerciantes, está muito inserida a sua utilização, na cultura nordestina, através do artesanato e consumo in natura. (CUENCA et al., 2003; HOODA et al., 2012). Segundo a EMBRAPA (2011), a Indonésia se apresenta como o maior produtor de coco do mundo, seguida pelas Filipinas e a Índia, gerando um total aproximado de 45 milhões de toneladas, numa área colhida de 11,2 de hectares. O Brasil se insere em quarto lugar com uma produção em 2,8 milhões de toneladas. É inrrefutável a importância da cadeia de produção do coco ,mas frente a isso existem problemas quanto ao cultivo desse fruto. Problemas de ordem fitossanitárias têm comprometido a produtividade e qualidade de produção do coco. Há comumente, a incidência de pragas como o fungo Lasiodiplodia theobromae (Pet.) Griffon & Maubl. (forma anamórfica), que causa a queima das folhas do coqueiro, que necrosam e morrem, enfraquecendo a sustentação dos frutos que caem antes da maturação ocasionando perda na produção. Doença essa originária do Brasil, não relatada em outras regiões do mundo. Esta doença constitui-se um problema seríssimo para as plantações do Nordeste e Norte do Brasil (Renard, 1982). Em boas condições de proliferação, pode acarretar prejuízos na ordem de 50% da produção de coco (Warwick et al.. 1994). Outro problema que chama a atenção é a grande geração de resíduos orgânicos oriundos do agronegócio do coco (cocus nucifera l.). MARTINS E JESUS JR (2011) estimam que sejam descartados no Brasil cerca de 7 milhões de toneladas de coco por ano. Segundo a FAO (2018) em 1990 o país já produzia cerca de 477 mil toneladas de coco e aumentou para 2,46 milhões de toneladas em 2016. Aliado ao grande aumento populacional no mundo, a produção agrícola também aumenta exponencialmente nos últimos anos, e com isso há uma proporcional produção de resíduos orgânicos, que devido a sua grande escala de produção e utilização, não conseguem ser eficientemente tratados, provocando acumulo nos lixões e aterros, mau odor, propagação de doenças, além de prejuízos ao solo quando despejados em locais inadequados. (CARLESSO, RIBEIRO E HOEHNE, 2011; ESTEVES, ABUD & BARCELLOS, 2015) O beneficio do investimento da comunidade científica na área de reaproveitamento de resíduos se torna importante tanto econômica como socialmente em vista da geração de valor a matéria descartada e de baixo custo, além de minimizar os efeitos colaterais ambientais. O reaproveitamento dos subprodutos da indústria de beneficiamento do coco verde se mostra proficiente, pois os seus resíduos industriais como a torta ou farelo do coco, o líquido da casca do coco verde e principalmente as cascas (fibras ou pó de coco), são matérias-primas de origem natural, que podem ser utilizados variadas áreas de produção, como por exemplo, na agricultura, na medicina, na cosmetologia, na indústria têxtil, dentre outros. Seus potenciais biológicos relatados vão desde protetores de raios UV e antioxidantes, até ação antimicrobiana. (DEBMANDAL & MANDAL, 2011; FREITAS, 2017; Figueira, 2012) Se torna duplamente vantajoso a proposta de aliar o reaproveitamento de resíduos ao tratamento de doenças fungicas nas culturas de coqueiro, se utilizando de defensivos provenientes de fontes naturais e consequentemente menos agressivos a natureza. O objetivo deste trabalho foi avaliar o potencial antifúngico do extrato etanólico da casca do coco verde, em diferentes tempos e concentrações, frente ao fungo Lasiodiplodia Theobromae e sua toxicidade frente a Artemia Salina, agregando valor a uma matéria prima abundante, sustentável e economicamente viável.
Material e métodos
Os extratos foram preparados a partir dos coco do tipo anão verde. Utilizou- se da técnica de maceração da casca do coco verde. Primeiro foi triturado e posto em estufa por 24h a 60°C. Após esse tempo, foi feita a percolação das fibras do coco em solvente éter etílico a 95%, 100g/L, durante 24h. Ao termino do tratamento foi filtrado e rotoevaporado, obtendo a fração de extrato etírico. A quantificação de fenóis totais foi feita por meio de espectroscopia na região do visível pelo método de Folin-Ciocalteau (SOUSA et al., 2007). Na preparação dissolveu-se 7,5 mg do extrato em 25mL de metanol. Agitou-se uma alíquota de 100 μL dessa solução com 500μL de Folin-Ciocalteu por 30 segundos, em seguida acrescentou-se 6 mL de H2O destilada e 2mL de Na2 CO3 à 15%. Realizou-se triplicata das amostras. Agitou-se novamente a mistura por 1 min e completou-se o volume para 10 ml com H2O destilada (1,4 mL). Em espectrofotômetro UV-Vis após 2 h foi feita as leituras de absorbância das amostras em 750 nm. A quantificação dos compostos fenólicos será encontrada através de uma curva analítica de ácido gálico. O teor de fenóis é determinado e o resultado expresso em mg EAG (equivalente Ácido Gálico) por grama de extrato. Para o teste da eficiência do potencial fungicida (MENTEN et al., 1976), foi medida pelo percentual de crescimento micelial (PIC), onde PIC=(CRTE- CRT)/CRTE x 100, sendo CRTE é o crescimento radial da testemunha e CRT é o crescimento radial de tratamento. O extrato etérico foi emulsionado em 5 gotas de dimetilsufóxido (DMSO) e adicionados ao meio Agar Potato Dextrose fundente, vertido em placa de Petri nas concentrações 200, 500, 800, 1100, e 1400 µg/mL, com duas repetições para cada concentração de constituintes/fungo. No centro da placa foi depositado um disco de micélio de 7 mm de diâmetro, retirado das bordas da colônia do fungo. Para efeito comparativo da atividade, utilizou-se como testemunha uma placa de Petri inoculada com o fungo sem a adição dos produtos e outra com a adição de 5 gotas de DMSO como controle. Determinou-se o diâmetro médio das colônias (em milímetros) após um intervalo de 24, 48 e 72 horas após a incubação, na temperatura de 25 ºC, e por comparação com o crescimento micelial das colônias nas placas testemunhas calculou-se a percentagem de inibição do crescimento micelial. Para o ensaio de toxicidade, seguindo a metodologia de MEYER (1982) com algumas modificações, pesou-se 50 mg do extrato e realizou-se as diluições em series do mesmo com água salina em copos plásticos, obtendo assim as concentrações finais de 1000, 500, 250 e 125 μg/mL. Posteriormente transferiu-se 10 larvas de A. salina. para cada copo. Depois de 24 horas, fez-se a contagem do número de larvas sobreviventes. O teste foi realizado em triplicata, sendo todos os constituintes diluídos em Tween. Os resultados foram tratados estatisticamente por Anova dois fatores e comparação das médias.
Resultado e discussão
Após a maceração, foi obtido 0,15g de extrato etérico que ao ser analisado
na curva padrão de regressão linear, apresentou teor de 158,70 mg ± 0,06
EAG/g (Equivalente de Ácido Gálico por grama de extrato) de fenóis totais
DEY e colaboradores (2003) avaliaram o conteúdo total de fenóis do extrato
etanólico da casca de coco maduro e encontraram um valor de cerca de 13 mg
EAG/g de extrato seco. COSTA (2008) por outro lado detectou teores de 25,87
e 18,08% dos extratos de acetato de etila e butanólico. Isto pode estar
relacionado com o tipo de processamento realizado para a obtenção da amostra
e a diferença de polaridades dos solventes utilizados, que extraíram
substâncias diferentes. Esses estudos avaliaram os teores de fenóis totais
do coco quanto aos seus aspectos químicos, entretanto pouco se sabe sobre a
composição dos extratos de éter etílico. SANTANA (2012) e BRUM (2009) citam
a utilização de éter diétílico e outros solventes puros apolares para a
extração de lipídios neutros pela técnica de Soxhlet, o que pode sugerir a
presença de tais lipídios e açucares neste extrato.
A toxicidade contra A. salina é expressa pela Concentração Letal Média
(CL50) que é a concentração que inibe 50% da população de A. salina, menores
valores de CL50 correspondem a maior toxicidade. No teste de toxicidade, a
CL50 das amostras foram definidas a partir de equações obtidas por regressão
linear que determinam os valores de CL50 de extratos naturais ativos em ppm
(MEYER et al. 1982). Os extratos com CL50 < 1.000 μg/mL serão julgados
biologicamente ativos. (KRISHNARAJU et al. 2005) Em vista da sua facilidade
de reprodução e distribuição aquática, a Artemia sp é utilizada para
inúmeros estudos de ecotoxicidade e no estudo da toxicidade de produtos como
pesticidas, derivados do petroquímicos e dispersantes e outros vários desde
a década de 50 (BEVILACQUA et al. 2008). No presente ensaio foi observado
que extrato etérico apresentou uma CL50 de 1359,2 μg/mL, valor superior a
1000 ppm, indicando que o extrato não é tóxico.
A atividade antifungica, sobre o fitopatógeno, foi obtida com base em
avaliações de inibição do crescimento micelial em ágar, esta técnica é
validada, pois tem sido bastante empregada (MENTEN et al., 1976, LIMA et
al., 1993, FEITOSA et al., 2000; FREIRE et al., 2011).
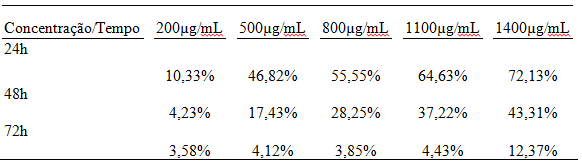
As amostras feitas apenas com ágar, chamadas de branco, possuem PIC de 100%.
A partir dessas amostras, que foram usadas como base, obtivemos os dados de
inibição, tabela 1, e resultados estatísticos, apresentados nos gráficos 1.
Os resultados apresentados, para o extrato etérico da casca do coco,
demonstraram potencial como antifúngico.
O tempo de observação de 24h apresentou taxas de inibição superiores ao de
48 e 72 horas, e segundo a análise estatística foi constatado que há efeito
significativo dos tempos sobre o potencial de inibição do fungo. O fungo
apresentou maior sensibilidade ao extrato nas primeiras 24 horas nas
concentrações de 1400 e 1100 µg/mL para o crescimento micelial (Gráfico 1),
inibindo respectivamente, 72,13% e 64,63% do fungo Lasiodiplodia T.,
diferença estatisticamente comprovada pela comparação de médias. Após 48h
apresentou ainda inibição de 37,22% e 43,31% nas concentrações de 1100 e
1400 µg/mL respectivamente. Foi observado também que não houve diferença na
inibição do fungo após as 72h nas concentrações de 200 a 1100 µg/mL,
apresentando inibição significativa de 12,37%, na concentração de 1400
µg/mL, do crescimento micelial após as 72h.
RAMOS, JUNIOR e KOZUSNY- ANDREANI (2016) obtiveram um resultado de CIM –
Concentração mínima inibitória do fungo Colletotrichum gloeosporioides de
25% ao avaliar atividade de extrato de óleo essencial de Cocos Nucifera,
resultado abaixo do obtido no referente trabalho.
O extrato da noz de areca (areca catechu) planta da mesma família do coco
(Palmae), também foi relatado como antifúngico. O extrato aquoso de noz de
areca a 50 µg / ml efetivamente inibiu o crescimento do fungo unicelular
Candida albicans. (ANTHIKAT E MICHAEL, 2009)
Para o manejo adequado de doenças no coqueiro, estudos mais amplos devem ser
priorizados quanto à determinação dos melhores intervalos de aplicação e
concentrações necessárias. De acordo com algumas literaturas, muitos
fungicidas podem ter efeitos fitotóxicos, podendo reduzir o crescimento e
interferir no desenvolvimento de plantas, se aplicados em concentrações e
intervalos de tempo inadequados além de possibilitar a resistência do
fitopatógeno.
Porcentagem de inibição do fungo Lasiodiplodia T. nos tempos de 24, 48 e 72hs.

Porcentagem de inibição do fungo Lasiodiplodia T. nos tempos de 24, 48 e 72hs. Anova 2 fatores.
Conclusões
A determinação da atividade antifúngica in vitro se constitui numa fase preliminar da seleção de produtos químicos, assim, os resíduos de descarte da indústria de beneficiamento da coco e comércio popular, sugerem grande potencial antifúngico in vitro frente ao fitopatógeno Lasiodiplodia theobromae, podendo contribuir para amenizar problemas de ordem fitossanitárias que ocasionam perdas na produtividade, além do reaproveitamento de resíduo orgânico natural. Estudos mais aprofundados sobre esses potenciais biológicos devem ser priorizados.
Agradecimentos
Agradeço a FUNCAP e a UECE pelo apoio e incentivo para a pesquisa. Agradeço a EMBRAPA por ceder a Cepa do fungo para estudo.
Referências
ANTHIKAT R, R.; MICHAEL A. Study on the Areca Nut for its Antimicrobial Properties. J. Young. Pharm. v. 1, n.1, p 42-5, 2009.
BEVILACQUA, A. H. V.; SUFFREDINI, I. B., BERNARDI, M. M. Toxicidade de Neem, Azadirachta indica A. Juss. (Meliaceae), em Artemia SP: comparação da preparação comercial e do óleo puro. Revista Instituto Ciências Saúde. v. 26, p. 157-160, 2008.
BRUM, A., A., S.; ARRUDA, L., F.; REGITANO-D´ARCE, M., A., B. Métodos de extração e qualidade da fração lipídica de matérias-primas de origem vegetal e animal. Química Nova, v. 32, n. 4, p. 849-854, 2009.
CARLESSO, W. M.; RIBEIRO, R.; HOEHN, L. Tratamento de resíduos a partir de compostagem e vermicompostagem. Revista Destaques Acadêmicos, n.4, p.1, 2011.
CUENCA, M. A. G.; SIQUEIRA, L. A. Aspectos econômicos da cocoicultura, coco: produção, aspectos técnicos. Brasília: Embrapa Informação Tecnológica, p. 10-13, 2003.
DEBMANDAL, M.; MANDAL, S. Coconut (Cocos nucufera L.: Arecaceace): in health promotion and disease prevention. Asian Pacifice Journal of Tropical Medicine, p.241–247, 2011.
DEY, G.; SACHAN, A.; GHOSH, S.; MITRA, A. Detection of major phenolic acids from dried mesocarpic husk of mature coconut by thin layer chromatography. Industrial Crops and Products, v. 18, p. 171-176, 2003.
EMBRAPA, Centro de Pesquisa Agropecuária dos Tabuleiros Costeiros. Evolução da produção de coco no Brasil e o comércio internacional - Panorama 2010. Documentos, nº 164 Aracaju, SE, p. 32. 2011.
ESTEVES, M. R. L., ABUD, A. K. S., BARCELLOS, K. M. Avaliação do potencial energético das cascas de coco verde para aproveitamento na produção de briquetes. Scientia plena, v.11, n.3, p.1–8, 2015.
FAO. Food And Agriculture Organization. Crops Statistics. Roma: Organização das Nações Unidas. Acesso 14 julho. 2018. Disponível http://www.fao.org/faostat/en/#data/QC
FEITOSA, V. S.; PESSOA, M. N. G.; ALMEIDA, J. L. & SILVA, M. G. V. Efeito da tintura, extrato bruto e sumo de plantas medicinais sobre o crescimento micelial de Colletotrichum gloeosporioides, Lasiodiplodia theobromae e Macrophomina phaseolina “in vitro”. Fitopatologia Brasileira, v. 25, p. 374. 2000.
FIGUEIRA, C. N. T. Avaliação da atividade antimicrobiana, citotóxica e capacidade sequestradora de radicais livres de extratos brutos do Cocos nucifera Linn. Dissertação. 2012. 122 f. Programa de Pós-Graduação em Enfermagem da Escola de Enfermagem e Farmácia. Universidade Federal de Alagoas, 2012.
FIGUEIRA, C. N. T.; SANTOS, R. M.; CAMPESATTO, E. A.; LÚCIO, I. M. L.; ARAÚJO, E. C.; BASTOS, M. L. Biological activity of the Cocos Nucifera l. And its profile in the treatment of diseases: A review. Journal of Chemical and Pharmaceutical Research, v. 5, n. 5, p. 297-302, 2013.
FREIRE, F. C. O., DANTAS, J. D. P., ALVES, C. R., GUEDES, M. I. F. Desenvolvimento e Eficiência de um Fungicida Triazol a partir do Líquido da Casca da Castanha (LCC) do Cajueiro, Comunicado Técnico 178, Embrapa Agroindústria Tropical, p. 1-4. 2011.
FREITAS, R, B. Desenvolvimento de fitocosmético antioxidante a partir de extrato padronizado do coco (cocos nucifera): um estudo comparativo entre as variedades amarela e verde. Dissertação. 2017. 94 f. Programa de Pós-Graduação em Ciências Farmacêuticas da Faculdade de Farmácia, Odontologia e Enfermagem. Universidade Federal do Ceará. 2017.
HOODA, V.; SHARMA, N. G.; TYAGI, N.; HOODA, A. Phytochemical and pharmacological profile of Cocos nucifera: an overview. International Journal of Pharmacy & Therapeutics, v. 3, n. 2, p. 130-135, 2012.
KRISHNARAJU, A. V.; RAO, T. V. N.; SUNDARARAJU, D.; VANISREE, M.; TSAY, H. S.; SUBBARAJU, G. V. Assessment of bioactivity of indian medicinal plants using brine shrimp (artemia salina) lethality assay. International Journal of Applied Science and Engineering, India, v. 134, p. 125, 2005.
LIMA, J. S., MOREIRA, R. C., CARDOSO, J. E., MARTINS, M. V., VIANA, F. M.P. Caracterização cultural, morfológica e patogênica de Lasiodiplodia theobromae associado a frutíferas tropicais. Summa Phytopathol, Botucatu, v. 39, n. 2, p. 81-88. 2013.
MARTINS, C. R.; JESUS Jr. L. A. Evolução da produção de coco no Brasil e o comércio internacional. Documentos 164. Embrapa Tabuleiros Costeiros, Aracaju. 2011.
MENTEN, J. O. M.; MACHADO, C. C.; MINUSSI, E.; CASTRO, C.; KIMATI, H. Efeito de alguns fungicidas no crescimento micelial de macrophomina phaseolina (tass.) goid. in vitro. Fitopatologia Brasileira. v.1, n.2, p 57-66, 1976.
MEYER B. N.; FERRIGNI N. R.; PUTNAM J. E.; JACOBSEN L. B.; NICHOLS D. E.; MCLAUGHLIN J. L. Brine shrimp, a convenient general bioassy for active-plant constituents. Planta Medica. v. 45, p. 31-34, 1982.
N. SUBHAKARA REDDY, A. SRINIVAS RAO, M. ADHARVANA CHARI, V. RAVI KUMAR, V. JYOTHY, V. HIMABINDU. Synthesis and Antibacterial Activity of Urea and Thiourea Derivatives of Anacardic acid mixture isolated from a natural product cashew nut shell liquid (CNSL). International Journal of Organic Chemistry, v. 2, n. 3, 2012.
RAHMAN, A.; CHOUDHARY, M.I.; THOMSON, W. J. Bioassay techniques for drug development, Harwood academic publishers, 2001.
RAMOS, K.; ANDREANI JUNIOR, R.; KOZUSNY- ANDREANI, D.I. Óleos essenciais e vegetais no controle in vitro de Colletotrichum gloeosporioides Rev. Bras. Pl. Med, Campinas, v. 18, n. 2, p.605-612, 2016.
RENARD, J. J. Missão de prospecção sobre as doenças do coqueiro e palmeira oleaginosa no Brasil. Paris: IHRO / GERDAT, p. 85, 1982.
SANTANA, I. A. Avaliação Química e Funcional de Polpa de Coco Verde e Aplicação em Gelado Comestível. 2012. 107f. Dissertação de Mestrado. Escola de Engenharia Mauá, São Caetano do Sul, SP. 2012.
SOUSA, C. M. M.; SILVA, H. R.; VIEIRA-JR, G. M.; AYRES, M. C. C.; COSTA, C. L. S.; ARAÚJO, D. S.; CAVALCANTE, L. C. D.; BARROS, E. D. S.; ARAÚJO, P. B. M.; BRANDÃO, M. S.; CHAVES, M. H. Fenóis totais e atividade antioxidante de cinco plantas medicinais. Quimica Nova. v, 30, p. 351-355. 2007.
WARWICK, D. R. N.; RENARD, J. L.; BLAHA, G. La queima das folhas du cocotier. Plantations, Recherche, Development, v.1, n.2, p.57-52, 1994.









