Avaliação da atividade antimicrobiana de compostos aromáticos frente à X. citri subsp. citri, bactéria causadora do cancro cítrico
ISBN 978-85-85905-25-5
Área
Produtos Naturais
Autores
dos Santos Niculau, E. (UNIVERSIDADE FEDERAL DO TOCANTINS) ; Batista Fernandes, J. (UNIVERSIDADE FEDERAL DE SÃO CARLOS) ; Fátima das Graças Fernandes da Silva, M. (UNIVERSIDADE FEDERAL DE SÃO CARLOS) ; Henrique Gomes Martins, C. (UNIVERSIDADE DE FRANCA) ; Rossi Forim, M. (UNIVERSIDADE FEDERAL DE SÃO CARLOS) ; Antonio Machado, M. (CENTRO DE CITRICULTURA SYLVIO MOREIRA, IAC)
Resumo
O cancro cítrico é uma fitopatogenia causada por Xanthomonas citri subsp. citri que provoca sérios problemas na citricultura mundial. As plantas produzem diversos compostos aromáticos, porém na presença de um micro- organismo, geralmente elas tentam se defender biossintetizando fitoanticipinas ou fitoalexinas. Neste trabalho, foi realizado a avaliação de atividade antimicrobiana de 16 compostos aromáticos e 1 limonóide. Entre estes, o álcool feniletílico e salicilato de metila apresentaram boa concentração inibitória mínima (CIM) de 3,3 x 103 μM e 2,6 x 103 μM. Os outros foram: Eugenol (2,4 x 103 μM), timol (0,7 x 103 μM), benzoato de 2- etilhexila (1,7 x 103 μM), 4-carboxaldeído-quinolina (1,3 x 103 μM), hesperidin e rutina (ambos de 0,7 x 103 μM).
Palavras chaves
X. citri subsp. citri; compostos aromáticos; efeito antimicrobiano
Introdução
O cancro cítrico é uma doença quarentenária A2 causada por Xanthomonas citri subsp. citri que provoca sérios problemas na citricultura mundial, incluindo a cultura de Laranja Pêra. X. citri subsp. citri [sinonímia X. campestres pv. citri, Vauterin et al. (1995) e X. axonopodis pv. citri (Hasse) Vauterin et al.], é uma espécie de bactéria Gram-negativa, pertencente ao reino Bactéria, filo Proteobactéria, classe Gammaproteobactéria, ordem Xanthomonadales, família, Xanthomonadaceae e gênero Xanthomonas (BRUNINGS e GABRIEL, 2003; GRAHAM et al., 2004). O micro-organismo é um tipo de bactéria baciliforme, aeróbica obrigatória, que apresenta formato de bastonete com presença de um único flagelo polar e não forma esporo (GRAHAM et al., 2004). A bactéria é caracterizada por formar colônias amarelas de forma pegajosa em nutriente ágar (NA), sendo esta uma das características para diagnosticar a presença do micro-organismo na planta. A interação entre plantas e seus patógenos é fruto de relacionamento coevolucionário entre eles e a resistência da planta, logo a patogenicidade do micro-organismo é resultado dessa interação. A interação entre plantas e seus patógenos é íntima (genética, gene a gene), complexa (ativação de reações bioquímicas em cascatas, acumulo de proteínas de defesa e mudanças citológicas e morfológicas na planta) e antiga (desde a evolução das plantas na terra). Numa batalha coevolutiva, plantas respondem ao ataque de patógenos e pragas, fazendo uso de mecanismos efetivos de resistência a doenças (SILVA, 2013). Patógenos atacam plantas porque durante a evolução de seu desenvolvimento, eles adquiriram a habilidade de viver das substâncias produzidas pelas plantas hospedeiras. Como muitas substâncias estão contidas no protoplasma das células vegetais, para acessá-las os patógenos primeiro precisam transpor as barreiras estruturais externas da planta, a cutícula e a parede celular (AGRIOS, 1997). A maioria dos patógenos tem acesso ao interior das plantas diretamente, via penetração da superfície foliar (ex.: fungos) ou radicular (ex.: nematoides), por meio de ferimentos (ex.: fungos, vírus, bactérias e nematoides) ou por meio de aberturas naturais, tais como estômatos e hidatódios (ex.: fungos, bactérias e vírus) (FALEIRO, 2011). A ideia de que as plantas possuem um sistema de defesa semelhante ao sistema imunológico dos animais surgiu no final do século IX, mas evidências de que elas respondem ao ataque de micro-organismos, alterando seu metabolismo e sintetizando substâncias capazes de protegê-las das doenças, só foram obtidas por volta de 1940. Estudos realizados na Alemanha, com cultivares de batata atacados pelo fungo da requeima, levaram à descoberta de que as plantas resistentes acumulavam substâncias inibidoras do crescimento do fungo, o que não ocorria nas cultivares de batata suscetíveis à doença (BRAGA, 2008). Estas substâncias foram denominadas de fitoalexinas e sua descoberta causou profundas mudanças no conceito de resistência de plantas a patógenos (DESJARDINS et al., 1989). Fitoalexinas são substâncias produzidas pela planta nas regiões individuais e na sua vizinhança imediata para ajudar a limitar a propagação de patógenos invasores, não sendo observáveis antes da infecção (GRAYER e HARBORNE, 1994; VANETTEN et al,1989). Este é um mecanismo comum de resistência à patógenos em uma vasta gama de plantas (BAILEY e MANSFIELD, 1982; DARVILL e ALBERSHEIM, 1984; GRAYER e HARBORNE, 1994; VANETTEN et al., 1989). Podem ser acumulados em resposta a vários micro-organismos, mas também como consequência de fatores que causam estresse na planta, como ferimentos e exposição a substâncias tóxicas. Diversas classes de produtos naturais como alcalóides, compostos aromáticos fenólicos e flavonóides, entre outros, têm sido descritos como fitoalexinas (FLORES et al., 2005). Na tese de Doutorado de NICULAU, 2014, o autor demonstrou que a Citrus sinensis produz vários compostos aromáticos na presença da bactéria, mas não foi provado se os mesmos são fitoalexinas ou fitoanticipinas com atividade antimicrobiana frente ao micro-organismo causador do cancro cítrico. Acredita-se que a maioria das plantas seja capaz de sintetizar fitoalexinas, mas algumas a fazem de maneira muito lenta, permitindo que o micro-organismo complete a infecção antes que haja o acúmulo dessas substâncias em quantidades suficientes para inibi-lo (OSBOURN, 1999). Além disso, geralmente as quantidades das fitoalexinas produzidas pelas plantas atacadas pelo patógeno podem não ser suficientes para inibir a infeção causada pelo micro-organismo. Dessa forma, este trabalho mostra os efeitos antimicrobiano in vitro de vários compostos aromáticos que podem ser biossintetizados por Citrus sinensis frente à X. citri subsp. citri.
Material e métodos
A bactéria empregada neste ensaio foi a X. citri subsp. citri, cepa 306, obtida junto ao Centro Avançado de Pesquisa Tecnológica do Agronegócio de Citros Sylvio Moreira do Instituto Agronômico (IAC), situado na cidade de Cordeirópolis-SP, com a colaboração do Prof. Dr. Marcos Antônio Machado. A cepa empregada foi transferida e mantida no Laboratório de Pesquisa em Microbiologia Aplicada - LaPeMA da Universidade de Franca (Franca, SP, Brasil), sob criopreservação (-80°C). O ensaio antimicrobiano foi realizado sob a coordenação do Prof. Dr. Carlos Henrique Gomes Martins da Universidade de Franca. A determinação da concentração inibitória mínima (CIM) dos compostos padrões álcool benzílico, salicilato de metila, benzoato de isoamila, benzoato de 2- etil hexila, álcool feniletílico, benzoato de metila, acetato de benzila, benzoato de etila, benzoatiazol, quercetina, eugenol, 4-carboxaldeído- quinolina, rutina, timol, naringina, hesperidina e cedrelona foi realizada segundo a metodologia da diluição em caldo proposta pelo “Clinical and Laboratory Standards Institute” (CLSI, 2012). Foram utilizadas microplacas com fundo chato esterilizadas com 96 orifícios (TPP®, EUA). Cada orifício recebeu o inóculo, o meio de cultura líquido caldo nutriente (Difco) e as soluções das amostras em concentrações finais que variaram de 0,195 a 400 μg mL-1, sendo o volume final de 100 μL. O inóculo foi ajustado para a bactéria, a uma concentração de 5 × 105 Unidades Formadoras de Colônia por mililitro (UFC/mL), segundo as normas do CLSI, por meio da verificação das absorbâncias em 625 nm. Logo após a micropipetagem as placas foram tampadas e incubadas a 28ºC por 72 h, sem agitação. Terminado o período de incubação, foram adicionados em cada orifício das placas 30 μL de resazurina a 0,02% em solução aquosa esterilizada onde, após 60 minutos de reincubação, a leitura foi realizada. A resazurina facilita verificar a presença de crescimento microbiano, a coloração azul indica ausência de crescimento microbiano, enquanto a cor vermelha indica a presença de células viáveis em crescimento. Dessa maneira foi possível determinar a menor concentração da amostra capaz de inibir o crescimento da bactéria avaliada. Para o controle positivo, as concentrações avaliadas variaram de 0,0115 a 5,9 μg mL-1 (Estreptomicina), perfazendo 100 μL de volume final. Foram realizados o controle de esterilidade do caldo, do solvente e da cultura.
Resultado e discussão
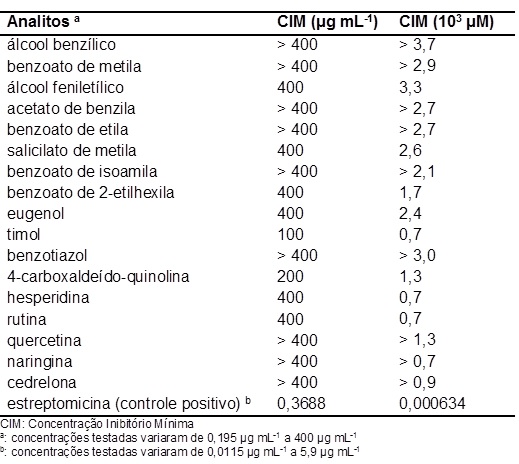
Entre os compostos ensaiados neste estudo, o álcool feniletílico apresentou
uma Concentração Inibitória Mínima (CIM) de 3,3 x 103 μM (400 μg mL-1) e
salicilato de metila de 2,6 x 103 μM (400 μg mL-1), comprovando que estes
compostos podem agir como fitoalexinas em C. sinensis, pois esta planta não
biossintetiza as mesmas na ausência dos sintomas do cancro cítrico
ocasionado pela bactéria X. citri subsp. citri. Estas atividades são
superiores à maioria das CIMs encontradas por RIBEIRO et al., 2008, os quais
avaliaram vários compostos naturais frente à inibição de Xylela fastidiosa,
um fitopatógeno causador da CVC em várias variedades de Citrus sinensis.
Além disso, a concentração máxima avaliada foi de apenas 400 μg mL-1,
enquanto RIBEIRO et al., 2008, usaram 2000 μg mL-1 como concentração limite.
Os demais compostos avaliados podem apresentar atividade em concentrações
superiores a 400 μg mL-1, ou seja, superiores a 2,7; 2,9 e 3,7 x 103 μM,
haja vista que foi adotado apenas 400 μg mL-1 como concentração limite
(FIGURAS 1 e 2). Os outros compostos naturais que também são considerados
voláteis presentes em plantas e que apresentaram atividade são: eugenol (2,4
x 103 μM), timol (0,7 x 103 μM) e benzoato de 2-etilhexila (1,7 x 103 μM).
Este último composto foi identificado em folhas assintomáticas (infectada
com o Xac, mas sem sintoma) e sintomáticas (infectada com Xac e com sintoma)
do cancro cítrico (NICULAU, E. S, 2014), provando com isso que este volátil
também é uma fitoalexina. 4-carboxaldeído-quinolina também apresentou boa
atividade (1,3 x 103 μM).
As CIMs dos flavonóides hesperidina e rutina foram de 0,7 x 103 μM para
ambos, mostrando também ser potenciais compostos naturais antimicrobiano.
Alguns trabalhos de mestrado e/ou doutorado do grupo de produtos naturais da
UFSCar (PN-UFSCar) mostraram que esses flavonóides aumentam em concentração
quando atacados por determinados fitopatógenos, agindo como fitoanticipina.
Provavelmente, o mesmo efeito ocorre com a associação C. sinensis - X. citri
subs.citri. Aproximadamente um milhão de toneladas métricas de cascas de
laranja é descartada como resíduo (RIBEIRO et al, 2008), com isso, as mesmas
representam uma fonte promissora de hesperidina e rutina para utilização em
larga escala como agente natural antimicrobiano. Os demais compostos
avaliados podem apresentar atividade em concentrações superiores variando de
0,7 a 3,7 x 103 μM (FIGURAS 1 e 2). É importante destacar que o controle
positivo, o antibiótico estreptomicina, apresentou uma excelente CIM,
0,000634 103 μM, porém a utilização do mesmo na agricultura é inviável, haja
vista que o mesmo pode acumular na planta, solo, plantações podendo causar
uma seleção de micro-organismos super-resistentes em seres humanos, animais
e vegetais.

Estruturas químicas dos compostos utilizados para ensaio antimicrobiano.
Determinação da concentração inibitória mínima das possíveis fitoalexinas frente à X. citri subsp. citri
Conclusões
Alguns compostos biossintetizados pela planta foram confirmados serem fitoalexinas. Devido a boas atividades, álcool feniletílico, salicilato de metila, eugenol, timol, benzoato de 2-etilhexila, 4-carboxaldeído, hesperidina e rutina podem ser promissores para inibir o crescimento da bactéria in vivo. Provavelmente, os dois últimos compostos são fitoanticipina na associação C. sinensis - X. citri subs.citri. Este trabalho abre caminhos para estudos futuros in vivo, no sentido de avaliar os compostos aromáticos como inibidores na presença de todas as enzimas ativas da planta. Efeitos de toxicidade dos mesmos na planta também podem ser elucidados.
Agradecimentos
Ao CNPq-INCT: 573742/2008-1; FAPESP-INCT: 08/57859-5; FAPESP-Bolsa de Pós- Doutorado: Processo 2014/18872-7 e ao Programa Novos Pesquisadores da PROPES/UFT pelos auxílios financeiros.
Referências
AGRIOS, G. N. How plants defend themselves against pathogens. Plant pathology. 4th ed. California: Academic Press. p. 93-114. 1997.
BAILEY, J. A.; MANSFIELD, J. W. (Eds) Phytoalexins. A Halsted Press Book. John Wiley and Sons. New York - Toronto, 334 p, 1982. ISBN 0-470-27291-0.
BRAGA, M. R. Fitoalexinas e a Defesa das Plantas. Texto disponível em http://www.sbq.org.br/filiais/adm/Upload/subconteudo/pdf/Texto4_Fitoalexinas%20e%20a%20Defesa%20das%20Plantas.pdf. Acessado em 06/02/14. 2008.
BRUNINGS, A. M.; GABRIEL, D. W. Xanthomonas citri: breaking the surface. Mol. Plant Patol. 4: 141-157, 2003.
Clinical and Laboratory Standards Institute. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically – Nine Edition. Approved Standard M7-A9, CLSI, Wayne, PA, 2012
DARVILL, A. G.; ALBERSHEIM, P. Phytoalexins and their elicitors-A defense against microbial Infection in plants. Annual Rev. Plant Biol. 35: 243-275, 1984.
DESJARDINS, A. E.; SPENCER, G. F.; PLATTNER, R. D.; BEREMAND, M. N. Furanocoumarin Phytoalexins, Trichothecene Toxins, and Infection of Pastinaca sativa by Fusarium sporotrichioides. Phytopat. 79: 170-175, 1989.
FALEIRO, F. G.; ANDRADE, S. R. M. Biotecnologia: estado da arte e aplicações na agropecuária. Embrapa Cerrados-Planaltina, DF. 2011. 730 p. : il.
GRAHAM, J. H.; GOTTWALD, T. R.; CUBERO, J.; ACHOR, D. S. Xanthomonas axonopodis pv. citri: fator affecting successful eradication of citrus canker. Mol. Plant Pathol. 5: 1-5, 2004.
GRAYER, R.J.; HARBORNE, J. B. A survey of antifungal compounds from higher plants. Phytochemistry. 37: 19-42, 1994.
NICULAU, E. S. Estudo químico de Xanthomonas citri subsp. citri e sua influência no perfil químico de Citrus sinensis. São Carlos, Departamento de Química – Universidade Federal de São Carlos, 2014. Tese de Doutorado, 182 p.
OSBOURN, A. E. Review. Antimicrobial phytoprotectans and fungal pathogens: a commentary. Fungal Gen. Biol. 26: 163-168, 1999.
RIBEIRO, A. B.; ABDELNUR, P. V.; GARCIA, C. F.; BELINE, A.; SEVERINO, V. G. P.; Da SILVA, M. F. G. F.; FERNANDES, J. B.; VIEIRA, P. C.; De CARVALHO, S. A.; De SOUZA, A. A.; MACHADO, M. A. Chemical Characterization of Citrus sinensis Grafted on C. limonia and the Effect of Some Isolated Compounds on the Growth of Xylella fastidiosa. J. Agric. Food Chem, 56: 7815-7822, 2008
SILVA, C. A. R. da. Efeito do cultivo consorciado na produtividade do repolho, viabilidade econômica do sistema e manejo de pragas. Dissertação de Mestrado: Faculdade de Agronomia e Medicina Veterinária, Universidade de Brasília, 2013, 113 p.
VANETTEN, H. D., MATTHEWS, D. E., MATTHEWS, P. S. Phytoalexin detoxification: importance for pathogenicity and practical implications. Ann. Rev. Phytopathol. 27: 143-164, 1989.
VAUTERIN, L.; HOSTE, B.; KERSTERS, K.; SWINGS, J. Reclassification of Xanthomonas. Intern. J. Syst. Bact. 45: 472-489, 1995.









