FILMES ELETROFIADOS DE QUITOSANA E POLI(ÓXIDO DE ETILENO) COM INCORPORAÇÃO DE CORANTES FLUORESCENTES
ISBN 978-85-85905-25-5
Área
Química Analítica
Autores
Guellis, C. (UNIOESTE) ; Dragunski, D.C. (UNIOESTE) ; Bariccatti, R.A. (UNIOESTE) ; Lindino, C.A. (UNIOESTE)
Resumo
Neste trabalho a eletrofiação foi empregada para obtenção de filmes de quitosana (Qt), a partir de misturas do biopolímero com poli(óxido de etileno) (PEO) em ácido acético 90% v/v. As melhores condições para a obtenção do filme foi da solução preparada a 2% m/v com proporção 90:10% m/m e eletrofiada a 18 kV e 18 cm. Para aplicação do filme obtido incorporou-se 2% em relação a massa dos polímeros, dos corantes alaranjado de acridina, eritrosina e fluoresceína sódica em soluções a serem eletrofiadas. Na análise de espectrofluorímetria o filme com alaranjado de acridina apresentou indícios de formação de excímero, pela presença de um pico de excitação em 569 nm. Além disso, comprovou-se a produção de filmes fluorescentes considerados bons candidatos a biomaterial.
Palavras chaves
biopolímero; blenda polimérica; fibras
Introdução
A eletrofiação é uma técnica relativamente antiga, mas que atualmente é bastante estudada. É um método para produzir fibras de micro a nano escala, capaz de formar filmes de elevada área superficial e alta porosidade (PAKRAVAN; HEUZEY; AJJI, 2011). Vista como uma técnica relativamente simples e versátil, a eletrofiação se baseia na aplicação de um campo elétrico entre o tubo capilar, contendo a solução polimérica e o coletor (VRIEZE et al., 2007; BIZARRIA; D’ÁVILA; MEI, 2014). Basicamente, o tubo, usualmente uma seringa, que contêm a solução do polímero, é acoplado a uma bomba de infusão e conectado ao eletrodo positivo pela agulha capilar acoplada à seringa. Uma vez aplicado o campo elétrico, este influencia a superfície líquida na ponta do capilar e ali são geradas cargas elétricas, as forças de repulsão aparecem e agem de forma oposta à tensão superficial e a gota pendente se deforma inicialmente no cone de Taylor. À medida que se tem um campo elétrico forte, em que as forças de repulsão eletrostática superam a tensão superficial do líquido, um jato de fluido é ejetado da ponta do cone. Conforme a densidade de carga no jato interage com o campo elétrico produzindo sua instabilidade, ocorre também a evaporação do solvente e as fibras são depositadas no coletor que está ligado ao eletrodo negativo (OHKAWA et a., 2004; GENG; KWON; JANG, 2005; VRIEZE et al., 2007; CORRADINI et al., 2017). Embora este processo seja relativamente simples, a produção das fibras depende dos diversos parâmetros de eletrofiação, tais como os de processo, diâmetro interno da agulha, distância desta e o coletor, vazão e tensão elétrica aplicada, os fatores ambientais, como temperatura e umidade relativa, e as propriedades do polímero e solução como concentração, massa molar, viscosidade, condutividade, tensão superficial, solvente e constante dielétrica (GENG; KWON; JANG, 2005; VRIEZE et al., 2007; HOMAYONI; RAVANDI; VALIZADEH, 2009). No que se refere ao polímero a ser utilizado, um grande número de origem natural ou sintética, com muitas aplicações e diferentes funcionalidades, veem sendo eletrofiados. No caso dos biopolímeros, um dos mais pesquisados em virtude de suas características de biodegradabilidade, biocompatibilidade e não toxicidade (KLOSSNER et al., 2008; LEMMA; BOSSARD; RINAUDO, 2016) é a quitosana. A quitosana é um polímero derivado da reação de desacetilação da quitina. A quitina, por sua vez, é um polissacarídeo linear, presente em crustáceos, insetos e fungos e é o segundo mais abundante na natureza após a celulose (CHEN et al., 2016). Estruturalmente a quitina é constituída predominantemente por unidades N-acetil-D-glicosamina e a quitosana por unidades D-glucosamina (DESAI et al., 2008; TORRES-GINER; OCIO; LAGARON, 2008; SENCADAS at al., 2012). A solubilidade da quitosana está diretamente relacionada ao grau de desacetilação, pH e a natureza do solvente. Este biopolímero é considerado insolúvel em soluções com pH maior ou igual a 6,5 (HOMAYONI; RAVANDI; VALIZADEH, 2009; SENCADAS at al., 2012) e na maioria dos solventes orgânicos convencionais (LI; HSIEH, 2006). Embora, mesmo em ácidos inorgânicos sua solubilidade seja bastante limitada, a quitosana com elevado grau de desacetilação é, de fato, solúvel em soluções diluídas de ácidos orgânicos (VRIEZE et al., 2007; HOMAYONI; RAVANDI; VALIZADEH, 2009). O meio ácido age de forma a protonar os grupos aminas livres desse polímero para formar um polieletrólito de caráter catiônico, motivo pelo qual apresenta maior solubilidade que sua precursora, a quitina (KLOSSNER et al., 2008; HOMAYONI; RAVANDI; VALIZADEH, 2009; LEMMA; BOSSARD; RINAUDO, 2016). No caso específico desse biopolímero, ainda são necessários estudos envolvendo sua fiação, devido à dificuldade em se obter micro e nanofibras de quitosana pura (PAKRAVAN; HEUZEY; AJJI, 2011; BIZARRIA; D’ÁVILA; MEI, 2014). Diante disso, na busca por contornar a dificuldade de eletrofiação da quitosana, muitos estudos vêm avaliando sua eletrofiação associada a outros polímeros, como o poli(oxido de etileno), PEO (PAKRAVAN; HEUZEY; AJJI, 2011; BIZARRIA; D’ÁVILA; MEI, 2014; LEMMA; BOSSARD; RINAUDO, 2016). O PEO é um homopolímero sintético de óxido de etileno. É um polímero termoplástico, semicristalino, que não presenta toxicidade, o que o torna aplicável nas indústrias farmacêuticas, alimentícia e de cosméticos, é solúvel em água e em diversos solventes orgânicos (BAILEY; KOLESKE, 1976; SONG et al., 2017). Embora a eletrofiação de soluções contendo apenas as macromoléculas tenha sido bastante pesquisada, a busca por novos materiais tem levado há um interesse crescente na incorporação de outros componentes a matriz polimérica. Assim, este trabalho teve como objetivo produzir filmes eletrofiados de quitosana e PEO com incorporação dos corantes fluorescentes alaranjado de acridina, eritrosina e fluoresceína sódica, visto o potencial que possuem para o desenvolvimento de novos materiais.
Material e métodos
Soluções de quitosana (Polymar, grau de desacetilação 85%, massa molar 47976,3 ± 1095,5 g mol-1) (SANTOS; BUKZEM; CAMPANA-FILHO, 2016) foram preparadas em ácido acético 90% v/v (Neon) nas concentrações de 2 e 4% m/v. Da mesma forma, soluções contendo quitosana e PEO (Sigma-Aldrich, massa molar 65000 g mol-1) foram preparadas em ácido acético 90% v/v, nas concentrações de 1 a 5% m/v, nas proporções 90:10 e 95:05% m/m (Qt:PEO). Para completa solubilização tais soluções permaneceram sob agitação magnética por 24 horas. Para eletrofiação utilizou-se um equipamento com bomba infusora da World Precision Instruments modelo sp100i syringe pump, fonte de alta tensão da marca Bertan modelo 30-R, coletor estático e seringa de vidro de 5 mL, com agulha hipodérmica de diâmetro 0,70 mm. Para produção do filme eletrofiado foram realizados testes variando a tensão em 15, 18, 21 e 23 kV e a distância em 15, 18 e 20 cm, com vazão a 0,5 mL h- 1. Para avaliação do diâmetro das fibras, fixou-se no coletor lâminas de microscópio para coleta de amostras. Tais experimentos foram realizados a 22 ± 05°C e 46 ± 05% de umidade. A avaliação da uniformidade das fibras foi realizada por microscópio ótico modelo CX31 com câmera SC30, ambos da marca Olympus e captura das imagens no software Analisis Get It®. Na determinação do diâmetro foi usado o software Quantikov Image Analyzer 10.1, no qual se mediu 10 diâmetros aleatórios em cada uma das 4 fotos tiradas para cada lâmina na objetiva de 100x /1,25. Definido os melhores parâmetros, preparou-se novas soluções de Qt:PEO a 2% m/v e proporção 90:10% m/m, para produção do filme e para incorporação de 2% em relação a massa dos polímeros dos corantes alaranjado de acridina (Biotec), eritosina (Vetec) e fluoresceína sódica (Vetec). Tais soluções foram igualmente agitadas por 24 horas. A análise morfológica dos filmes foi realizada com microscópio eletrônico de varredura (MEV) da FEI Company modelo Quanta 250 e metalizador Bal-tec SCD 005 Sputter Coater. O diâmetro das fibras foi determinado com o software Quantikov Image Analyzer 10.1, medindo-se 20 fibras nas imagens de 10000x-10 μm. As análises de espectroscopia de infravermelho com transformada de Fourier (FTIR) utilizando reflexão total atenuada, foram realizadas na região de 4000-550 cm-1, com resolução de 8 cm-1 e 8 varreduras, em espectrofotômetro da Perkin-Elmer. Na determinação do comprimento de onda de máxima absorção dos corantes, as soluções preparadas a 0,001% m/v em água destilada foram analisadas na faixa de 190-1100 nm, utilizando espectrofotômetro UV-Vis da marca Shimadzu, modelo UV-1800. Os espectros de refletância dos filmes eletrofiados foram igualmente obtidos no espectrofotômetro UV-Vis da Shimadzu, na faixa de 190-1100 nm. Os espectros de fluorescência foram obtidos em um espectrofluorímetro da marca Aminco, modelo SPF-500C, com lâmpada de descarga Xenon de 300 kW, abertura das fendas de excitação e emissão em 4 nm e alta voltagem da fotomultiplicadora em 800V.
Resultado e discussão
A eletrofiação das soluções de quitosana de 2 e 4% m/v, em ácido acético 90%
v/v, não resultou na formação de fibras. O que se obteve foram gotículas
pulverizadas depositadas no coletor. A visualização por microscopia ótica
mostrou claramente a formação de gotas e não de fibras. Alterações na
distância da agulha ao coletor e na tensão elétrica aplicada não resolveu
esse problema, nem melhorou a qualidade do produto formado. Tais resultados
corroboram com a literatura (LI; HSIEH, 2006; DESAI et al., 2008; PAKRAVAN;
HEUZEY; AJJI, 2011; BIZARRIA; D’ÁVILA; MEI, 2014), no que se refere a
dificuldade da produção de fibras eletrofiadas de soluções de quitosana.
Essa dificuldade em se eletrofiar quitosana é principalmente devido à alta
viscosidade de sua solução, que pode ser explicada pelas fortes ligações de
hidrogênio entre as cadeias poliméricas, que complexam o entrelaçamento das
mesmas e restringem sua mobilidade (DARBASIZADEH et al., 2018). Além disso,
as interações repulsivas entre os grupos NH_3^+ das moléculas desse
biopolímero aumentam a viscosidade da solução devido a uma expansão do seu
volume hidrodinâmico. Sob o alto campo elétrico, essas forças repulsivas
impendem a formação de fibras durante o estiramento do jato, o que resulta
na produção de gotículas no coletor (PAKRAVAN; HEUZEY; AJJI, 2011).
Em vista disso, e com base na literatura (KLOSSNER et al., 2008; PAKRAVAN;
HEUZEY; AJJI, 2011; BIZARRIA; D’ÁVILA; MEI, 2014; LEMMA; BOSSARD; RINAUDO,
2016), para a obtenção das fibras de quitosana fez-se necessário a
utilização do PEO junto a matriz polimérica, como aditivo facilitador de
formação de fibras. Tal escolha foi feita por poder se trabalhar com um
material capaz de ser diluído junto à solução de quitosana.
Para se determinar a concentração ideal da solução para obtenção das fibras,
preparou-se soluções de quitosana e PEO nas concentrações de 1, 2, 3, 4, e
5% m/v, em ácido acético 90% v/v. No caso do preparo dessas soluções nas
proporções de 90:10 e 95:05% m/m para quitosana e PEO, respectivamente, foi
devido ao objetivo de se produzir filmes eletrofiados com maior quantidade
do biopolímero.
Para definição dos melhores parâmetros de eletrofiação, levou-se em conta a
solução que apresentou menor desvio padrão relacionado à medida do diâmetro
das fibras por microscopia ótica. Tal análise estatística é capaz de indicar
a solução que permite a obtenção de fibras mais uniformes. Nesse caso, a
solução de 2% m/v com proporção 90:10% m/m e eletrofiada nos parâmetros de
18 kV e 18 cm, apresentou o melhor resultado com diâmetro médio e desvio
padrão de 0,8117 ± 0,0719 μm.
Com base nesses dados, foi produzido o filme eletrofiando-se 4 mL dessa
solução, sob as condições de 25 ± 05°C e 46 ± 05% de umidade. Após a
obtenção do filme polimérico, foram realizadas medidas de microscopia
eletrônica de varredura para melhor visualização das fibras.
De acordo com as imagens de MEV a eletrofiação produziu fibras sem a
presença de beads. A medida do diâmetro dessas fibras a partir da imagem com
ampliação de 10000x – 10 μm apontou diferença no diâmetro médio obtido pelas
imagens das duas técnicas de microscopia. O que antes era uma média de
0,8117 ± 0,0719 μm passou a ser com a nova medida 0,2855 ± 0,0508 μm, o que
melhor corrobora com os resultados obtidos por outros autores (ZHANG et al.,
2009; SENCADAS et al., 2012; BIZARRIA; D’ÁVILA; MEI, 2014; CHEN et al.,
2016).
Os estudos iniciais da incorporação dos corantes alaranjado de acridina,
eritrosina e fluoresceína sódica nas soluções de 2% m/v de quitosana e PEO
na proporção 90:10% m/m, foram bem-sucedidos, alteraram a coloração dos
filmes eletrofiados o que indica interações dos mesmos com os polímeros
(Figura 1).
A incorporação dos corantes não produziu mudanças na morfologia das fibras
eletrofiadas. As fibras formadas mostraram-se uniformes e sem a presença de
beads. No caso do diâmetro médio obteve-se os valores de 0,2472 ± 0,0436 μm,
0,2492 ± 0,0355 μm e 0,2558 ± 0,0424 μm para as fibras dos filmes obtidos
com alaranjado de acridina, eritrosina e fluoresceína sódica,
respectivamente.
De acordo com a análise de FTIR dos filmes eletrofiados com os corantes, a
inibição das bandas em 1551 cm-1 e 1407 cm-1, atribuídas ao grupo NH_3^+ no
filme eletrofiado sem os corantes (BRANCA et al., 2016; WANG et al., 2018),
é efeito da incorporação dos mesmos nos filmes. Este fato indica que a maior
interação dos corantes com os polímeros ocorreu com o grupamento amina da
quitosana. Como a proporção dos polímeros na solução é de 90:10% m/m, para
quitosana e PEO, respectivamente, tem-se a probabilidade de haver vários
grupamentos livres na quitosana que podem interagir com os corantes.
Nos espectros de absorção eletrônica dos corantes em solução aquosa
verificou-se que o alaranjado de acridina apresenta comprimento de onda de
máxima absorção em 491 nm (HUBENKO et al., 2018; KARMAKAR et al., 2019), a
eritrosina em 526 nm (XU et al., 2015; PEDRO et al., 2018) e a fluoresceína
sódica em 454 nm e 478 nm (ŁUKARSKA et al., 2018). No caso do alaranjado de
acridina, o aumento da concentração deste corante em solução altera o perfil
da banda de absorção que apresenta aumento relativo da intensidade em 470
nm, em comparação com 491 nm. Nessa situação, tal dependência da intensidade
com a concentração permite que estas bandas sejam atribuídas ao dímero (λmax
= 470 nm) e ao monômero (λmax = 491 nm) do corante, respectivamente
(MARKARIAN; SHAHINYAN, 2015; HUBENKO et al., 2018).
A comprovação da incorporação dos corantes nos filmes eletrofiados pode ser
verificada pelos espectros de refletância no UV-Vis (Figura 2a). Os filmes
com alaranjado de acridina, eritrosina e fluoresceína sódica apresentam,
respectivamente, refletância nos comprimentos de onda de 491 nm e 469, 541
nm e 505 nm, valores estes muito próximos a máxima absorção dos corantes em
solução, o que confirma a presença dos mesmos nos filmes eletrofiados. No
caso do filme eletrofiado com o alaranjado de acridina mudanças no perfil do
espectro de refletância podem ser indício da presença de agregados do
corante (HUBENKO et al., 2018; KARMAKAR et al., 2019).
Isto posto, tratando-se de estudos iniciais dos efeitos da incorporação dos
corantes nos filmes eletrofiados, verificou-se que os espectros de
fluorescência dos corantes eritrosina e fluoresceína sódica (Figura 2c/d)
são muito semelhantes às espécies em solução (SZABELSKI et al., 2009;
ŁUKARSKA et al., 2018). Por outro lado, os espectros de excitação de ambos
os corantes apresentaram perfis diferentes dos espectros de excitação e
absorção na solução. No filme o corante eritrosina apresenta λex em 543 nm e
λem em 575 nm que corresponde a λΔ de 32 nm. A fluoresceína sódica, por sua
vez, possui λex a 469 nm, λem a 548 nm e λΔ de 79 nm. Esta variação entre as
bandas de excitação e emissão corresponde ao deslocamento de Stokes. Esse
deslocamento é fundamental para aplicações do uso da fluorescência porque
permite a fácil detecção da sua emissão (PAVONI et al., 2014).
No caso do corante alaranjado de acridina tanto o espectro de emissão quanto
de excitação (Figura 2b) apresentaram grandes diferenças. Neste caso, a
banda de emissão com formato alargado pode ser indicativa da possível
formação de agregados, o que corrobora com o espectro de refletância do
filme. Além disso, a presença do pico de excitação em 569 nm, que
corresponde a emissão em 603 nm, é incomum. Como não foi observado bandas
nesse comprimento de onda no espectro de refletância do filme, este pico
pode ser indicativo da formação de excímero (dímero excitado), que poderia
ser comprovado com medidas do tempo de vida (HUBENKO et al., 2018).
Por fim, os resultados evidenciam a produção de filmes fluorescentes, o que
torna o material produzido particularmente útil para aplicações como
sensores flexíveis e sondas fluorescentes. Ademais, o uso desses corantes
tornar a produção bastante favorável, por se tratarem de produtos de fácil
acesso e de baixo custo.

Fotografias dos filmes eletrofiados com corantes alaranjado de acridina (a), eritrosina (b) e fluoresceína sódica (c).
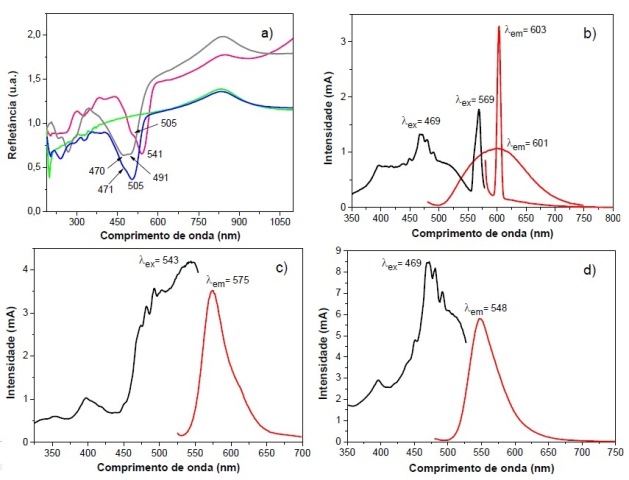
Espectros de refletância dos filmes obtidos com corantes (a) e espectros de fluorescência: b) alaranjado de acridina; c) eritrosina; d) fluoresceína.
Conclusões
Apesar da eletrofiação de soluções de quitosana se mostrar desafiadora, neste trabalho foi possível obter, a partir da otimização dos parâmetros, filmes eletrofiados de quitosana e PEO com alta proporção do biopolímero. A quitosana como componente biodegradável, biocompativel e assim como o PEO não toxica, possibilita que esse filme produzido possa ser um bom candidato a biomaterial para aplicações biomédicas, alimentícias e farmacêuticas. Ademais, a capacidade do filme eletrofiado ser trabalhado tornou possível a incorporação dos corantes fluorescentes, o que faz o material produzido útil para aplicações como sensores flexíveis e sondas fluorescentes. Além disso, a utilização do ácido acético como solvente proporciona aos filmes maior aplicabilidade, como também causa menor impacto ao ambiente, colaborando assim com os princípios da Química Verde.
Agradecimentos
Ao CNPq e CAPES pelo apoio financeiro.
Referências
BAILEY, F. E.; KOLESKE, J. V. Poly(ehtylene oxide). New York: Academic Press, 1976.
BIZARRIA, M. T. M.; D'ÁVILA, M. A.; MEI, L. H. I. Non-woven nanofiber chitosan/PEO membranes obtained by electrospinning. Brazilian Journal of Chemical Engineering, v. 31, n. 1, p. 57-68, mar. 2014.
BRANCA, C.; D'ANGELO, G.; CRUPI, C.; KHOUZAMI, K.; RIFICI, S.; RUELLO, G.; WANDERLINGH, U. Role of the OH and NH vibrational groups in polysaccharide-nanocomposite interactions: A FTIR-ATR study on chitosan and chitosan/clay films. Polymer, v. 99, p. 614-622, 2016.
CHEN, Q.; XIN, Z. X.; SAHA, P.; KIM, J. K. Fabrication of chitosan/PEO nanofiber mats with mica by electrospinning. Journal of Polymer Engineering, v. 37, n. 5, p. 1-10, jan. 2016.
CORRADINI, E.; CURTI, P. S.; GONZALEZ, R. S. G.; PEREIRA, A. G. B.; DRAGUNSKI, D. C.; MARTINS, A. F.; MUNIZ, E. C. Preparation of polymeric mats through electrospinning for technological uses. Recent advances in complex functional materials. Springer International Publishing, 2017.
DARBASIZADEH, B.; MOTASADIZADEH, H.; FOROUGHI-NIA, B.; FARHADNEJAD, H. Tripolyphosphate-crosslinked chitosan/poly (ethylene oxide) electrospun nanofibrous mats as a floating gastro-retentive delivery system for ranitidine hydrochloride. Journal of Pharmaceutical and Biomedical Analysis, v. 153, p. 63-75, maio 2018.
DESAI, K.; KIT, K.; LI, J.; ZIVANOVIC, S. Morphological and surface properties of electrospun chitosan nanofibers. Biomacromolecules, v. 9, n. 3, p. 1000-1006, mar. 2008.
GENG, X.; KWON, O.; JANG, J. Electrospinning of chitosan dissolved in concentrated acetic acid solution. Biomaterials, v. 26, n. 27, p. 5427-5432, set. 2005.
HOMAYONI, H.; RAVANDI, S. A. H.; VALIZADEH, M. Electrospinning of chitosan nanofibers: Processing optimization. Carbohydrate Polymers, v. 77, n. 3, p. 656-661, jul. 2009.
HUBENKO, K. O.; YEFIMOVA, S. L.; TKACHEVA, T. N.; MAKSIMCHUK, P. O.; SEDYH, O. O.; VIAGIN, O. G.; SOROKIN, A. V.; MALYUKIN, Y. V. Excimer emission of acridine orange adsorbed on gadolinium-yttrium orthovanadate nanoparticles. Journal of Fluorescence, v. 28, n. 4, p. 943-949, jun. 2018.
KARMAKAR, A.; BANERJEE, S.; SINGH, B.; MANDAL, N. C. Study of hydrogen bonding interaction of acridine orange with different acceptor molecules by spectroscopic, theoretical, and antimicrobial studies. Journal of Molecular Structure, v. 1177, p. 418-429, fev. 2019.
KLOSSNER, R. R.; QUEEN, H. A.; COUGHLIN, A. J.; KRAUSE, W. E. Correlation of chitosan’s rheological properties and its ability to electrospin. Biomacromolecules, v. 9, n. 10, p. 2947-2953, out. 2008.
LEMMA, S. M.; BOSSARD, F.; RINAUDO, M. Preparation of pure and stable chitosan nanofibers by electrospinning in the presence of poly(ethylene oxide). International Journal of Molecular Sciences, v. 17, n. 11, p. 1790-1805, out. 2016.
LI, L.; HSIEH, Y. Chitosan bicomponent nanofibers and nanoporous fibers. Carbohydrate Research, v. 341, n. 3, p. 374-381, fev. 2006.
ŁUKARSKA, M.; JANKOWSKA, A.; GAPIŃSKI, J.; VALABLE, S.; ANFRAY, C.; MÉNARD, B.; MINTOVA, S.; KOWALAK, S. Encapsulation of fluorescein into nanozeolites L and Y. Microporous and Mesoporous Materials, v. 260, p. 70-75, abr. 2018.
MARKARIAN, S. A.; SHAHINYAN, G. A. The effect of dimethylsulfoxide on absorption and fluorescence spectra of aqueous solutions of acridine orange base. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, v. 151, p. 662-666, dez. 2015.
OHKAWA, K.; CHA, D.; KIM, H.; NISHIDA, A.; YAMAMOTO, H. Electrospinning of chitosan. Macromolecular Rapid Communications, v. 25, n. 18, p. 1600-1605, set. 2004.
PAKRAVAN, M.; HEUZEY, M.; AJJI, A. A fundamental study of chitosan/PEO electrospinning. Polymer, v. 52, n. 21, p. 4813-4824, set. 2011.
PAVONI, J. F.; NEVES-JUNIOR, W. F. P.; SPIROPULOS, M. A.; ARAÚJO, D. B. Uma montagem experimental para a medida de fluorescência. Revista Brasileira de Ensino de Física, v. 36, n. 4, p. 4501-4509, dez. 2014.
PEDRO, M. F. C.; KALCK, A. S.; SANTOS, K. F.; SOUSA, M. S.; ROMIO, K. B.; SOUTO, P. C. S.; SILVA, J. R.; SOUZA, N. C. Immobilization of triclosan and erythrosine in layer-by-layer films applied to inactivation of microorganisms. Photodiagnosis and Photodynamic Therapy, v. 22, p. 158-165, jun. 2018.
SANTOS, D. M.; BUKZEM, A. L.; CAMPANA-FILHO, S. P. Response surface methodology applied to the study of the microwave-assisted synthesis of quaternized chitosan. Carbohydrate Polymers, v. 138, p. 317-326, mar. 2016.
SENCADAS, V.; CORREIA, D. M.; AREIAS, A.; BOTELHO, G.; FONSECA, A. M.; NEVES, I. C.; GOMEZ RIBELLES, J. L.; LANCEROS MENDEZ, S. Determination of the parameters affecting electrospun chitosan fiber size distribution and morphology. Carbohydrate Polymers, v. 87, n. 2, p. 1295-1301, jan. 2012.
SONG, Z.; CHIANG, S. W.; CHU, X.; DU, H.; LI, J.; GAN, L.; XU, C.; YAO, Y.; HE, Y.; LI, B.; KANG, F. Effects of solvent on structures and properties of electrospun poly(ethylene oxide) nanofibers. Journal of Applied Polymer Science, v. 135, n. 5, p. 45787-45796, set. 2017.
SZABELSKI, M.; ILIJEV, D.; SARKAR, P.; LUCHOWSKI, R.; GRYCZYNSKI, Z.; KAPUSTA, P.; ERDMANN, R.; GRYCZYNSKI, I. Collisional Quenching of Erythrosine B as a Potential Reference Dye for Impulse Response Function Evaluation. Applied Spectroscopy, v. 63, n. 3, p. 363-368, mar. 2009.
TORRES-GINER, S.; OCIO, M. J.; LAGARON, J. M. Development of active antimicrobial fiber‐based chitosan polysaccharide nanostructures using electrospinning. Engineering in Life Sciences, v. 8, n. 3, p. 303-314, jun. 2008.
VRIEZE, S.; WESTBROEK, P.; CAMP, T. V.; LANGENHOVE, L. V. Electrospinning of chitosan nanofibrous structures: feasibility study. Journal of Materials Science, v. 42, n. 19, p. 8029-8034, 2007.
WANG, P.; WANG, L.; DONG, S.; ZHANG, G.; SHI, X.; XIANG, C.; LI, L. Adsorption of hexavalent chromium by novel chitosan/poly(ethylene oxide)/permutit electrospun nanofibers. New Journal of Chemistry, v. 42, n. 21, p. 17740-17749, 2018.
XU, Z.; ZHENG, L.; YIN, Y.; WANG, J.; WANG, P.; REN, L.; EREMIN, S. A.; HE, X.; MENG, M.; XI, R. A sensitive competitive enzyme immunoassay for detection of erythrosine in foodstuffs. Food Control, v. 47, p. 472-477, jan. 2015.
ZHANG, J.; YANG, D.; XU, F.; ZHANG, Z.; YIN, R.; NIE, J. Electrospun core−shell structure nanofibers from homogeneous solution of poly(ethylene oxide)/chitosan. Macromolecules, v. 42, n. 14, p. 5278-5284, jul. 2009.









