ANALISE DE COMPONENTES PRINCIPAIS NA DETECÇÃO DE ADULTERAÇÃO EM MEL
ISBN 978-85-85905-25-5
Área
Química Analítica
Autores
Guellis, C. (UNIOESTE) ; Valerio, D.C. (UNIOESTE) ; Bessegato, G.G. (UNIOESTE) ; Boroski, M. (UNILA) ; Dragunski, J.C. (UNIOESTE) ; Lindino, C.A. (UNIOESTE)
Resumo
O mel é um alimento de alto valor agregado e um dos mais adulterados em produtos comerciais. Este trabalho descreve o uso de voltametria cíclica e espectrofotometria UV-vis, associadas à Quimiometria para detectar adulteração do mel com xarope de milho. Os dados de voltametria ciclica mostraram que as amostras de mel e de xarope apresentam pico anodico em +1,1 V, com diferentes intensidades de corrente. Um pico catodico a +0,42V foi obtido em velocidades de varredura mais altas, principalmente em amostras de xarope. Foram observados picos de absorvancia nos comprimentos de onda de 216 e 285 nm. As análises mostraram que é possível diferenciar entre amostras de mel e de xarope, assim como detectar adulterações simuladas, com uso mínimo de reagentes e possibilidade de analises in situ.
Palavras chaves
eletrodo de Cu/CuO; carboidratos; fraude
Introdução
O mel é o alimento natural com poder adoçante que tem o maior valor agregado no mercado e consiste em uma mistura de açúcares, principalmente glicose (em torno de 33%), frutose (em torno de 39%) e sacarose (em torno de 2%). Outros componentes incluem outros açucares, aminoácidos, minerais e proteínas. O conteúdo de água normalmente se situa entre 17 a 20% (CODEX, 2001). Enquanto que a produção mundial de mel é de 1.511.000 toneladas em 2016 (TRIDGE, 2019), o Brasil produziu 37.820 toneladas em 2015 (BRASIL, 2016). A adulteração do mel é um problema econômico e de saúde pública que ocorre no mundo inteiro (BERTELLI et al., 2010; FERREIRO-GONZÁLEZ et al., 2018; NAILA et al., 2018). As adulterações mais comuns referem-se à adição de xarope de milho, devido ao seu baixo custo de produção quando comparado ao mel, assim como a adição de melaço ou outros tipos de xarope (YILMAZ et al., 2014; NAILA et al., 2018). Estas adulterações são difíceis de serem detectadas principalmente devido a dificuldade de se diferenciar o conteúdo de açucares redutores naturalmente presente no mel daqueles intencionalmente inseridos com o propósito de fraude. A determinação de 5-hidroximetilfurfural como um indicador da adulteração não é confiável pois o tempo de estocagem e altas temperaturas, entre outros fatores, provocam alterações desta substância mesmo em méis não adulterados (BASAR e OZDEMIR, 2018). Yilmaz et al (2014) relataram diversos métodos analíticos utilizados na determinação de fraudes em mel, incluindo HPLC-MS (DONG et al., 2016); Ressonância Magnética Nuclear (BERTELLI et al., 2010); espectrofotometria na região do infravermelho (BASAR e OZDEMIR, 2018; FERREIRO-GONZÁLEZ et al., 2018) e kits portáteis (NAILA et al., 2018). Atualmente, técnicas eletroanalíticas também têm sido utilizadas. Sobrino-Gregorio et al., (2018) utilizaram voltametria de pulso em combinação com técnicas de análise multivariada para detectar e quantificar xarope de milho em mel, com rapidez, assim como Bougrini et al. (2016) que classificaram méis provenientes de diferentes regiões geograficas, verificando também a adulteração com xarope de milho, utilizando língua eletrônica e voltametria com eletrodos de ouro, prata e carbono vítreo. Em relação à reações de oxidação de carboidratos, eletrodos de Cu/CuO tem sido utilizados devido à suas propriedades eletrocatalíticas (PEREZ- FERNANDES et al., 2017; BARRAGAN et al. 2018). Nestes eletrodos, açucares redutores são oxidados em meio alcalino, sendo o aumento de corrente anodica proporcional à sua concentração, tornando estes eletrodos atrativos na aplicação em amostras de mel e verificação de possíveis adulterações. Neste trabalho utilizou-se voltametria cíclica com eletrodo de Cu/CuO combinado com a espectrofotometria UV-vis e análise de componentes principais (PCA) e analise de grupos hierárquicos (HCA) para obter um método rápido com a mínima geração de resíduos para detectar adulterações com xarope de milho em amostras de mel.
Material e métodos
Todos os reagentes utilizados foram de pureza grau para análise. A água utilizada no preparo de soluções foi destilada e purificada por osmose reversa (ADAMO). O eletrodo de Cu/CuO foi preparado a partir de cobre comercial (>99% de pureza), mecanicamente tratado com lixa 240 e lavado com água purificada em banho de ultrassom. Em seguida, em frasco de polipropileno, misturou-se 4,0 mL de solução de hidróxido de sódio a 10,0 mol L−1, 2,0 mL de solução de persulfato de amônia a 1,0 mol L−1 e 9,0 mL água purificada, imergindo o eletrodo de cobre nesta solução por uma hora (ZHANG et al. 2003). Em seguida, o eletrodo foi removido, lavado com água purificada e seco por três dias em dessecador com silica gel. A morfologia do filme de CuO formado foi caracterizado por microscopia eletrônica de varredura (MEV) e espectroscopia de energia dispersiva (EDS) em microscópio VEGA SB 15 kV. Para as medidas eletroquímicas utilizou-se o potenciostato Vertex Ivium, com eletrodo de referência de Ag/AgCl/KCl saturado e eletrodo de platina como eletrodo auxiliar, com NaOH 0,1 mol L−1 como eletrólito de suporte (JING et al., 2012; ARUL & JOHN, 2017; BARRAGAN et al., 2018). Seis amostras de mel e três amostras de xarope de milho foram obtidas do comercio local e estocadas protegidas da luz e em temperaturas entre 20,0 e 26,0°C. Os parâmetros de pH, umidade, condutividade elétrica, teor de açucares redutores e presença de hidroximetilfurfural (HMF) foram realizadas em triplicata (MORAES e TEIXEIRA, 1998; ZENEBON et al., 2008; LEMOS et al., 2010). Cada amostra de mel recebeu um código (H1 a H6) assim como as amostras de xarope (S1 a S3). Os voltamogramas cíclicos individuais das amostras de mel e de xarope (0,4% m/v base seca) e as misturas simuladas de mel:xarope (0, 25, 50, 75 e 100% mel) foram obtidos utilizando o Cu/CuO como eletrodo de trabalho, com eletrodo de referência de Ag/AgCl/KCl saturado e platina como eletrodo auxiliar em eletrólito de suporte de NaOH 0,1 mol L-1 na faixa de potenciais entre 0 e 1,1 V nas velocidades de varredura de 20, 50, 100, 150 e 200 mV s−1. Os espectros na região do UV-visível das amostras foram obtidos em espectrofotômetro duplo feixe Shimadzu UV-1800 PC (resolução de 0,1 nm) entre 200 e 800 nm. O software Action® for Excel e Chemoface 1.61® foram utilizados para as analises quimiometricas para diferenciar entre amostras de mel e de xarope e para as adulterações simuladas de mel com xarope de milho.
Resultado e discussão
Durante a síntese química do CuO, um filme de coloração azul é observado na
interface metal-solução, indicando a formação da espécie Cu(OH)2 (ZHANG et
al., 2003; ZOU et al., 2014; KONAR et al., 2016; BARRAGAN et al., 2018).
Esta espécie é metaestável e transforma-se em óxido de cobre, de coloração
preta, a partir da desidratação em condições controladas.
As imagens de microscopia eletrônica de varredura indicaram a presença de um
filme uniforme com uma estrutura tipo flower, também observada por Volanti
et al. (2008), Wang et al. (2010) e Momemi et al. (2016). A análise por EDS
indicou a presença dos elementos cobre e oxigênio com razão molar entre
cobre (80,0% massa) e oxigênio (20% massa) próxima da razão estequiométrica
molar. Wang et al. (2010), Simon et al. (2015) e Momemi et al. (2016)
obtiveram os mesmos resultados.
Os resultados da caracterização das amostras de mel e de xarope
mostraram que os valores de pH, condutividade elétrica e umidade estão de
acordo com a legislação brasileira e europeia (BRASIL, 2000; EU, 2001). Em
relação ao teor de HMF, duas amostras de mel e uma de xarope ultrapassaram
os níveis permitidos pela legislação brasileira (BRASIL, 2000) indicando
condições anteriores inadequadas de estocagem.
A voltametria cíclica dos méis mostrou um processo anodico
irreversível que é referente à oxidação de açucares redutores presentes em
sua composição. As amostras de xarope também apresentaram mesmo
comportamento eletroquímico, com diferença na intensidade de corrente. Todas
as amostras de mel e de xarope apresentaram comportamento similar. Segundo
Barragan et al. (2018), o mecanismo eletroquímico envolve a hidratação da
camada do óxido (CuO) por íons hidroxila em meio alcalino forte. As
características de semicondutor do Cu/CuO sugerem a formação de vacâncias e
espécies reativas que reagem com os carboidratos. Para as amostras de mel e
de xarope o processo eletroquímico de oxidação dos carboidratos é controlado
por difusão, como mostraram os gráficos de Ipa em função de v1/2 com R2 =
0,9972 e R2 = 0,9890 para mel e para xarope, respectivamente.
Um pico na varredura catodica em +0,42V foi observado com o aumento
na velocidade de varredura, provavelmente devido à reação de redução da
forma aldeído do isômero da glicose para sorbitol (PINTAURO et al., 1984). O
aumento na corrente de pico catodico é menos pronunciado no mel do que no
xarope devido ao menor conteúdo de glicose.
Os voltamogramas das misturas simuladas de amostras de mel e xarope
de milho na proporção de 0%, 25%, 50%, 75% e 100% m/m indicaram que a
corrente anódica a +1,1 V aumenta com o aumento da quantidade de mel na
mistura e a corrente catódica a +0,42 V aumenta ligeiramente com o aumento
da quantidade de xarope de milho na mistura.
O espectro molecular na região do UV-visível mostrou um pico intenso
em 216 nm para amostras de mel e de xarope, mas uma grande diferença na
intensidade de absorção foi observada no comprimento de onda de 285 nm sendo
alta para amostras de xarope e mínima para amostras de mel.
A análise de PCA foi aplicada às medidas voltamétricas e
espectrofotométricas. Como respostas para a análise de PCA foram escolhidas
as correntes de pico em +1,1 V e + 0,42 V (a 200 mV s-1) e absorbâncias a
285 e 216 nm.
A partir do gráfico de escore desta análise verificou-se que os dois
primeiros componentes principais juntos explicam 100,0% da variabilidade dos
dados, especificamente 97,81% pelo PC1 e 2,19% pelo PC2. A discriminação
entre méis e xaropes é determinada principalmente pelo eixo X (PC1), no qual
as amostras de mel estão no lado do gráfico de pontuação e os xaropes de
milho são colocados no outro lado. Isto indica que, para discriminar entre
mel e xarope, as medidas voltamétricas das amostras são suficientes para a
diferenciação entre elas, simplificando o processo de análise. Em velocidade
de varredura de 10 e 20 mV s-1, não há diferença nos valores de PC1 e PC2.
Na análise de PCA para as blendas, as respostas foram a corrente
anódica em +1,1 V; corrente catódica a +0,42 V e absorvância a 283 nm. O
gráfico de escore desta análise mostrou que os dois primeiros componentes
principais juntos explicam 100% da variabilidade dos dados, especificamente
97,81% pelo PC1 e 2,19% pelo PC2. Existe uma clara distinção entre os sinais
analíticos obtidos para as diferentes porcentagens de adulteração,
principalmente em relação às medidas de absorbância no comprimento de onda
de 283 nm, que é linear com o aumento da proporção de mel nas blendas (R2 =
0,9981 com equação da reta de A = 1,43273 - 0.01257 [% mel m/m]. Este
comportamento foi constante, independentemente do tipo de xarope de milho e
mel.
Para a análise hierárquica de agrupamentos (HCA), o Método de Ward foi
selecionado para a preparação de clusters e a distância Euclidiana quadrada
usada para medir as distâncias entre os clusters. Existe a tendência de as
amostras serem agrupadas de acordo com o tipo (mel ou xarope), Figura 1. O
dendrograma para as misturas mel: xarope mostra que é possível avaliar
facilmente a porcentagem de adulteração, Figura 2.
Os resultados deste estudo mostraram a viabilidade de um método de detecção
de adulteração de mel que permite análises rápidas e simples, permitindo
controle de qualidade e inspeção mais eficiente, evitando o consumo de
produtos que em longo prazo possam prejudicar a saúde humana, como relatado
por Samat et al. (2018) em que efeitos aparentes do consumo de mel
adulterado são registrados a partir do estudo de longo prazo, nos quais as
cobaias avaliadas mostraram aumento de peso, alterações nos parâmetros renal
e hepático, aumento de triglicerídeos circulantes, colesterol e glicose e
aumento da deposição de gordura.
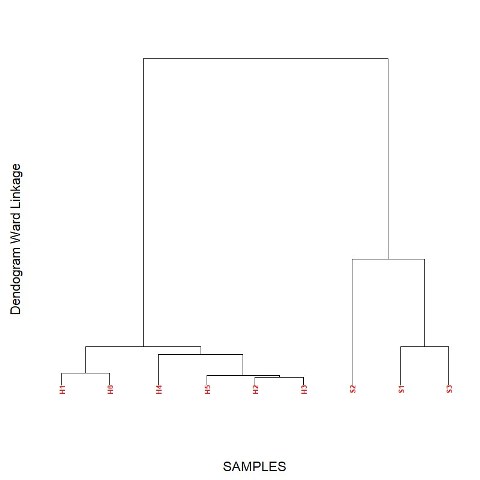
Dendograma das amostras de mel e xarope obtido a partir dos dados de voltametria cíclica e espectrofotometria.
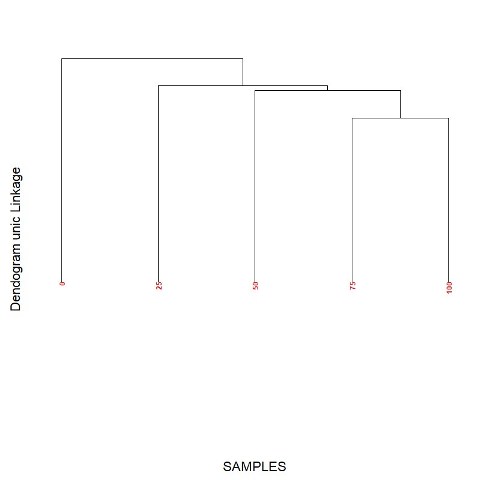
Dendograma das misturas de mel:xarope de milho obtida a partir de dados de voltametria cíclica e espectrofotometria.
Conclusões
Com este trabalho, mostrou-se que análises voltamétricas e espectrofotométricas podem ser aplicadas para identificar a presença de xaropes de milho no mel, indicando adulteração. O HCA e o PCA eram capazes de não apenas diferenciar os tipos de mel puro e xaropes puros, mas também de discriminar os méis aos quais os xaropes foram adicionados em níveis diferentes. As principais realizações deste método são a quantidade mínima de amostra necessária para a análise, a geração de resíduos que são inofensivos ao meio ambiente ou facilmente tratáveis. Além disso, a possibilidade de utilização de equipamentos portáteis permite tornar mais acessível a análise pelo setor da apicultura.
Agradecimentos
À CAPES, pela bolsa concedida.
Referências
ARUL, P.; JOHN, A. Electrodeposition of CuO from Cu-MOF on glassy carbon electrode: a non-enzymatic sensor for glucose. Journal of Electroanalytical Chemistry, 799, 61-69, 2017.
BARRAGAN, J. T. C.; KOGIKOSKI, Jr., S.; SILVA, E. T. S. G.; KUBOTA, L. T. Insight into the Electro-Oxidation Mechanism of Glucose and Other Carbohydrates by CuO-Based Electrodes. Anal. Chem., 90, 3357−3365, 2018.
BASAR, B.; ÖZDEMIR, D. Determination of honey adulteration with beet sugar and corn corn syrup using infrared spectroscopy and genetic-algorithm-based multivariate calibration. J Sci Food Agric., 98, 5616–5624, 2018.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Departamento de Inspeção de Produtos de Origem Animal. Instrução Normativa n. 11 de 20 de outubro de 2000. Regulação da Identidade e Qualidade do Mel. 2000.
BRASIL. Instituto Brasileiro de Geografia e Estatística – IBGE. Produção Agrícola Municipal em 2015. 2016.
BERTELLI, D.; MASSIMO, L.; PAPOTTI, G.; BORTOLOTTI, L.; SERRA, G., PLESSI, M. Detection of Honey Adulteration by Sugar Corn syrups Using One-Dimensional and Two-Dimensional High-Resolution Nuclear Magnetic Resonance. J. Agric. Food Chem., 58, 8495–8501, 2010.
BOUGRINI, M.; TAHRI, K.; SAIDI, T.; El HASSANI, N. A.; BOUCHIKHI, B.; El BARI, N. Classification of Honey According to Geographical and Botanical Origins and Detection of Its Adulteration Using Voltammetric Electronic Tongue Food Anal. Methods, 9, 2161–2173, 2016.
CODEX. Codex Alimentarius (2001) Draft revised standard for honey. Alinorm 01/25 19-26.
DONG, H.; LUO, D.; XIAN, Y.; LUO, H.; GUO, X.; LI, C.; ZHAO, M. Adulteration Identification of Commercial Honey with the C-4 Sugar Content of Negative Values by an Elemental Analyzer and Liquid Chromatography Coupled to Isotope Ratio Mass Spectroscopy. J. Agric. Food Chem., 64, 3258−3265, 2016.
EU. European Commission. European Commission Council Directive 2001/110/EC of 20 December 2001 relating to honey. Official Journal of the European Communities. 2002; 10–47.
FERREIRO-GONZÁLEZ, M.; ESPADA-BELLIDO, E.; GUILLÉN-CUETO, L.; PALMA, M.; BARROSO, C. G.; F. BARBERO, G. Rapid quantification of honey adulteration by visible-near infrared spectroscopy combined with chemometrics. Talanta, 188, 288–292, 2018.
JING, T.; ZHOU, Y.; HAO, Q.; ZHOU, Y.; MEI, S. A nano-nickel electrochemical sensor for sensitive determination of chemical oxygen demand. Analytical Methods, 4, 1155-1159, 2012.
KONAR, S.; KALITA, H.; PUVVADA, N.; TANTUBAY, S.; MAHTO, M. K.; BISWAS, S.; PATHAK, A. Shape-dependent catalytic activity of CuO nanostructures. Journal of Catalysis, 336, 11–22, 2016.
LEMOS, G. S.; SANTOS, J. S.; SANTOS, M. L. P. Validação de método para determinação de 5-Hidroximetilfurfural em mel por cromatografia líquida e sua influência na qualidade do produto. Química Nova, 33, 1682–1685, 2010.
MOMENI, M. M.; MIRHOSSEINI, M.; MOHAMMADI, N. Efficient photo catalytic degradation of methyl orange over Ag–CuO nanostructures grown on copper foil under visible light irradiation. Journal of Materials Science: Materials in Electronics, 27, 6542–6551, 2016.
MORAES, R.M.; TEIXEIRA, E.W. Análise do Mel. Manual Técnico. Centro de Apicultura Tropical, 1998. 41p.
NAILA, A.; FLINT, S. H.; SULAIMAN, A. Z.; AJIT, A.; WEEDS, Z. Classical and novel approaches to the analysis of honey and detection of adulterants. Food Control, 90, 152-165, 2018.
PÉREZ-FERNÁNDEZ, B.; MARTÍN-YERGA, D.; COSTA-GARCÍA, A. Galvanostatic electrodeposition of copper nanoparticles on screen-printed carbon electrodes and their application for reducing sugars determination. Talanta, 175, 108–113, 2017.
PINTAURO, P. N.; JOHNSON, D. K.; PARK, K.; BAIZER, M. M.; NOBE, K. The paired electrochemical synthesis of sorbitol and gluconic acid in undivided flow cells. I. Journal of Applied Electrochemistry, 14, 209-220, 1984.
SAMAT, S.; ENCHANG, F. K.; RAZAK, A. A.; HUSSEIN, F. N.; ISMAIL, W. I. W. Adulterated Honey Consumption can Induce Obesity, Increase Blood Glucose Level and Demonstrate Toxicity Effects. Sains Malaysiana, 47, 353-365, 2018.
SIMON, I. A.; MEDEIROS, N. G.; GARCIA, K. C.; SOARES, R. M. D.; ROSA, A. T.; SILVA, J. A. CuO nanofibers immobilized on paraffin-impregnated graphite electrode and its application in the amperometric detection of glucose. Journal of the Brazilian Chemical Society, 26, 1710–1717, 2015.
SOBRINO-GREGORIO, L.; BATALLER, R.; SOTO, J.; ESCRICHE, I. Monitoring honey adulteration with sugar syrups using an automatic pulse voltammetric electronic tongue. Food Control, 91, 254-260, 2018.
TRIDGE. Honey. 2019. Disponível em: https://www.tridge.com/intelligences/honey/production. Acesso em 12 de Jun 2019.
VOLANTI, D. P; KEYSON, D; CAVALCANTE, L. S; SIMÕES, A. Z; JOYA, M. R; LONGO, E; VARELA, J.A; PIZANI, P. S; SOUZA, A.G. Synthesis and characterization of CuO flower nanostructure processing by a domestic hydrothermal microwave. Journal of Alloys and Compounds, 459, 537–542, 2008.
YILMAZ, M. T.; TATLISU, N. B.; TOKER, O. S.; KARAMAN, S.; DERTLI, E.; SAGDIC, O.; ARICI, M. Steady, dynamic and creep rheological analysis as a novel approach to detect honey adulteration by fructose and saccharose corn syrups: Correlations with HPLC-RID results. Food Res. Int., 64, 634−646, 2014.
WANG, X.; HU, C.; LIU, H., DU, G.; HE, X.; XI, Y. Synthesis of CuO nanostructures and their application for nonenzymatic glucose sensing. Sensors and Actuators B 144, 220–225, 2010.
ZENEBON, O.; PASCUET, N.S.; TIGLEA, P. Métodos físico-químicos para Análise de Alimentos. 4.ed. São Paulo: Instituto Adolfo Lutz, 2008. 1020p.
ZHANG, W.; WEN, X.; YANG, S.; BERTA, Y.; WANG, Z. L. Single-crystalline scroll-type nanotube arrays of copper hydroxide synthesized at room temperature. Advanced Materials, 15, 822–825, 2003.
ZOU, Y.; LI, Y.; LIAN, X.; AN, D. Preparation and characterization of flower-shaped CuO nanostructures by complex precipitation method. Research of Materials Science, 3, 44–51, 2014.









