AVALIAÇÃO DA CAPACIDADE FOTOCATALÍCA DO ÓXIDO MODIFICADO SrZrxSn1-xO3 QUANTO A DEGRADAÇÃO DA MICROCISTINA-LR EM ÁGUAS
ISBN 978-85-85905-25-5
Área
Química Analítica
Autores
Monteiro, G.F. (UEPB) ; Ramo, L.B. (UEPB) ; Silva, A.G. (UEPB) ; Silva Júnior, E.P. (UEPB) ; Pereira, C.X. (UEPB) ; Martins, G.C. (UEPB) ; Torres, C.S. (UEPB) ; Locio, L.L. (UEPB) ; Alves, M.C.F. (UEPB) ; Simões, S.S. (UEPB)
Resumo
Microcistinas (MC-LR) são hepatotoxinas presentes em reservatórios que podem causar problemas à saúde. Este trabalho objetivou avaliar a performance do óxido modificado SrZrxSn1-xO3 quanto a degradação da MC-LR em água. Os testes fotocatalíticos foram desenvolvidos utilizando um planejamento do tipo Box Behnken, variando 3 fatores em 3 níveis, tendo a diminuição na % de toxicidade como variável dependente. Os resultados obtidos mostraram uma diminuição de 86,11% da citotoxicidade da solução produto da fotocatálise em relação a solução que não foi submetida a este processo. Deste modo, verificou-se que utilização das perovskitas com as maiores modificações estruturais apresentaram uma maior diminuição na toxicidade da solução contaminada.
Palavras chaves
Microcistina-LR; Fotodegradação; Box Behnken
Introdução
A região nordeste do Brasil possui longos períodos de seca, sendo necessário o acúmulo de águas em reservatórios para o abastecimento da população. No entanto, devido as grandes evaporações e pelo acúmulo de poluentes ocorre o processo de eutrofização, causando as florações de fitoplâncton (SILVA, 2015). A biomassa fitoplanctônica é constituída por “blooms” de cianobactérias, que produzem uma variedade de cianotoxinas, tais como hepatotoxinas, neurotoxinas, dermatotoxinas e citotoxinas que causam sérios problemas a saúde e alteraram a qualidade da água, ocasionando um sabor e odor desagradáveis, além de prejudicar todo o ecossistema aquático, bem como os seres humanos (CARMICHAEL, 1997; CHEUNG, LIANG, LEE, 2013). Dentre as cianotoxinas mais estudadas, encontram-se as Microcistinas (MCs), que são hepatoxinas heptapeptídicas cíclicas. Esta toxina é produzida principalmente pela Microcystis aeruginosa, entretanto outras espécies de cianobactérias também contribuem para a presença das MCs nos ambientes aquáticos, tais como Anabaena, Oscillatoria, Plankothrix, Chroococcus e Nostoc (PEARSON et al., 2010; ZHOU et al.., 2013). As microcistinas são compostas por sete aminoácidos, sendo cinco fixos e dois variáveis, totalizando aproximadamente 100 diferentes tipos desta cianobactéria, sendo a mais tóxica a Microcistina-Leucina, Arginina (MC-LR). Esta endotoxina fica no interior das células bacterianas, entretanto são liberadas pela senescência e lise celular, ficando dissolvidas nas águas dos reservatórios (ALTANER et al., 2017; ZHANG et al., 2009). Segundo Carmichael (2001), um caso de grande repercussão no Brasil envolvendo as microcistinas, principalmente a variante LR, está relacionado à morte por hepatite tóxica de aproximadamente 50 pessoas em uma clínica de hemodiálise em Caruaru-PE. Assim, o Ministério da Saúde do Brasil, através da Portaria N° 2914/2011 estabeleceu um valor máximo aceitável de 1,0 μg.L-1 de MC-LR em água para consumo humano (BRASIL, 2011). Embora as Estações de Tratamento de Água e Esgotos (ETAS e ETES) venham empregando diversos procedimentos para a remoção das cianotoxinas, como a coagulação ou floculação, sedimentação, filtração e desinfecção, os mesmos não têm sido suficientes, já que conseguem eliminar apenas as toxinas dissolvidas. Além disto, estas técnicas podem promover a lise celular, liberando mais MC-LR em água (HE et al., 2017). Diante do exposto, é importante o desenvolvimento de metodologias que possam substituir ou complementar a ação daquelas utilizadas pelas ETAS e que sejam mais eficazes na remoção da MC-LR. Nas últimas décadas os Processos Oxidativos Avançados (POAs) têm se destacado no desenvolvimento de tecnologias para o tratamento de águas residuais. A eficiência dos POAs depende da geração de radicais livres reativos, sendo o mais importante o radical hidroxila (ARAÚJO et al., 2016). Conforme revela Silva (2015), os POAs são classificados de acordo com a fase do catalisador (homogênea ou heterogênea), bem como através da necessidade da presença ou ausência da radiação UV no processo de degradação. Para o autor, a oxidação de compostos orgânicos ocorre devido ao alto poder de oxidação das hidroxilas para gerar produtos não-tóxicos, como CO2 e H2O. Os catalisadores heterogêneos utilizam além da radiação UV, semicondutores geralmente na forma sólida. Dentre estes, encontram-se os óxidos mistos com estrutura ABO3, denominados de peroviskitas, que tem sido muito utilizado pelos pesquisadores, pois apresentam rendimentos satisfatórios nos processos de degradação de poluentes orgânicos (SUN, LIU, LI, 2011). Nessa perspectiva, o presente trabalho teve por objetivo avaliar performance dos óxidos modificados do tipo SrZrxSn1-xO3 quanto a capacidade de fotodegradação da microcistina-LR em águas e a citotoxicidade do produto da reação fotocatalítica.
Material e métodos
Os experimentos foram realizados no Laboratório de Química Sanitária e Ambiental (LAQUISA) da Estação Experimental de Tratamento Biológico de Esgotos Sanitários (EXTRABES), em Campina Grande-PB. O cultivo da Microcystis aeruginosa, produtora da microcistina-LR, foi realizado baseado no método Estático ou Batch (UTHERMÖHL, 1958) pelo LAQUISA, a partir de cepa fornecida pelo Departamento de Botânica da UFSCAR. O cultivo foi lisado, pelo congelamento e descongelamento consecutivo para promover a ruptura celular e liberação da toxina para o meio líquido. Após a lise, foi realizada a extração da microcistina-LR por centrifugação a 3.600 rpm em Centrífuga Baby 206-Fanem. Em seguida procedeu-se a extração em fase sólida (EFS) empregando cartuchos de octadecilsilano (C18), para purificar e concentrar o analito de interesse. A concentração da MC-LR do extrato resultante foi determinada por Cromatografia Liquida de Alta Eficiência Acoplada a Espectrometria de Massas. Os óxidos modificados foram sintetizados utilizando o método dos precursores poliméricos, baseado no método de Pechini (ALVES et al., 2009). Os materiais resultantes das sínteses foram caracterizados por difração de raio X, espectroscopia UV-vis e espectroscopia Raman. Para avaliação da performance dos óxidos modificados utilizou-se planejamento Box Behnken, variando-se simultaneamente 3 fatores, a massa do óxido (0,1; 0,2 e 0,3g), o tempo de exposição à radiação UV (5, 9, 16h) e a estequiometria do óxido (SrZr0,75Sn0,25O3; SrZr0,50Sn0,50O3; SrZr0,25Sn0,75O3) em três níveis (mínimo, intermediário e máximo). A variável dependente analisada foi a porcentagem de hemólise. Para a realização dos testes fotocatalíticos, foi preparada uma solução estoque de MC-LR com concentração da toxina de aproximadamente 3 µg L-1, a partir da diluição de 170 mL da MC-LR semipurificada com concentração de 8µg.L-1 em 1 L de água destilada. Em seguida estas soluções foram divididas em alíquotas de 50 mL, colocadas em recipientes de vidro, e a estas foi adicionada a quantidade adequada de óxido. Esses recipientes foram colocados em um reator fotocatalítico e expostos a radiação UV pelo tempo adequado. Ao final foram realizados os testes de atividade hemolítica, para avaliar a toxicidade do produto da degradação. Os testes de hemólise foram realizados em eritrócitos humanos frescos (tipo O+). Assim, adicionou-se 2 mL da solução de MC-LR diluída e 2 mL da solução de hematócrito em um tubo de ensaio, deixando a solução incubadas durante 1h. Os testes foram realizados em triplicata e o ácido acético a 5% LT foi utilizado como droga hemolítica padrão. A hemoglobina libertada foi monitorada através da medição da absorbância em 540 nm no espectrofotômetro. O tratamento estatístico dos dados obtidos foi realizado utilizando o software Statistica®, versão 10 da StatSoft.
Resultado e discussão
Em relação a caracterização dos óxidos obtidos, os espectros de Difração de Raios X (DRX) dos padrões de óxidos modificados SrZrxSn1-xO3 apresentaram picos bem definidos, além da fase principal estrutura da perovskita ortorrômbica (Pbnm). As fases formadas foram confirmadas por meio da indexação dos picos utilizando fichas cristalográfica JCPDS 01-070-4389 (SrSnO3) e 00-044-0161 (SnZrO3). Observou-se ainda a formação de fase secundária com a presença de picos referentes ao carbonato de estrôncio, em torno de 25,3°; 36,2°; 44,2° e 50,0°. Nesse sentido, notou-se que a substituição de Sn4+ por Zr4+ no sítio B eleva o grau da distorção das peroviskitas, devido ao aumento do tamanho do cátion B na estrutura, o que foi evidenciado pelo descolamento dos picos para maiores valores de teta. Este tipo de comportamento pode estar relacionado com uma maior desordem no sistema cristalino a longo alcance, devido ao rearranjo do cátion no sítio do octaedro dos óxidos modificados. (TARRIDA, LARGUEM e MADON, 2009). Os resultados dos espectros do Raman (figura 1) revelaram que as amostras puras de SrZrO3 e SrSnO3 apresentam modos ativos típicos de perovskitas do tipo ortorrômbicas com 24 modos ativos no Raman, porém não são observados todos os modos devido à sobreposição de alguns modos previstos ou baixa polarizabilidade das ligações químicas (ZHANG, TANG e YE, 2006; TARRIDA, LARGUEM e MADON, 2009; NAKAMOTO, 1986).
Verificou-se a partir dos espectros de UV-Vis que o aumento da quantidade do cátion substituinte no sistema modificado SrZrxSn1-xO3 levou a um aumento nos valores de energia de “band gap” dos óxidos sintetizados, devido a substituição de forma gradativa do cátion Sn4+, de tamanho menor por Zr4+ de tamanho maior, nos sítios dodecaedro e octaedro na estrutura perovskita ortorrômbica, confirmando o que foi observado nos espectros de Raman, a qual a modificação SrZr0,25Sn0,75O3 apresenta uma maior grau de assimetria, devido a presença de maior números de modos ativos no Raman (TARRIDA, LARGUEM e MADON, 2009; ZHANG, TANG e YE, 2006; UDAWATTE, KAKIHANA e YOSHIMURA, 2000).
A atividade fotocatalítica dos óxidos obtidos foi avaliada a partir dos experimentos definidos pelo planejamento Box Behnken, o qual foi avaliado como resposta a citotoxicidade da solução após os experimentos de degradação fotocatalítica da MC-LR pelo óxido modificado.
Quanto à avaliação estatística dos dados obtidos, pode-se observar a partir do gráfico de Pareto e da estimativa dos efeitos, que os fatores individuais não foram significativos. No entanto, as interações da massa quadrática com o tempo linear e da massa quadrática com a estequiometria linear se mostraram significativos. Os óxidos que mostraram melhor performance foram aqueles com a maior modificação estrutural (níveis mínimo e máximo da estequiometria).
O modelo, definido pela equação 1, considerou as variáveis de maneira linear e quadrática separadamente, bem como suas respectivas interações (CAN, KAYA, ALGUR, 2006). O coeficiente de determinação para este modelo foi de R2=0,98033 e R2 ajustado=0,86228, indicando que apenas 1,967% da variação total não foi explicada pelo mesmo. O alto valor de R2 demonstra a alta significância do modelo e a boa relação entre as variáveis dependentes e independentes. O valor de R2 ajustado é menor que R2, o que pode estar relacionado ao pequeno tamanho da amostra, bem como com a pouca quantidade de termos no modelo (YETILMEZSOY, DEMIREL, VANDERBEI, 2009).
Y = 74,30 – 6,11X1 – 1,50X12 + 1,20X2 + 0,85X22 + 1,20X3 – 6,36X32 + 3,89X1X2 + 5,83X1X22 – 11,53X12X22 – 5,55X1X3 – 9,86X12X3 – 4,17X2X3 (Equação 1).
Onde: Y é a resposta avaliada e X1, X2 e X3 representam as variáveis independentes massa, tempo e estequiometria, respectivamente.
A figura 2, mostra as superfícies de resposta relativas à interação de massa quadrática com tempo linear (a e b) e massa quadrática com estequiometria linear (c e d) para os óxidos com maior desordem estrutural, SrZr0,25Sn0,75O3 e SrZr0,75Sn0,25O3 respectivamente.
Os óxidos que apresentaram melhor performance fotocatalítica foram aqueles modificados com a maior variação na proporção zircônia:estanho em sua composição. De acordo com os valores obtidos no teste de hemólise das soluções resultantes dos testes fotocatalíticos, estes óxidos foram os que levaram a uma maior diminuição na porcentagem de hemólise das soluções contendo a cianobactéria. De acordo com estes e a análise estatística dos dados, foi constatado que a utilização de 0,2000g do óxido SrZr0,75Sn0,25O3 por 5h de exposição à radiação UV apresentou uma maior diminuição na citotoxicidade da microcistina-LR (86,11%). Em contrapartida, a utilização de 0,3000g do óxido modificado SrZr0,50Sn0,50O3por 5h apresentou uma menor diminuição na toxicidade do produto de degradação da cianobactéria (58,89%).
Os resultados obtidos neste trabalho estão de acordo com os obtidos por Klafke (2016), que demonstrou que a atividade fotocatalítica dos óxidos modificados estudados está relacionada com a sua desordem estrutural que favorece a migração dos elétrons na rede cristalina e consequentemente a formação do par elétron/buraco na superfície do catalisador, favorecendo suas propriedades fotocatalíticas. De fato, de acordo com a literatura (ZANG, TANG, YE, 2006; MOUNTSTEVENS, ATTFIELD, REDFERN, 2003), a maior competição simultânea entre os diferentes cátions B nos sítios octaedros, que promoveram diferentes níveis de polarizabilidade eletrônica na estrutura ortorrômbica do óxido, conforme comprovado pelas análises de espectroscopia Raman.
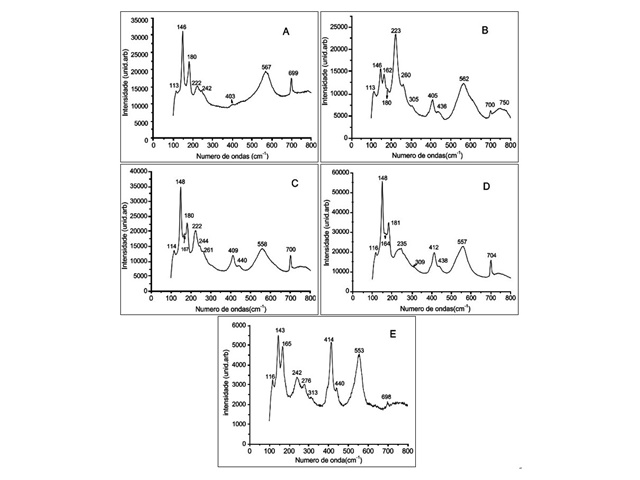
Espectros Raman dos óxidos modificados.
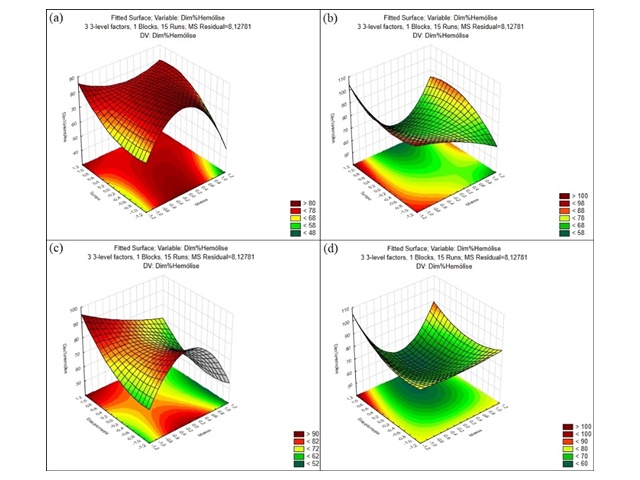
Gráficos de superfície de resposta
Conclusões
Os óxidos modificados do tipo SrZrxSn1-xO3 sintetizados, pelo método dos precursores poliméricos baseado no método de Pechini, caracterizados por meio de técnicas instrumentais como espectroscopia Raman e difratometria de Raio X. A partir destas análises pode-se concluir que a perovskita SrZrxSn1-xO3 foi obtida com êxito. A formação das fases cristalinas foi confirmada pela indexação dos picos utilizando as fichas cristalográficas JCPDS 00-044-0161 (ZrSnO3) e 01-077-1798 (SrSnO3). De acordo com os testes fotocatalíticos, os quais variou-se de forma multivariada os parâmetros massa de óxido, tempo de exposição e estequiometria do óxido e monitorou-se a variável dependente porcentagem de diminuição da hemólise da solução contendo MC-LR antes e após a fotocatálise, bem como a análise estatísticas dos dados, foi possível observar que os óxidos que possuem a melhor performance fotocatalítica são aqueles que possuem a maior desordem estrutural. Deste modo, a maior diminuição na porcentagem de hemólise foi obtida quando se utilizou 0,2000g do óxido SrZr0,75Sn0,25O3 por 5h de exposição à radiação UV, onde foi alcançada 86,11% de diminuição hemólise da solução contendo a MC-LR. Os resultados obtidos corroboraram com o comportamento observado nos espectros Raman e no DRX, evidenciando a composição SrZr0,75Sn0,25O3 como a de melhor performance fotocatalítica, o que está relacionado a desordem em sua estrutura. Deste modo, pode-se concluir que o óxido modificado SrZr0,75Sn0,25O3 possui eficiência para a degradação da MC-LR em águas e que o produto gerado após a fotocatálise tem uma toxicidade menor que a solução inicial.
Agradecimentos
CAPES, CNPQ, EXTRABES/UEPB
Referências
ALVES. M. C. F.; SOUZA, S.C.; LIMA, H, H. S.; NASCIMENTO, M. R.; SILVA, M. R. S.; ESPINOSA, J. W. M.; LIMA, S. J. G., LONGO, E.; PIZ ANI, P. S.; SOLEDADE, L.E. B.; SOUZA, A. G.; SANTOS, I. M. G. Synthesisof CaSnO3-SrSnO3thinfilmsbychemicalsolutiondeposition. Journal of Alloys Compounds, v.476, p. 507-512, 2009.
ALTANER, S.; PUDDICK, J.; WOOD, S. A.; DIETRICH, D. R. Adsorption of ten microcystin congeners to common laboratory-ware is solvent and surface dependent. Toxins, v. 9, n. 4, p. 1–15, 2017.
ARAÚJO, K. S. DE; ANTONELLI, R.; GAYDECZKA, B.; GRANATO, A. C.; MALPASS, G. R. P. Perfis cognitivos de crianças e adolescentes com dislexia na WISC-III. Arquivos Brasileiros de Psicologia, v. 66, n. 2, p. 17–35, 2016.
BRASIL, MINISTÉRIO DA SAÚDE, Portaria nº 2.914 de 12 de dezembro de 2011. Dispõe sobre os procedimentos de controle e de vigilância da qualidade da água para o consumo humano e seu padrão de potabilidade. Brasília: Diário Oficial da União, 2011.
CAN, M. Y., KAYA, Y., ALGUR, O. F. Response surface optimization of the removal of nickel from aqueous sulution by cone biomass of Pinus sylvestris. Bioresour. Technol., v. 97, p. 1761-1765, 2006.
CARMICHAEL, W. The cyanotoxins. Advances in Botanical Researc, v. 27, n. 1, p. 211–256, 1997.
CARMICHAEL, W. W. Health effects of toxin-producing cyanobacteria: “The cyanohabs”. Human and Ecological Risk Assessment, v. 7, n. 5, p. 1393–1407, 2001.
CHEUNG, M. Y.; LIANG, S.; LEE, J. Toxin-producing cyanobacteria in freshwater: A review of the problems, impact on drinking water safety, and efforts for protecting public health. Journal of Microbiology, v. 51, n. 1, p. 1–10, 2 fev. 2013.
HE, X.; STANFORD, B. D.; ADAMS, C.; ROSENFELDT, E. J.; WERT, E. C. Varied influence of microcystin structural difference on ELISA cross-reactivity and chlorination efficiency of congener mixtures. WaterResearch, v. 126, p. 515–523, dez. 2017.
KLAFKE, Y. R. Avaliação da permormance do sistema de fotocatalisadores SrZrxSn1-xO3 destinados a degradação do corante remazol amarelo ouro utilizando planejamentos experimentais. 93 p., 2016. Dissertação (Mestrado em Ciência e Tecnologia Ambiental), Universidade Estadual da Paraíba, Campina Grande.
MOUTSTEVENS, E. H., ATTFIELD, J. P., REDFERN, S. A. T. Cation-size control of structural phase transitions in tin perovskites. J. Phys, v. 15, p. 8315-8326, 2003.
NAKAMOTO, K. Infrared and Raman spectra of inorganic and coordination compounds. 4 ed. Nova Jersey: Wiley, 1986.
PEARSON, L.; MIHALI, T.; MOFFITT, M.; KELLMANN, R.; NEILAN, B. On the chemistry, toxicology and genetics of the cyanobacterial toxins, microcystin, nodularin, saxitoxin and cylindrospermopsin. Marine Drugs, v. 8, n. 5, p. 1650–1680, 2010.
SILVA, A. G. da. Avaliação do pH de oxidação do processo fenton na remoção de microcistina-LR de água de abastecimento. 102 p., 2015. Dissertação (Mestrado em Ciência e Tecnologia Ambiental), Universidade Estadual da Paraíba, Campina Grande.
SUN, Y.; LIU, J.; LI, Z. Design of highly ordered Ag-SrTiO3 nanotube arrays for photocatalytic degradation of methyl orange. Journal of Solid State Chemistry, v. 184, n. 8, p. 1924–1930, 2011.
TARRIDA, M.; LARGUEM, H.; MADON, M. Structural investigations of (Ca, Sr) ZrO3 and Ca (Sn, Zr) O3 perovskite compounds. Phys Chem Minerals, v. 36, p. 403–413, 2009.
UDAWATTE, C. P.; KAKIHANA, M.; YOSHIMURA, M. Low temperature synthesis of pure SrSnO and the (Bax Sr1-x)SnO3 solid solution by the polymerized complex method. Solid State Ionics, v. 128, p. 217–226, 2000.
UTERMÖHL, H. ZurVervollkommnung der quantitativen Phytoplankton Methodik. 9. ed. Stuttgart, Germany: Schweizerbart Science Publishers, 1958.
YETILMEZSOY, K., DEMIREL, S., VANDERBEI R. J. Response suface modeling od Pb(II) removal from aqueous solution by pistaciavera L.:Box-Benhken experimental desing. Journal of Hazardous Materials, n. 171, p. 551-562, 2009.
ZHANG, D.; XIE, P.; LIU, Y.; CHEN, J.; WEN, Z. Spatial and temporal variations of microcystins in hepatopancreas of a freshwater snail from Lake Taihu. Ecotoxicology and Environmental Safety, v. 72, n. 2, p. 466–472, 2009.
ZHANG, W. F., TANG, J., YE, J. Photoluminescence and photocatalytic properties of SrSnO3 perovskite. Chem Phys. Lett, v. 418, p. 174-178, 2006.
ZHOU, S.; SHAO, Y.; GAO, N.; DENG, Y.; QIAO, J.; OU, H.; DENG, J. Effects of different algaecides on the photosynthetic capacity, cell integrity and microcystin-LR release of Microcystis aeruginosa. Science ofthe Total Environment, v. 463–464, p. 111–119, 2013.









