A eletrooxidação de Glicerol sobre Nanopartículas de PtRh/C em meio Ácido
ISBN 978-85-85905-25-5
Área
Físico-Química
Autores
Correia dos Santos, W.D. (UFMA) ; dos Santos Neto, A.G. (UFMA) ; de Lima, R.B. (UFMA)
Resumo
A aplicação de células a combustível como fonte renovável de energia tem levado a busca por novos combustíveis como o glicerol. O principal catalisador utilizado nestes dispositovos é a platina e suas ligas. Buscando aumentar a eficiência deste dispositivo, novos catalisadores bimetálicos vem sendo testados neste tipo de sistema. Desse modo, este trabalho visa estudar a eficiência das nanopartículas de PtRh para eletrooxidação do glicerol utilizando técnicas eletroquímicas de voltametria cíclica e cronoamperometria, além da técnica de Espectroscopia de Raio-X. Os resultados mostraram que os catalisadores Pt95Rh5/C e Pt85Rh15/C possuem melhor atividade catalítica, notou-se um deslocamento do início da oxidação do glicerol para os catalisadores de Pt95Rh5/C e Pt85Rh15/C.
Palavras chaves
Eletrooxidação; Platina; Glicerol
Introdução
Buscando solucionar problemáticas como a possível escassez dos combustíveis fósseis e o crescimento populacional que aumenta a demanda energética mundial, têm-se pesquisado novas fontes de energia renovável como as células a combustível. Nesse sistema ocorre a conversão da energia química por meio da utilização de combustíveis como o hidrogênio. No entanto, os álcoois de pequena cadeia como o metanol, etanol e etileno glicol vem sendo estudados para serem possíveis substitutos (GONZALEZ, 2000). Os álcoois de cadeia pequena possuem uma densidade energética superior ao hidrogênio molecular (LAMY, BELGSIR e LEGER, 2001). Em uma célula a combustível direta a álcool (DAFC), o combustível é inserido no ânodo da célula, onde se encontra o catalisador metálico que tem o papel de oxidar o álcool. No cátodo da célula, é injetado oxigênio gasoso (VIELSTICH, GASTEIGER e YOKOKAWA, 2009). Um álcool que vem chamando a atenção de diferentes grupos de pesquisa é o glicerol devido a sua oxidação total gerar 14 e-. A escolha do ródio como segundo metal foi baseada no Princípio de Sabatier, em que descreve que para obter uma atividade catalítica elevada, o adsorbato deve possuir uma ligação optimizada com a superfície do catalisador, não possuindo uma ligação nem tão forte e nem tão fraca com o material. Leão et al. em 2011 mostraram que na eletrooxidação do acetaldeído em eletrodos de PtRh a formação de CO2 era favorecida e de ácido acético era inibida (LEÃO et al.,2011). Em eletrodos de PdRh em meio alcalino foi observado que o CO2 formado pela eletrooxidação do glicerol consumia os íons OH- formando como produto CO32-. Além disso o Rh aumenta a capacidade do Pd em realizar a cisão C-C (FERREIRA; JANETE GIZ; CAMARA, 2013).
Material e métodos
Todas as soluções empregadas nos experimentos foram preparadas com água deionizada (18 MΩ) a partir do sistema Millipore-MilliQ. Os eletrólitos suportes utilizados foram obtidos a partir de H2SO4 97% (MERCK). A espécie eletroativa utilizada foi o glicerol (C3H5(OH)3, P.A., VERTEC). Na síntese das nanopartículas foram utilizados o ácido hexacloroplatÍnico hexahidratado (H2PtCl6.6H2O, SIGMA ALDRICH), cloreto de ródio hidratado (RhCl3.xH2O, SIGMA ALDRICH). Para a síntese dos eletrocatalisadores de Pt/C, Pt95Rh5/C, Pt90Rh10/C, Pt85Rh15/C, Pt80Rh20/C foi utilizado o método de redução por álcool (LI et al., 2013; DE SOUZA et al., 2014). A forma de preparo utilizado para síntese dos catalisadores foi o método do polyol, utilizando o carbono de alta área superficial ativado como suporte e as soluções dos precursores de Pt e Rh e a mistura redutora de Etileno glicol e água 4:1 v/v (ZHANG et al, 2019). Foi preparado uma suspensão pesando 5mg do catalisador sintetizado em pó junto a uma mistura contendo 1,4 mL de água deionizada e 1,0 mL de metanol como solventes, e como quelante foi utilizado 100 µL de Nafion®. As medidas voltamétricas e cronoamperométricas foram realizadas com o auxílio de um potenciostato Princeton Applied Research Model 263A. As análises de Difratometria de Raios X (DRX) foram realizadas em um difratômetro BRUCKER AXS D5005 para caracterização física das nanopartículas. Os parâmetros seguintes foram mantidos constantes durante a análise de Raios-X: variando 20<2θ<90° com passo de 0,03° e tempo de 3 s, e a análise total de tempo igual a 1,94 h.
Resultado e discussão
Na Figura 1 são apresentados os difratogramas de Raio-X obtidos para os
diferentes eletrocatalisadores. Para o catalisador de Pt/C foram observados
picos de difração em 2= 39,8°, 46,3°, 67,6°, 81,45° que são referentes,
respectivamente, aos planos (111), (200), (220) e (311) característicos das
estruturas cúbicas de face centrada (CFC) da Pt. O pico em 2 = 25° é
referente ao plano (002) do Carbono Vulcan XC-72R. Não foram observados
picos característicos para o Rh (HUANG et al., 2016).
Na Figura 2 (A) é apresentado o voltamograma cíclico para a eletrooxidação
do glicerol sobre o catalisador de Pt/C. Um lento aumento da corrente
catalítica é observada sobre o catalisador de Pt/C a potenciais próximos de
0,4V vs RHE, obtendo o máximo de corrente a potencial de 0,86V. Após esse
potencial observa-se uma diminuição na densidade de corrente até 1,0 V. Essa
queda na densidade é causada pela inibição da adsorção do álcool pelas
moléculas de água, consequência da competição pelos sítios ativos que ocorre
nessa região (0,8-1,0V).
Na Figura 2 (B) são mostrados obtidos para a eletrooxidação de glicerol
sobre os catalisadores de PtRh/C. É observado um deslocamento do potencial
no início da eletrooxidação do glicerol, este efeito está mais proeminente
visível para o catalisador de Pt85Rh15/C. Esse deslocamento ocorre devido a
propriedade que o segundo metal tem em disponibilizar de forma mais fácil
espécies oxigenadas (FERNÁNDEZ; MARTINS; CAMARA, 2012). Com o aumento de Rh
a corrente catódica se torna menor, sugerindo uma maior presença de espécies
Rh-O que podem diminuir o número de sítios ativos disponíveis. Por fim,
observamos que o aumento de quantidade de Rh acima de 20% interfere na
eficiência catalítica do material (RUFFO et al., 2017; SEN GUPTA; DATTA,
2006).
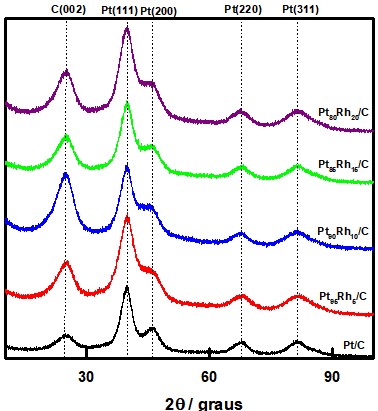
Difratogramas de raio-X para os eletrocatlisadores de Pt e PtRh, em diferentes composições.
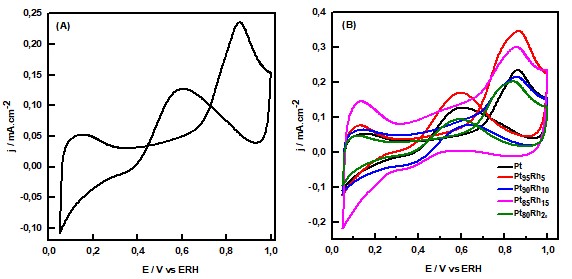
Voltamograma cíclico para a eletro-oxidação de 0,1 molL-1 C3H8O3 + 0,5 molL-1 H2SO4 para os catalisadores de PtRh/C e Pt/C, v=50 mV.s-1.
Conclusões
A síntese pelo método de redução por álcool utilizando o etileno glicol como redutor favoreceu o crescimento dos cristais. Os resultados mostram que a as nanopartículas de PtRh/C contribuem para oxidação do glicerol em meio ácido a potencias menores que os observados para a Pt/C. A presença do Rh pode garantir um aumento na oxidação do póliol, mas ao mesmo tempo pode interferir nas vias de reação.
Agradecimentos
Os autores agradecem a CAPES, CNPq e FAPEMA pelas bolsas consedidas.
Referências
FERNÁNDEZ, Pablo S.; MARTINS, María E.; CAMARA, Giuseppe A. New insights about the electro-oxidation of glycerol on platinum nanoparticles supported on multi-walled carbon nanotubes. Electrochimica Acta, v. 66, p. 180–187, 2012.
FERREIRA, R. S.; JANETE GIZ, M.; CAMARA, G. A. Influence of the local pH on the electrooxidation of glycerol on Palladium-Rhodium electrodeposits. Journal of Electroanalytical Chemistry, v. 697, p. 15–20, 2013.
GONZALEZ, E. R. Eletrocatálise e poluição ambiental. Química Nova, v. 23, n. 2, p. 262–266, 2000.
HUANG, L. et al. Combined EC-NMR and in Situ FTIR Spectroscopic Studies of Glycerol Electrooxidation on Pt/C, PtRu/C, and PtRh/C. ACS Catalysis, v. 6, n. 11, p. 7686–7695, 2016.
LAMY, C.; BELGSIR, E.M; LÉGER, J-M. Electrocatalytic oxidation of aliphatic alcohols: Application to the direct alcohol fuel cell (DAFC). Journal Applied Elecrochemistry, v.31, p. 799-809, 2001.
LEÃO, E. P.; GIZ, M. J.; CAMARA, G. A.; MAIA, G. Rhodium in presence of platinum as a facilitator of carbon-carbon bond break: A composition study. Electrochimica Acta, v. 56, n. 3, p. 1337–1343, 2011.
RUFFO, Vitor A. et al. All at once: How electrochemistry can be used to design and access multiple compositions in a single sample. Journal of Materials Chemistry A, v. 5, n. 43, p. 22641–22647, 2017.
SEN GUPTA, Sagar; DATTA, Jayati. A comparative study on ethanol oxidation behavior at Pt and PtRh electrodeposits. Journal of Electroanalytical Chemistry, v. 594, n. 1, p. 65–72, 2006.
VIELSTICH, W; LAMM, A.; GASTEIGER, H., Eds. Handbook of Fuel Cells: Fundamentals, technology, applications. Chinchester, Wiley, v. 2, 2003.









