ELETROOXIDAÇÃO DE ETILENOGLICOL SOBRE CATALISADORES DE PT E PTSN EM MEIOS ÁCIDO E BÁSICO
ISBN 978-85-85905-25-5
Área
Físico-Química
Autores
de Figueiredo, P.B.S. (UFMA) ; Correia Santos, W.D. (UFMA) ; Santos Neto, A.G. (UFMA) ; de Lima, R.B. (UFMA)
Resumo
Este trabalho apresenta o desenvolvimento de catalisadores a base de platina e estanho dispersos sobre carbono de alta área superficial (Vulcan XC-72), para estudar a eletrooxidação do etileno glicol em meio ácido (H2SO4, HClO4) e básico (NaOH), com o intuito de obter a oxidação do álcool a potenciais mais baixos, assim melhorando o rendimento do mesmo nas células a combustível. Os voltamogramas cíclicos e cronoamperogramas mostram que o catalisador de Pt:Sn 80:20 apresenta maior atividade catalítica em meio ácido (H2SO4), e em meio alcalino (NaOH) o catalisador de Pt:Sn 85:15 apresenta melhor atividade.
Palavras chaves
Eletrooxidação; Platina; Etileno Glicol
Introdução
O aumento do desenvolvimento industrial requereu um maior consumo de energia proveniente de combustíveis fosseis, que ainda são as principais fontes energéticas no mundo, e, como uma das consequências desse consumo, ocorreu o aumento da poluição atmosférica (CHU, MAJUNDAR, 2012). Para minimizar esses efeitos, novos dispositivos menos poluentes vêm sendo estudados, como as células a combustível. O combustível utilizado nessas células pode ser um álcool de cadeia pequena, ou seja, uma célula a combustível direta a álcool (DAFC). O que se deseja nesse caso é a total conversão do combustível a produtos finais de reação como o CO2 e H2O os quais são mais bem assimilados pela natureza (MALLICK, 2017). O Etilenoglicol (EG), um diol, possui baixa toxicidade, é de fácil manuseio e tem alta densidade energética (TRAVITSKY et al, 2009). Porém, umas das dificuldades de oxidar álcoois com mais de um carbono em sua cadeia molecular é a ruptura da ligação C-C a baixas temperaturas (SIMÕES, BARANTON, COUTANCEAU, 2010). Para isso é necessária a utilização de um catalisador eficiente para facilitar a quebra dessa ligação podendo assim obter-se a oxidação final do álcool. A Platina (Pt) é o catalisador mais amplamente estudado para o uso em DAFC, devido a sua alta atividade e estabilidade para a oxidação de pequenas moléculas orgânicas (FIGUEIREDO et al., 2015), porém a Pt apresenta algumas limitações em relação a intermediários de reações que podem por diminuir sua atividade catalítica. Para diminuir essas limitações pode-se adicionar um segundo metal de preço inferior e que possa melhorar sua atividade catalítica como o Estranho (Sn) (COLMATI, ANTOLINI, GONZALEZ, 2007).
Material e métodos
As soluções foram preparadas com água deionizada obtida através do sistema Millipore-MilliQ. Para as soluções do eletrólito-suporte foi utilizado ácido sulfúrico (97%, Sigma-Aldrich) Ácido Perclórico (71%, Sigma-Aldrich), Hidróxido de Sódio (99,99% Merck). Para preparação das nanopartículas foram utilizados Ácido Hexacloroplatínico (35,5%, H2PtCl6.XH2O Sigma-Aldrich), Cloreto de Estanho (98%, SnCl2 Sigma- Aldrich). Os experimentos eletroquímicos foram realizados em uma célula eletroquímica com capacidade de 10 mL e utilizando um eletrodo de trabalho de carbono vítreo (CV) modificado com as nanopartículas de diferentes concentrações de Pt e Sn, um eletrodo de referência Padrão de Hidrogênio e um eletrodo auxiliar de platina. A forma de preparo utilizado para síntese dos catalisadores foi o método do polyol, utilizando o carbono de alta área superficial ativado como suporte e as soluções dos precursores de Pt e Sn e a mistura redutora de Etileno glicol e água 4:1 v/v (ZHANG et al, 2019). Foi preparado uma suspensão pesando 5mg do catalisador sintetizado em pó junto a uma mistura contendo 1,4 mL de água deionizada e 1,0 mL de metanol como solventes, e como quelante foi utilizado 100 µL de Nafion®. As medidas voltamétricas e cronoamperométricas foram realizadas com o auxílio de um potenciostato Princeton Applied Research Model 263A. As análises de Difratometria de Raios X (DRX) foram realizadas em um difratômetro BRUCKER AXS D5005 para caracterização física das nanopartículas. Os parâmetros seguintes foram mantidos constantes durante a análise de Raios-X: variando 20<2θ<90° com passo de 0,03° e tempo de 3 s, e a análise total de tempo igual a 1,94 h.
Resultado e discussão
Os padrões de DRX obtidos para os catalisadores (Figura 1) mostram os picos
característicos para os planos cristalográficos da Pt com estrutura cúbica
de face centrada (fcc): (111), (200), (220) e (311), além de um pico largo
encontrado em torno de 25° corresponde ao plano (002) da estrutura hexagonal
do carbono Vulcan XC-72 utilizado como suporte das nanopartículas. Apenas o
catalisador de proporção Pt:Sn(50:50) apresentou outros dois picos além dos
outros. Esses picos podem ser observados nos ângulos 2θ = 34° e 52°. Eles
estão associados as reflexões (101) e (220) que são características da
cassiterita (SnO2) (LIU, al, etal, etal, & etal., 2006).
Os perfis voltamétricos dos catalisadores mostram em ambos os eletrólitos as
áreas de adsorção/dessorção de hidrogênio que ocorre em meio ácido (H2SO4,
HClO4) entre 0,05 e 0,3 vs RHE, e em meio alcalino (NaOH) entre 0,2 e 0,4V
vs RHE. Em todos os casos é perceptível uma diminuição dessa adsorção
conforme a concentração de Sn aumenta nos catalisadores, e um segundo pico
acima de 0,7V vs RHE aumenta, correspondente ao óxido de Sn.
Para a oxidação do Etileno glicol, os resultados dos voltamogramas cíclicos
mostram um aumento pequeno na atividade catalítica para o catalisador de
proporção Pt:Sn 80:20 em meio ácido (H2SO4) e em meio alcalino para o
catalisador de Pt:Sn 85:15. Os dados obtidos de densidade de corrente versus
o tempo (figura 2) a um potencial constate de 0,60 V vs ERH e 30 min de
eletrólise, mostraram diferentes perfis, indicando que a mudança de
eletrólito altera o mecanismo da reação. Observa-se que em meio alcalino os
valores de corrente são maiores quando comparado ao meio ácido.
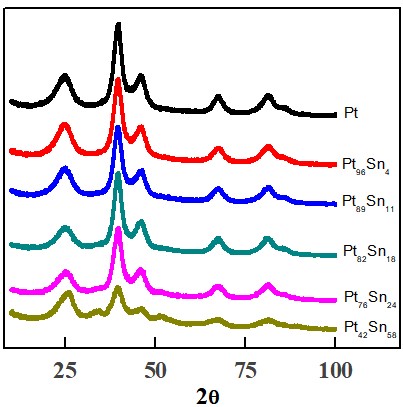
Difratogramas de Raio-X para os catalisadores de Pt e PtSn
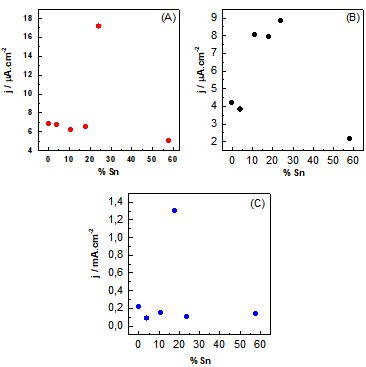
Gráficos de densidade de corrente versus % Sn após 30 min da oxidação de Etileno Glicol (0,1 mol L-1) E = 0,60 V. (A) H2SO4, (B) HClO4 e (C) NaOH.
Conclusões
O estudo mostrou que o Sn em concentrações certas pode facilitar a oxidação do álcool a potenciais mais baixos em três diferentes eletrólitos, e também aumentar a estabilidade do catalisador ao longo do tempo. E em proporções acima do ideal acaba por diminuir essa atividade devido a formação de óxidos amorfos de Sn, dificultando assim a oxidação do álcool e a condução elétrica. Além da temperatura favorecer essa atividade em H2SO4 e NaOH e desfavorecer em HClO4.
Agradecimentos
Os autores agradecem a FAPEMA, CAPES e CNPq pelas bolsas concedidas.
Referências
ANTOLINI, E. Catalysts for direct ethanol fuel cells. Journal of Power sources, n. 170, p.1-12, 2007.
CHU, S.; MAJUNDAR, A. Opportunities and challenges for a sustainable energy future. Nature, n. 488, p. 294-303, 2012.
COLMATI, F.; ANTOLINI, E.; GONZALEZ, E.. Ethanol oxidation on a carbon-supported Pt75Sn25 electrocatalyst prepared by reduction with formic acid: Effect of thermal treatment. Applied Catalysis B: Environmental, n.73(1-2), p.106-115, 2007.
FIGUEIREDO, M. C. et al. Direct alcohol fuel cells: Increasing platinum performance by modification with sp-group met als. Journal of Power Sources, n.275, p.341-350, 2015
LIU, Z et al. Microwave heated polyol synthesis of carbon-supported PtSn nanoparticles for methanol electrooxidation. Electrochemistry Communications, n.8(1), p.83-90, 2006.
MALLICK, R. K. Performance of passive DMFC with expanded met al mesh current collectors. Electrochimica Acta, v.243, p.299-309, 2017.
SIMÕES, M.; BARANTON, S.; COUTANCEAU, C. Electro-oxidation of glycerol at Pd based nano-catalysts for an application in alkaline fuel cells for chemicals and energy cogeneration. Applied Catalysis B: Environmental, n.93, p.354-362, 2010.
TRAVITSKY, N. et al. Effect of methanol, ethylene glycol and their oxidation by-products on the activity of Pt-based oxygen-reduction catalysts. Journal of Power Sources, n.194, p.161-167, 2009.
ZHANG, Z. et al. Vulcan XC-72 treated by nitric acid and its electrocatalytic activity for oxygen reduction reaction. Functional Materials Letters, v.12.n.2 2019.









