Constantes de velocidade da reação H + CO ↔ HCO calculadas no limite de alta pressão
ISBN 978-85-85905-25-5
Área
Físico-Química
Autores
Vichietti, R.M. (INSTITUTO TECNOLÓGICO DE AERONÁUTICA) ; Machado, F.B.C. (INSTITUTO TECNOLÓGICO DE AERONÁUTICA) ; Haiduke, R.L.A. (UNIVERSIDADE DE SÃO PAULO)
Resumo
A reação de formação do HCO a partir de H e CO, bem como o processo inverso, têm sido estudados por meio de uma grande variedade de técnicas experimentais e teóricas. Contudo, a maioria dos estudos cinéticos realizados para estas duas reações focou apenas em condições de baixas pressões. Por conta disso, este trabalho apresenta valores teóricos para as constantes de velocidade destas reações calculadas no limite de alta pressão, considerando faixas de temperaturas bem amplas. A significativa influência de efeitos de tunelamento quântico em baixas temperaturas, bem como a importância de se considerar efeitos variacionais nos valores destas constantes de velocidade, também é discutida.
Palavras chaves
constantes de velocidade; limite de alta pressão; cálculos ab initio
Introdução
O radical HCO é um intermediário comumente produzido em diferentes processos químicos de combustão, fazendo com que esta molécula seja de extrema importância em estudos voltados a esta área (KEÇELI et al., 2009). O mesmo ocorre com seu processo de decomposição em H e CO (KRASNOPEROV et al., 2005). Apesar de tudo isso, a grande parte dos estudos teóricos e experimentais que investigaram as propriedades cinéticas da dissociação do HCO em H e CO (ou mesmo na sua formação a partir do processo inverso) apenas focaram em condições de pressão baixa ou moderada. A exceção ocorre para a dissociação do HCO, a qual já foi investigada experimentalmente em pressões tão altas quanto 140 bar (HIPPLER et al., 2004), embora esta pressão não foi ainda suficiente para que as constantes de velocidade dessa reação atinjam o limite de alta pressão. Além disso, a formação do HCO a partir de H e CO foi estudada teoricamente por Timonen et al. (1987) e por Wagner e Bowman (1987) e eles verificaram que o limite de alta pressão deve ocorrer entre 100 e ~10000 atm. Todavia, esses mesmos autores afirmam que estimativas mais precisas de constantes de velocidade no limite de alta pressão precisam ser feitas a fim de testar os fundamentos das diferentes teorias utilizadas por eles. Em suma, devido à falta de dados suficientes, este estudo utiliza tratamentos avançados de estrutura eletrônica a fim de apresentar valores confiáveis para as constantes de velocidade das reações consideradas aqui em um regime de limite de alta pressão.
Material e métodos
As moléculas estáveis e o estado de transição envolvidos na reação tema deste trabalho foram obtidos em nível CCSD/aug-cc-pVTZ com auxílio do programa Gaussian 09 (FRISCH et al., 2009). Por sua vez, uma equação de extrapolação para conjunto de base completo, CBS, (PETERSON et al. 2012) foi utilizada com o intuito de melhorar a descrição das energias eletrônicas destas estruturas moleculares. Para esta extrapolação, foram realizados cálculos em nível CCSD(T)/aug-cc-pV5Z e CCSD(T)/aug-cc-pV6Z a partir das geometrias otimizadas anteriormente, constituindo assim um tratamento combinado que pode ser denominado como CCSD(T)/CBS//CCSD/aug-cc-pVTZ. Em seguida, as constantes de velocidade da reação direta, kd, e da reação inversa, ki, foram calculadas entre 50 e 4000 K por meio dos tratamentos TST e TST/W (EVANS & POLANYI, 1935; WIGNER, 1932) e também pelo ICVT e ICVT/SCT (TRUHLAR & GARRET, 1984; TRUHLAR et al., 1985), sendo que o programa Polyrate (ZHENG et al., 2009a) juntamente com a interface Gaussrate (ZHENG et al., 2009b) foram utilizados para esta finalidade. Embora as constantes de velocidade tenham sido inicialmente calculadas em nível CCSD/aug-cc-pVTZ, os valores de kd e ki foram aprimorados considerando as energias eletrônicas advindas do tratamento combinado CCSD(T)/CBS//CCSD/aug-cc-pVTZ e um fator de escala de 0,956 (JOHNSON III, 2015), que foi adotado para considerar correções anarmônicas nas frequências vibracionais.
Resultado e discussão
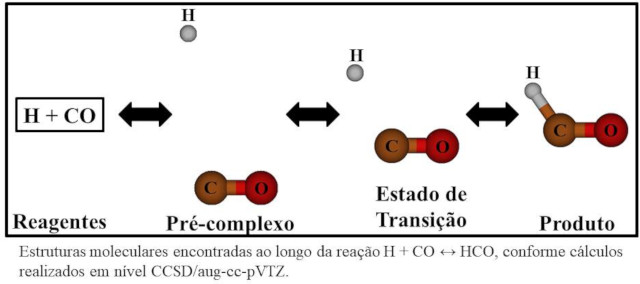
De acordo com os cálculos realizados em nível CCSD/aug-cc-pVTZ, a conexão entre reagentes e produto da reação em estudo ocorre em uma única etapa elementar, conforme pode ser visto na Figura 1. Por sua vez, a Tabela 1 mostra valores no limite de alta pressão para as constantes de velocidade no sentido direto e inverso desta reação, obtidos a partir dos tratamentos TST, ICVT, TST/W e ICVT/SCT, sendo que esta última metodologia fornece os valores recomendados neste estudo. Levando em consideração efeitos de tunelamento quântico, verificamos que as constantes de velocidade obtidas pelo método ICVT/SCT são cerca de 1010 e 103 vezes maiores que aquelas advindas do método ICVT para 50 e 100 K, respectivamente. Conforme esperado, este efeito decresce continuamente, de modo que sua influência é de apenas 0,3 % em 4000 K. Por fim, foi verificado que as constantes de velocidade ICVT em cada temperatura são sempre menores que aquelas obtidas pela TST convencional. Isso não é surpreendente, pois o método ICVT considera efeitos variacionais. Estes efeitos variacionais apresentam uma influência de 16,5 e 9,6 % para as temperaturas de 50 e 100 K, respectivamente. Por sua vez, foi observado um aumento contínuo da influência destes efeitos variacionais entre 200 e 4000 K que varia desde 7,5 até 38,0 %, respectivamente. Assim, esta análise mostra a importância de se considerar efeitos variacionais em todas as temperaturas investigadas aqui para ambas as reações em questão.

Conclusões
Este trabalho apresenta resultados teóricos das constantes de velocidade da reação entre H e CO formando HCO e também do processo inverso, sendo que elas foram calculadas entre 50 e 4000 K considerando um regime de limite de alta pressão. Verificamos neste estudo a considerável influência dos efeitos de tunelamento quântico nestas constantes para temperaturas de 50 e 100 K. Além disso, mostramos a importância de se considerar efeitos variacionais em todas as temperaturas consideradas aqui para melhor descrição dos valores teóricos obtidos.
Agradecimentos
Agradecemos a FAPESP (processos 2010/18743-1, 2014/23714-1, 2017/07707-3 e 2018/05691-5) e o CNPq (processos 168132/2014-1, 305366/2015-7, 307052/2016-8 e 404337/2016-3) pelo suporte financeiro.
Referências
EVANS, M. G.; POLANYI, M. State method to the calculation of reaction velocities, especially in solution. Transactions of the Faraday Society, v. 31, p. 875-894, 1935.
FRISCH, M. J. et al. GAUSSIAN 09, Revision D.01 (CT: Gaussian, Inc., Wallingford, 2009).
HIPPLER, H.; KRASTEVA, N.; STRIEBEL, F. The thermal unimolecular decomposition of HCO: effects of state specific rate constants on the thermal rate constant. Physical Chemistry Chemical Physics, v. 6, p. 3383-3388, 2004.
JOHNSON III, R. D. NIST Computational chemistry comparison and benchmark database, NIST standard reference database, number 101, release 17b, 2015 (http://cccbdb.nist.gov/).
KEÇELI, M.; SHIOZAKI, T.; YAGI, K.; HIRATA, S. Anharmonic vibrational frequencies and vibrationally-averaged structures of key species in hydrocarbon combustion: HCO+, HCO, HNO, HOO, HOO–, CH3+, and CH3. Molecular Physics, v. 107, p. 1283-1301, 2009.
KRASNOPEROV, L. N.; CHESNOKOV, E. N.; STARK, H.; RAVISHANKARA, A. R. Elementary reactions of formyl (HCO) radical studied by laser photolysis – transient absorption spectroscopy. Proceedings of the Combustion Institute, v. 30, p. 935-943, 2005.
PETERSON, K. A.; FELLER, D.; DIXON, D. Chemical accuracy in ab initio thermochemistry and spectroscopy: current strategies and future challenges. Theoretical Chemistry Accounts, v. 131, p. 1079-1098, 2012.
TIMONEN, R. S.; RATAJCZAK, E.; GUTMAN, D. J. The addition and dissociation reaction H + CO ↔ HCO. 2. Experimental studies and comparison with theory. The Journal of Physical Chemistry, v. 91, p. 5325-5332, 1987.
TRUHLAR, D. G.; GARRETT, B. C. Variational transition state theory. Annual Review of Physical Chemistry. v. 35, p. 159-189, 1984.
TRUHLAR, D. G.; ISAACSON, A. D.; GARRETT, B. C. Theory of Chemical Reaction Dynamics, Vol. 4 (CRC Press, Boca Raton, FL, 1985, p. 65).
WAGNER, A. F.; BOWMAN, J. M. The addition and dissociation H + CO ↔ HCO. 1. Theoretical RRKM studies, The Journal of Physical Chemistry, v. 91, p. 5314-5324, 1987.
WIGNER, E. Über das Überschreiten von Potentialschwellen bei chemischen Reaktionen. Zeitschrift für Physikalische Chemie, v. 19B, p. 203-216, 1932.
ZHENG, J. et al. POLYRATE - Version 2008 (Univ. Minnesota, Minneapolis, 2009a).
ZHENG, J.; ZHANG, S.; CORCHADO, J. C.; CHUANG, Y.-Y.; COITIÑO, E. L.; ELLINGSON, B. A.; TRUHLAR, D. G. GAUSSRATE - Version 2009-A (Univ. Minnesota, Minneapolis, 2009b).









