SÍNTESE E CARACTERIZAÇÃO DE SÍLICA MESOPOROSA CONTENDO FERRO PARA PROCESSOS DE DESSULFURIZAÇÃO
ISBN 978-85-85905-25-5
Área
Iniciação Científica
Autores
Aquino, C.B. (UFPE) ; Santos, F.J.M. (UFCG) ; Farias Barros, J.M. (UFCG)
Resumo
Diversos materiais estão atualmente em estudo para serem utilizados em processos de dessulfurização, a exemplo dos óxidos metálicos e óxidos metálicos mistos, zeólitas, materiais carbonáceos, organosílicas e sílicas mesoporosas modificadas. Neste trabalho analisou-se a capacidade, para dessulfurizaçao, da peneira molecular tipo MCM-41 contendo ferro. Os materiais foram caracterizados através das análises de difração de raios X, análise térmica, espectroscopia na região do infravermelho com transformada de Fourier e adsorção/dessorção de N2 (BET). Os teste de dessulfurização foram realizados utilizando o tiofeno como molécula teste a temperatura ambiente e a 200oC. A atividade adsortiva da peneira molecular tipo MCM-41 contendo íons Ferro foi testada apresentando conversões de 100%.
Palavras chaves
Tiofeno; Dessulfurização; Sílicas Mesoporosas
Introdução
Atualmente a maioria da população mundial encontra-se preocupada com o futuro do planeta Terra, principalmente quanto as questões relacionadas à poluição atmosférica cada vez mais crescente nos grandes centros urbanos. Uma das principais causas dessa poluição é a queima de combustíveis fósseis, pois além da liberação de gases como o dióxido de carbono (CO2) produto da queima completa dos hidrocarbonetos e um dos responsáveis pelo efeito estufa, são liberados também para a atmosfera os óxidos de enxofre (SOx) advindos dos combustíveis através da combustão de compostos sulfurados, também chamados contaminantes que estão presentes em todas as frações do petróleo. Enxofre em combustíveis de transporte é uma das principais fontes de poluição atmosférica. Processos de desulfurização eficiente em combustíveis são assuntos de grande interesse não só por causa da crescente preocupação em atender as exigências dos órgãos ambientais, mas também porque combustíveis com baixo teor em enxofre são requisitos essenciais para aplicações em célula à combustível [01]. Hidrocarbonetos líquidos são consideradas um potente combustível para automóveis e células à combustível portáteis devido à sua maior densidade energética e infra-estrutura prontamente existente para a produção, entrega e armazenamento [02]. No entanto, os níveis de enxofre orgânicos presentes nos combustíveis líquidos, especialmente gasolina e diesel, são suficientes para reduzir consideravelmente a atividade e a vida útil dos catalisadores utilizados no processador de combustível. Além disso, os atuais processos de hidrodesulfurização (HDSs) para a redução de enxofre na gasolina e diesel, especialmente os LCO (light cycle oil), exigem difíceis condições de processamento para eliminar os últimos 100ppm de enxofre, ocasionando penalidades na octanagem da gasolina, em investimentos e no consumo de hidrogênio. Isto é devido à presença, nos LCO, de decompostos de enxofre, tais como benzotiofenos ou dibenzotiofenos, que exigem maiores pressões de hidrogênio, temperaturas, e um maior tempo de contato para conseguir combustíveis com concentração de enxofre inferior a 10ppm. Durante a desulfurização oxidativa, compostos de enxofre podem ser oxidados pela adição eletrofílica de oxigênio aos átomos de enxofre para formar sulfóxidos (1- óxidos) e sulfonas (1,1-dióxido). As propriedades físicas e químicas destes compostos são significativamente diferentes das dos hidrocarbonetos no óleo combustível,e consequentemente, eles podem ser removidos por destilação, extração por solvente ou adsorção. As rotas de oxidação catalítica para produzir combustíveis com baixa concentração de enxofre, incluem vários tipos de oxidantes, tais como: óxidos de nitrogênio, ácido nítrico, peróxido de hidrogênio, ozônio, hidroperóxidos orgânicos, oxigênio molecular, perácidos, e outros. A oxidação de derivados de tiofeno com H2O2 ocorre através de vários sistemas catalíticos, tais como HCOOH, CF3COOH, ácido fosfotungstênico, e de metal suportado em alumina ou peneiras moleculares. A utilização de complexos de metais de transição (Ti, Mo, Fe, V, W, Re, Ru) como catalisadores ativos para oxidação seletiva de compostos de enxofre em condições homogêneas, também tem sido relatado [03]. No caso das peneiras moleculares contendo metais, as dimensões dos poros do material, bem como o metal de coordenação, agente oxidante e o solvente, desempenham papéis fundamentais na atividade e tempo de vida do catalisador para o desulfurização oxidativa de óleos. Neste sentido, vêm sendo estudada a reação de sulfetos pelo peróxido de hidrogênio sobre o TS-1 e Ti-Beta e por H2O2 eterc-butilhidroperóxido (TBHP) sobre Ti-Beta e Ti- MCM-41, respectivamente, utilizando vários solventes orgânicos. O TS-1 foi o menos ativo para compostos de enxofre com elevado peso molecular devido ao acesso restrito destas moléculas nos poros da zeólita. Em contraste, peneiras moleculares com elevado diâmetro de poros, tais como Fe-Beta e Fe-MCM-41, foram muito ativas na fase líquida, quando grandes quantidades de solventes tais como: metanol, etanol, ou acetonitrila foram utilizados para facilitar a solubilidade do H2O2. O Objetivo desse trabalho é o desenvolvimento de materiais a base sílica contendo ferro, que apresentam área superficial e porosidade elevadas, aumentando conseqüentemente a dispersão do metal ativo, podendo assim facilitar a difusão dos compostos sulfurados, apresentando consequentemente elevada atividade no processo de dessulfurização.
Material e métodos
A MCM-41 foi sintetizada pelo método hidrotérmico, preparando-se uma solução aquosa de sílica (merk) com silicato de sódio que permaneceu por 2 horas em agitação constante sob temperatura aproximada de 60 °C. Após a total homogeneização dessa mistura, foi adicionada uma outra solução aquosa contendo o surfactante brometo de cetiltrimetilamônio (CTMABr) permanecendo a mistura resultante por mais 1 hora em agitação a temperatura ambiente. O gel resultante apresenta composição molar igual a: 1,00 CTMABr: 4,00 SiO2: 1,00Na2O: 200 H2O. O gel obtido pelo processo descrito foi adicionado a um vaso de teflon com tampa e este inserido a uma autoclave de aço inox e submetido à temperatura de 100 °C por um período de 120 horas (5 dias), com ajunte de pH a cada 24 horas para uma faixa de 9,5-10, com uma solução de ácido acético 30% até que esse atingisse a estabilidade. O sólido final foi separado do sobrenadante por filtração a vácuo e em seguida esse foi lavado com uma solução 2% de HCl/Etanol, ao fim do processo esse material foi lavado novamente com água deionizada em excesso, e seco em estufa.A fase ativa, ferro na sua forma Fe3+ foi depositada sobre os suporte mesoporoso MCM-41 através da técnica de impregnação com excesso de solvente utilizando-se etanol absoluto: C2H5OH(99,5%, Merck) como solvente e nitrato de ferro hexahidratado (99%, Merck) como fonte de ferro. Pesou-se as quantidades necessárias de nitrato de ferro para se obter um percentual em massa de ferro de 5, 10 e 20%. As reações de dessulfurização do tiofeno foram realizadas em um aparato experimental formado por um micro-reator, do tipo em U de borossilicato de 0,64 cm de diâmetro externo e é provido de bulbo (1,91cm de diâmetro) onde, por colocação de lã de vidro, o sólido é suportado. O bulbo possui um acoplamento para um termopar através do qual a temperatura do sistema é monitorada. O micro-reator é conectado à unidade por flanges de aço inox 316. O sistema é operado em fluxo contínuo de nitrogênio à temperatura ambiente e pressão de 1atm. Em cada corrida, utilizou-se 100mg de catalisador o qual foi testado à 200ºC e à temperatura ambiente. O fluxo foi ajustado para se obter uma razão de fluxo molar de reagente por massa de catalisador (F/W) igual a 0,7mol h-1mcat-1. A saída do reator está conectada, através de uma linha de aço inox aquecida à 120ºC, com um cromatógrafo a gás Varian Modelo CP 3800 equipado com uma válvula automática de injeção de amostras gasosas. O sistema de análise cromatográfica possui um detctor PFPD seletivo a enxofre. O contaminante utilizado foi o tiofeno e o gás de arraste utilizado na reação foi o N2, o qual foi introduzido em um tubo de permeação dentro do saturador para arrastar os vapores de tiofeno até o micro-reator contendo a amostra, com uma vazão de 30 mL/min. A separação e identificação dos produtos da reação foi realizada em uma coluna do tipo VF5 MS, com diâmetro de 0,25mm, comprimento de 30m e espessura de 0,25μm.
Resultado e discussão
As propriedades estruturais da amostra MCM-41 utilizando o CTMABr como
direcionador estrutural foram obtidas por medidas de DRX. O padrão de DRX da
amostra apresentou três picos típicos, um com uma elevada intensidade,
atribuída a linha de reflexão do plano (100) e dois outros com menor
intensidade atribuídos às reflexões dos planos (110) e (200) característicos
da estrutura hexagonal mesoporosa como descrito por Beck et al. [04]. Um pico
em 2Θ = 2,20nm, correspondente à reflexão (100) na amostra MCM-41/CTMABr, nos
fornece, de acordo com a regra de Bragg, a dimensão do parâmetro de rede
hexagonal (ao) para o MCM-41 de 4,64nm. As análises termogravimétricas das
amostras sintetizadas na forma não calcinada, obtidas em atmosfera de
nitrogênio, estão de acordo com dados da literatura [05], apresentando as três
perdas de massa principais do material mesoporoso do tipo MCM-41. São feitas
as seguintes atribuições para estes eventos:(I) Dessorção de água fisicamente
adsorvida; (II) Decomposição do surfactante e (III) Condensação de grupos
silanóis. Os espectros de infravermelho do material MCM-41 apresentam as
bandas das vibrações dos estiramentos assimétricos e simétricos Si – O
presentes na estrutura, atribuídos para zeólitas[06]. Aparecem nas regiões
1243-1091 e 806 cm-1 respectivamente. O espectro de absorção na região do
infravermelho do material mesoporoso MCM-41/CTMABr corresponde à região
espectral entre 4000 e 400cm-1. Os espectros da amostra MCM-41/CTMABr antes da
etapa de calcinação, apresentou uma banda de absorção em 2930 e 2849 cm-1
correspondente a moléculas do surfactante (material orgânico). A ausência
desta banda nos espectros do material calcinado evidencia a completa remoção
do direcionador orgânico das estruturas originais. Através das análise de BET
por meio das isotermas de adsorção/ dessorção de N2 a 77 K. A amostra
apresentou isoterma do tipo IV de acordo com a classificação da IUPAC, com
baixa adsorção a pressões relativas < 0,1. A partir do resultado desta análise
foi possível determinar a área superficial específica pelo método de BET, o
diâmetro médio dos poros através do método BJH e a espessura da parede de
sílica de acordo com a Equação wt = ao - dp. Em que, wt, ao e dp significam
respectivamente espessura da parede de sílica, parâmetro hexagonal e diâmetro
de poro. Para o MCM-41 sintetizado neste estudo foram obtidos os valores de
730 m2.g-1 de área supercficial, 3,12 nm de parâmetro hexagonal e 1,58 de
diâmetro de poros.
Testes de dessulfurização
Os testes de dessulfurização usando o tiofeno como molécula sonda
foram realizados com as amostras de 5Fe/MCM-41 (5% de ferro), 10Fe/MCM-41 (10%
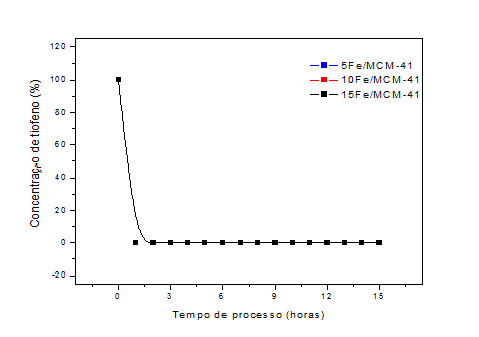
de ferro) e 20FeMCM/41(20% de ferro). As Figura 01 e 02 apresentam os
percentuais de tiofeno em função do tempo de reação à temperatura ambiente e a
200oC. Podemos observar a capacidade de adsorção dos matérias 10Fe/MCM-41 e
20Fe/MCM-41 é máxima por todo o período de processo estudado, para a amostra
5Fe/MCM-41 após 10 h o material apresenta o início da sua desativação, a carga
de fase ativa nesta amostra é insuficiente para reter o tiofeno por mais tempo
a temperatura ambiente. Para a dessulfurização realizada a 200oC a conversão
do tiofeno é máxima para todas as amostras em todo o período de tempo
estudado, evidenciando que a temperatura interfere no processo aumentando a
ativação dos sítios adsortivos presentes nos materiais favorecendo a formação
de sulfeto de ferro.

Concentração de tiofeno em função do tempo de processo a temperatura ambiente.
Concentração de tiofeno em função do tempo de processo a temperatura de 200oC.
Conclusões
Os resultados das diversas análises físico-químicas, juntamente com os dados obtidos através dos testes de dessulfurização realizados nos catalisadores MCM-41 contendo diferentes quantidades de Fe permitiram-nos obter as seguintes conclusões: • O suporte mesoporoso do tipo MCM-41 foi sintetizado com sucesso através do método hidrotérmico, utilizando o brometo de cetiltrimetilamônio como direcionador estrutural, a 100ºC por 120 horas, com ajuste de pH para a faixa de 9,5-10 a cada 24 horas. • O padrão de DRX da amostra do suporte apresentou três picos típicos, um com uma elevada intensidade, atribuída a linha de reflexão do plano (100) e dois outros com menor intensidade atribuídos às reflexões dos planos (110) e (200) característicos da estrutura hexagonal mesoporosa tipo MCM-41. • Através do espectro de FTIR é possível verificar que o processo de calcinação remove todo o material orgânico contido nos poros dos materiais, uma vez que os espectros das amostras calcinadas não apresentam a banda na região relacionada ao material orgânico; • As análises termogravimétricas dos materiais apresentam as perdas de massa características, sendo a primeira relacionada à saída de água fisisorvida na superfície, a segunda à decomposição do surfactante e a terceira relacionada à condensação dos grupos silanóis, sendo esta, importante para se concluir onde as ligações Si – OH estão sendo mais significativas. • A deposição da fase ativa, íons ferro, no suporte pelo método da impregnação úmida foi satisfatória na obtenção de diferentes materiais. • Os resultados dos testes de adsorção apresentados indicaram que os materiais obtidos podem ser utilizados na remoção de compostos sulfurosos. Desta forma, a atividade adsortiva da peneira molecular tipo MCM-41 contendo íons Fe foi testada usando a reação de dessulfurização de tiofeno como reação modelo, apresentando conversão de 100%.
Agradecimentos
Os autores agradecem a Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pela concessão do auxílio financeiro.
Referências
[01] CHAO, M.; ZELINSKY, A.; SORKIN, R.; McGLAUGHLIN, G.; MORELAND, R.C.; HANLEY, M.; KOONCE, T.A. JOHNSON, T.A. International Journal of Hydrogen Energy, 13 August 2014, Vol.39(24), pp.12948-12972
[02] STAICU, L. C.; MORIN-CRINI, N.; CRINI, G. Chemosphere, April 2017, Vol.172, pp.111-119.
[03] ZHANG, X.; PAN, L.; WANG, L.; Zou, J.J.Chemical Engineering Science, 28 April 2018, Vol.180, pp.95-125
[04] BECK, J.S.; VARTULI, J.C.; ROTH, W.J.; LEONOWICZ, M.E.; KRESGE, C.T.; SCHMITT, K.D.; CHU, C.T.; OLSON, D.H.; SHEPPARD, E.W.; McCULLEN, S.B.; HIGGINS J.B. and SCHLENKER, J.L. J. Am. Chem. Soc. 114. P. 10834, 1992.
[05] SONG, C. Catal. Today 86 (2003) 211.
[06] KRESG, C. T.; LEONOWICZ, M. E.; ROTH, W. J., VARTULI, J. C. & BECK, J. S. Nature. 359, 1992. p. 710 - 712.









