Comparação entre ordens de reação química obtidas através de métodos gráficos e do método das velocidades iniciais
ISBN 978-85-85905-25-5
Área
Iniciação Científica
Autores
Melo de Oliveira, J.L. (CENTRO UNIVERSITÁRIO SENAC - SANTO AMARO) ; Saron, A. (CENTRO UNIVERSITÁRIO SENAC - SANTO AMARO)
Resumo
O presente trabalho teve como objetivo realizar uma comparação entre os métodos gráficos e o método das velocidades iniciais na determinação da ordem de uma reação. Para este trabalho foi utilizada a reação de Landolt e realizados uma série de experimentos laboratoriais, determinando o tempo da reação em diferentes concentrações. Nos dados obtidos dos experimentos foram aplicados os métodos já mencionados. Como resultado das análises e das comparações dos dados obtidos, foi possível concluir que o método das velocidades iniciais é mais preciso que os métodos gráficos, mas a adoção das duas metodologias pode representar uma consolidação de resultados mais confiável na realização de trabalhos e estudos envolvendo a determinação da ordem de uma reação química.
Palavras chaves
cinética química; ordem de reação; métodos gráficos
Introdução
O trabalho em questão tem como objetivo realizar uma comparação entre os resultados obtidos através dos métodos gráficos e o método das velocidades iniciais na determinação da ordem de uma reação química. O presente estudo possui considerável importância e relevância para o ramo da cinética química, uma vez que os experimentos realizados para determinação de ordem de reação estão sujeitos a diversos tipos de incertezas. O trabalho se justifica com a necessidade de serem adotados diferentes métodos para consolidação de resultados em trabalhos envolvendo ordem de reação, como uma forma de se confirmar os resultados obtidos das análises gráficas, através do método das velocidades iniciais, pois este é mais preciso e menos sujeito a incertezas. Para os métodos gráficos, o gráfico do logaritmo natural da concentração em função do tempo pode indicar uma reação de primeira ordem. Já o gráfico do inverso da concentração em função do tempo pode indicar uma reação de segunda ordem (RUSSELL, 1994). Já o método das velocidades iniciais, segundo Russell (1994), consiste na realização de uma série de experiências, em separado, numa mesma temperatura e variando a concentração de um dos reagentes enquanto se fixa a concentração de outro. Este método consiste na determinação da velocidade e concentração dos reagentes no início de cada experiência, com posterior análise matemática da relação entre a concentração inicial e a velocidade inicial. Este método parte do princípio da variação da concentração do reagente em função da variação do tempo e sua relação com a concentração elevada a um expoente variável, que deverá ser calculado e que indica a ordem da reação para aquele reagente.
Material e métodos
Para a realização do presente estudo foram realizados diversos experimentos em laboratório à temperatura ambiente e variando a concentração dos reagentes em cada experimento e cronometrando o tempo de conclusão da reação. Nesse caso foi utilizada a reação de Landolt. A reação de Landolt consiste em uma solução de iodato de potássio (KIO3) que é adicionada a uma solução acidificada de bissulfito de sódio (NaHSO3) contendo amido, que atua como indicador de iodo, formando um complexo azul, que após certo tempo de reação, a mistura inicialmente incolor torna-se subitamente azul (COELHO, 2012). Nesta reação global ocorrem várias reações (etapas), e após o consumo de todo o bissulfito o iodo fica livre e reage com o amido, formando, subitamente, um complexo azul escuro, indicando a conclusão da reação. Após os experimentos, os resultados foram calculados de acordo com a lei de velocidade da reação estudada, tabelados e foram aplicados os métodos gráficos e das velocidades iniciais mencionados anteriormente.
Resultado e discussão
Os resultados do método das velocidades estão apresentados na Figura 1. De
acordo com os resultados obtidos desse método é possível, para efeitos
práticos, arredondar os valores encontrados para as ordens de reação dos
reagentes. Sendo assim, é possível afirmar que para o bissulfito corre uma
reação de primeira ordem, e para o iodato uma reação de segunda ordem,
totalizando uma reação global de terceira ordem. A Figura 2 apresenta os
resultados obtidos através dos métodos gráficos. Observando-se os gráficos,
é possível notar que a linearização para o iodato possui uma boa correlação
(quanto mais próximo de 1 o valor de R2, melhor é a correlação da
linearização) tanto para primeira ordem quanto para segunda ordem. Isso pode
evidenciar que ao se basear apenas nos métodos gráficos é possível levar a
uma conclusão errônea da ordem de reação para aquele reagente. Esse fato
pode ser explicado pela grande influência que erros experimentais e
instrumentais podem ter sobre os resultados de experimentos dessa natureza,
como já evidenciado pelo valor fracionário, e não exato, obtido pelo método
das velocidades iniciais.

Resultados obtidos a partir da aplicação do método das velocidades iniciais sobre os dados obtidos experimentalmente.
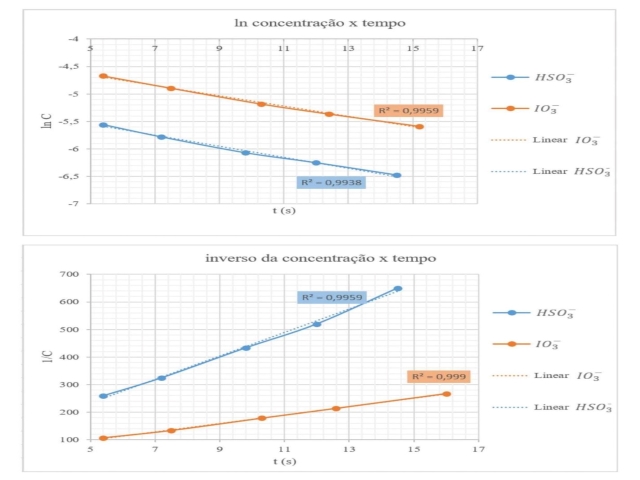
Gráficos obtidos a partir da aplicação dos métodos gráficos sobre os dados obtidos experimentalmente.
Conclusões
A partir dos resultados e da discussão dos mesmos ficou evidenciado que, para trabalhos experimentais dessa natureza e com finalidade de estudo da ordem de uma reação química, a adoção dos dois métodos estudados pode apresentar uma consolidação mais confiável dos resultados obtidos. Resultados de trabalhos experimentais dessa natureza estão sujeitos à grande influência de incertezas e erros, logo a abordagem apresentada no presente trabalho pode representar uma importante metodologia analítica por reduzir incertezas.
Agradecimentos
Ao meu orientador Prof. Dr. Alexandre Saron, pelo apoio na pesquisa e no meu aprendizado. Ao CNPq, pelo auxílio financeiro. Ao Centro Universitário Senac.
Referências
COELHO, Pedro. Reação de Landolt - Relógio de iodo. Santos, 2012. Disponível em: <https://www.engquimicasantossp.com.br/2012/03/reacao-de-landolt.html>. Acesso em: 15 abr. 2019.
RUSSELL, J. B. Química geral. 2ª ed. São Paulo: Pearson Makron Books, 1994. 2º v.









