Estudo Químico e Avaliação da Atividade Citotóxica Frente Artemia salina do Caule da Pithecoctenium crucigerum (Pente-de-macaco) Bignoniaceae
ISBN 978-85-85905-25-5
Área
Iniciação Científica
Autores
Guedes de Souza, K.L. (CCET/UEG) ; Borges Costa, M. (CCET/UEG) ; Bardella Castro, R.A. (CCET/UEG)
Resumo
A espécie Pithecoctenium crucigerum (Bignoniaceae) apresenta poucos estudos sobre esta espécie. Neste trabalho, inicialmente foi produzido 1,66g do extrato bruto etanólico (EBE) por extração contínua (etanol P.A.). Sequencialmente, o EBE foi fracionado por extração descontínua com o aumento crescente de polaridade dos solventes empregados e as frações hexânica, diclorometânica, acetato e a butanólica foram obtidas. Em seguida, foi desenvolvida a pesquisa das classes dos metabólitos seguindo dados da literatura. Foram observados na FrAcOEt, a presença dos metabólitos saponinas e alcaloides, e na FrBuOH, a presença de ácidos orgânicos, saponinas e açúcares redutores. O ensaio com Artemia salina com as frações evidenciou CL50>1000ppm, o que favorece potencial biológico para estas frações.
Palavras chaves
PIthecoctenium crucigerum; Artemia salina; Prospecção Fitoquímica
Introdução
Há uma ampla variedade de produtos vegetais com altos fins terapêuticos e medicinais, que apresentam diferentes atividades biológicas. Os diferentes compostos produzidos pelas plantas podem ser divididos em dois grupos: os metabólitos primários, e os metabólitos secundários (PHILLIPSON, 2007). Há uma ampla variedade de produtos vegetais com altos fins terapêuticos e medicinais, que apresentam diferentes atividades biológicas. Os diferentes compostos produzidos pelas plantas podem ser divididos em dois grupos: os metabólitos primários, e os metabólitos secundários (PHILLIPSON, 2007). A AFamília Bignoniaceae, segundo a Encyclopedia Britannia Facts Matter (2013)“contém cerca de 112 gêneros e mais de 725 espécies de árvores, arbustos e, mais comumente, cipós, principalmente na América tropical, África tropical e na região Indo-malaia”. Ela representa também a mais importante família da lianas da América Central. As Bignoniaceaes possuem, em geral, um conjunto de particularidades vegetativas e reprodutivas bem características: são eudicotiledôneas, lenhosas, particularmente lianas; folhas compostas e opostas; com frutos secos, deiscentes e com a parte externa coberta por espinhos grossos; e presença de sementes aladas (OLMSTEAD, 2009). A família Bignoniaceae é ainda divida em oito tribos, sendo elas: Tecomeae, Bignonieae, Crescentieae, Eccremocarpeae, Tourrettieae, Oroxyleae, Coleeae e Schlegelieae, das quais apenas as três primeiras são encontradas no Brasil (POSER, 1999). O Brasil com 55 gêneros e 316 espécies é o maior centro de diversidade dessa família (SCUDELLER, 2008). Nos últimos tempos o estudo das espécies de Bignoniaceae tem crescido extensamente no setor fitoquímico (CIPRIANE, 2007). No entanto, poucas espécies tem valor econômico fora à horticultura, porém muitas são empregadas para alimentação, para tratamentos medicinais, fins rituais e contêineres por povos indígenas (OLMSTEAD, 2009). Algumas espécies são ainda vastamente cultivadas como ornamentais, devido à imensa beleza que suas florações apresentam (POSER, 1999), e outras ainda com finalidade de horticultura, madeira, tintas e medicamentos. A aplicação medicinal mais conhecida é a de preparações de sua casca para cura do cancro (HOSTETTMANN, 2007). A Pithecoctenium, um gênero na família Bignoniaceae, são espécies lianas, caracterizadas pelas flores (Figura 1) melitófilas, geralmente brancas ou creme, odoríferas e nectaríferas (SCUDELLER, 2008).O interesse fitoquímico a respeito da Pithecoctenium crucigerum ainda é muito pequeno e não há praticamente autores que abordem este assunto. Testes realizados para identificação de metabólitos secundários para esta planta resultaram em heterosídeos, flavonoides (flavonas, flavonóis e xantonas), alcaloides e derivados de cumarinas e saponinas espumídicas (SOUSA, 2011). Com o intuito de direcionar para o isolamento de metabólitos secundários com potencial biológico, o estudo fitoquímico é normalmente acompanhado por bioensaios. Os testes de letalidade, contra a Artemia salina, é mais utilizado, por ser considerado rápido e fácil execução. A Artemia salina (Leach), um microcrustáceo (Figura 9), é amplamente empregado em ensaios de toxicidade, por ser conhecido como indicador de letalidade em um bioensaio que utiliza a CL50 (concentração letal média) como parâmetro de avaliação da atividade biológica. Ensaios com Artemia salina têm sido usadas para detecção de compostos bioativos em extratos de plantas, e em geral extratos vegetais com alta toxicidade contra este microcrustáceo possuem alto potencial para atividades biológicas, sendo útil a utilização deste bioensaio para o direcionamento de estudos que visam substâncias bioativas (AMARANTE et al., 2011). O teste de toxicidade contra Artemia salina é relativamente simples, rápido e econômico, e fornece informações de grande utilidade com reprodutibilidade. Testes preliminares com Artemia salina (Leach) (TAS) direcionam para ensaios mais específicos, tais como, a difusão em Ágar, a macrodiluição e microdiluição (ALVES et al., 2008), para a determinação da antimicrobiana e antibacteriana.
Material e métodos
A coleta do fruto foi realizada ás 09h00min, na Chácara Taquaral no município de Santa Rosa de Goiás (16°12’41”S e 49°27’31”W) e a identificação botânica da espécie foi selecionada por profissionais habilitados. Uma exsicata de nº 11990 foi depositada no herbário do Câmpus Anápolis de Ciências Exatas e Tecnológica Henrique Santillo– CCET/UEG. O material botânico foi seco a temperatura ambiente ao abrigo da luz solar direta. Em seguida, as cascas foram reduzidas a pó com o auxílio de um liquidificador doméstico. Os reagentes e solventes P. A. foram utilizados sem purificação prévia, exceto quando os procedimentos requeriam puros. Os reativos para identificação fitoquímica foram preparados de acordo com a literatura (BARBOSA, 2004). Os extratos e frações foram concentrados em evaporador rotatório QUIMIS. Neste trabalho 146,59g do caule foram inicialmente, submetidas à extração contínua em Soxhlet, com o emprego de etanol absoluto P.A.. O extrato bruto etanólico (EBE) foi concentrado, em evaporador rotativo a 40°C e seco até peso constante. Sequencialmente, o EBE foi submetido à extração descontínua com o emprego de solventes em ordem crescente de polaridade (hexano, diclorometano, acetato de etila e butanol). As frações hexânica(FrH); diclorometânica(FrDCM); acetato de etila(FrAcOEt) e butanólica (FrBuOH) obtidas, foram concentradas em evaporador rotativo e secas até peso constante. O EBE e as frações foram submetidas a testes de prospecção fitoquímica conforme BARBOSA (2004). Foram realizados testes para identificar saponinas espumídicas, ácidos orgânicos, açúcares redutores, polissacarideos, fenóis e taninos, flavonoides, alcaloides, esteroides e triterpenos. No decorrer da prospecção fitoquímica observou-se algumas descrições específicas para grupo de metabólito. A toxicidade dos compostos utilizou a metodologia adaptada de Molina & Said (2006). Foi empregado o meio de água marinha sintética, preparado com a dissolução em água destilada de sal marinho (40 g/L). O pH foi ajustado a 8,5 e 80 mg dos náuplios foram incubados por 36 horas em 1 L do meio com iluminação artificial, com temperatura ambiente e oxigenação constante. Após a eclosão, os náuplios foram atraídos por fonte de luz, pipetados e transferidos para uma placa de petri com 5 mL de meio fresco. O bioensaio foi realizado em microplaca de poliestireno estéril de 96 poços na qual foram adicionadas diferentes concentrações (1000, 500, 250, 125 e 62,5 µg/mL) de cada composto.Os náuplios foram distribuídos na placa, padronizando um total de 10±1 de indivíduos em cada poço. Foram incluídos nos ensaios controles positivos, de viabilidade e de letalidade utilizando diluições de K2Cr2O7. Os resultados foram obtidos a partir da contagem do número de componentes vivos e mortos após 24 horas em contato com os compostos em estudo. O cálculo da CDL50 foi pelo método de dose-resposta-Probit (Statistic 10).Todos os ensaios foram em triplicatas.
Resultado e discussão
Após a coleta, secagem e extração foram obtidos 1,66 g de EBE. A extração
descontínua do EBE gerou os extratos fracionados com as seguintes massas:
EFH (0,246g); EFDCM (0,362g), EFAcOEt (0,3538g), EFBuOH (0,1309g). A análise
fitoquímica, realizada em acordo com a metodologia de Barbosa (2004), do EBE
e das frações EFH e EFDCM não evidenciaram a presença de metabólitos
secundários. O resultado foi positivo para saponinas e alcaloides na EFAcOEt
e para saponinas, ácidos orgânicos e açúcares redutores para a EFBuOH.
Possivelmente, testes de abordagem fitoquímica mais específicos e com o
caule macerado e em pó serão realizados para uma nova comparação entre
os resultados obtidos até o presente momento. Os ensaios com Artemia salina
foram desenvolvidos em triplicatas. Porém, as triplicatas foram realizadas
em datas e ambientes diferentes, observando-se assim a influência que o meio
poderia causar no resultado dos testes.O ensaio com o branco, no qual
utilizou-se apenas a solução salina, apresentou mortalidade abaixo de 10%,
demostrando assim que a solução utilizada não influenciou no resultado dos
testes, uma vez que essa solução apenas tinha a função de servir como meio
de eclosão e crescimento da Artemia.
O controle, que possui a capacidade de matar as larvas do crustáceo, obteve
alta toxicidade, matando um elevado número de larvas, possuindo um valor de
CL50 de 130 ppm.
A determinação da toxicidade dos compostos leva em consideração que
compostos que apresentam valores de CL50<1000 ppm apresentam certa
toxicidade frente a Artemia salina (MEYER et al., 1982). No qual são
considerados com baixa toxidade os que apresentam CL50 entre 250 e 1000 ppm,
já extratos com CL50 entre 250 e 80ppm são considerados moderadamente
tóxicos, e com CL50 abaixo de 80 pmm altamente tóxicos (DOLABELA, 1997).
Logo, como frações obtidas do EBE analisadas apresentaram valores de
concentração mínima inibitória acima de 1000 ppm, é conveniente repetir a
análise antes dizer que ambos as frações não são tóxicos frente a Artemia
salina. Já para as frações foram observados valores menores que 1000 ppm,
sendo com atividade de moderada a baixa toxicidade. Os valores de CL50
obtidos para as frações foram: 129,2 ppm (Fr.H - moderamente tóxica);
397,648 ppm (Fr. DCM - baixa toxicidade); 408,041 ppm (Fr.AcOEt - baixa
toxicidade) e 592,712 ppm (Fr. BuOH - baixa toxicidade).
A análise, por CCD, do Fr.H mostrou que o eluente que promoveu a melhor
separação, entre os componentes presentes no EBE, foi à mistura de
hexano/acetato de etila 10%. Pela CCD foi observada uma enorme quantidade de
compostos com Rf’s próximos. Consequentemente, a separação foi desenvolvida
via cromatografia em coluna por gravidade, e 368 frações foram obtidas da
coluna.
Destas frações, as amostras 42A, 50A, 248A e 338A, por apresentarem-se como
um sólido ainda impuro, foram novamente purificadas por cromatografia em
camada preparativa (CCP). A fração 42 A apresentou melhor grau de pureza em
CCD e assim, foi submetida à análise em métodos espectrométricos (IV e
CG/EM).
Os dados de IV (Figura 1) evidenciaram bandas de estiramento de NH em 3490
cm-1, estiramento de CH sp3 em 2980-2890 cm-1 que foram confirmadas com
bandas de deformação angular para CH2 em 1475 cm-1 e para CH3 em 1375 cm-1.
Pode-se observar a deformação angular NH em 1560 cm-1. Além de deformações
angulares em 1100 cm-1 para bandas C-O. A elucidação por RMN ainda está em
processo de obtenção e análise.
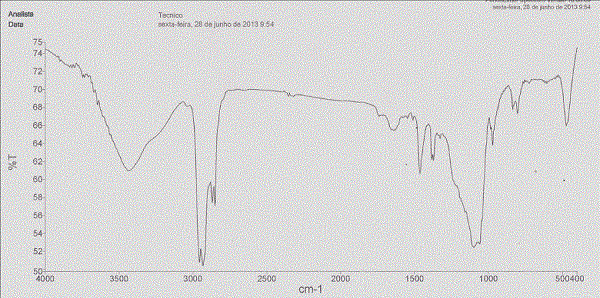
Espectro vibracional de absorção na região do IV da amostra 42A
Conclusões
O estudo inicial do caule da Pithecoctenium crucigerum, com o extrato bruto etanólico e suas frações mostrou-se promissor, tanto para o desenvolvimento científico do aluno, quanto para o isolamento de compostos orgânicos. Os ensaios fitoquímicos, com o EBE e suas frações, evidenciaram testes positivos apenas para saponinas, alcalóides, açúcares redutores e ácidos orgânicos, nas frações acetato e butanólica. Os ensaios com Artemia salina foram satisfatórios,pois apresentaram valores menores que 1000ppm, o que direciona para uma possível atividade biológica das frações. Uma complexa mistura de compostos foi observada pela análise em CCD e purificações por CC e CCP foram realizadas, mais ainda assim sem muito sucesso. A fração hexânica gerou uma amostra sólida ainda não totalmente caracterizada. Análises de RMN 1H e 13C serão aplicadas para elucidar a estrutura do composto. As demais frações obtidas mostraram-se mais complexos e novos estudos por cromatografia serão aplicadas. O estudo com o extrato bruto etanólico obtido por maceração também está sendo realizado para posterior comparação dos resultados.
Agradecimentos
A UEG, CAPES e CNPQ pela bolsa concedida
Referências
ALVES, H. M. A diversidade química das plantas como fonte de fitofármacos. Cadernos Temáticos de Química Nova na Escola, n. 3, mai 2001.
AMARANTE, C. B.; MÜLLER, A. H.; PÓVOA, M. M.; DOLABELA, M. F. Estudo fitoquímico biomonitorado pelos ensaios de toxicidade frente à Artemia salina e de atividade antiplasmódica do caule de aninga (Montrichardia linifera). Acta Amazonica, v.41, n.3, p.431-434, 2011.
BARBOSA, W. L. R. Manual para análise fitoquímica e cromatográfica de extratos vegetais. Revista Científica da UFPA, v.4, 2004.
CIPRIANE, F. A.; CIDADE, F. W.; SOARES, G. L. G.; KAPLAN, M. A. C. Similaridade Química entre as Tribos de Bignoniaceae. Revista Brasileira de Biociências, Porto Alegre, v. 5, supl. 2, p. 612-614, jul. 2007.
DOLABELA, M. F.; COSTA, E. S. S.; PÓVOA, M. M.; OLIVEIRA, D. J.; MÜLLER, A. H.; Estudos farmacognósticos, fitoquímicos, atividade antiplasmódica e toxicidade em Artemia salina de extrato etanólico de folhas de Montrichardia linifera (Arruda) Schott, Araceae. Revista Brasileira de Farmacognosia, v. 19, p. 834-838, 2009.
ENCYCLOPEDIA BRITANNIA FACTS MATTER. Disponível em: <http://global.britannica.com.ez29.periodicos.capes.gov.br/EBchecked/topic/65081/Bignoniaceae> Acesso em: 08/03/2013.
HOSTETTMANN, K. Iridoid glycosides from the stems of Pithecoctenium crucigerum (Bignoniaceae). Science Direct, v. 68, p. 1307-1311, 2007.
MEYER, B. N.; FERRIGNI, N. R., PUTNAM, J. E.; JACOBSEN, L. B.; NICHOLOS, D. E.; MCLAUGHLIN, J.L.; Brine Shrimp: A convenient general bioassay for active plants constituents. Planta Medica, v. 45, p. 31-34. 1982.
MOLINA, S.G.M.; SAID, F.S. A modified microplate cytotoxicity assay with brine shrimp larvae (Artemia salina). Pharmacology online. n. 3, p. 633-638, 2006.
OLMSTEAD, A. G.; ZJHRA, M. L.; LOHMANN, L. G.; GROSE, S. O.; ECKERT, A. J. A Molecular Phylogeny and Classification of Bignoniaceae. American Journal of Botany, v. 96, p. 1731-1743, 2009.
PHILLIPSON, J. D. Phytochemistry and pharmacognosy. Science Direct, v. 68, p. 2960-2972, 2007.
POSER, G. L. The distribution of iridoids in Bignoniaceae. Biochemical Systematics and Ecology, 1999.
SCUDELLER, V. V.; VIEIRA, M. F.; OKANO, R. M. de C. Distribuição Espacial, Fenologia da Floração e Síndrome Floral de Espécies de Bignonieae (Bignoniaceae). Rodriguésia, v. 59, p. 297-307, 2008.
SOUSA, T. W. de A.; SOUSA, I. G. A.; RAMOS, L. M.; COSTA, M. B. Análise fitoquímica e avaliação biológica de Pithecoctenium crucigerum (Bignoniaceae). VI Jornada de Pesquisa e Pós-Graduação, Universidade Estadual de Goiás, 2011.









