PROPRIEDADES VIBRACIONAIS DO CRISTAL DE GLICINA COMPLEXADO COM CROMO
ISBN 978-85-85905-25-5
Área
Materiais
Autores
Rodrigues, J.A.O. (UFMA) ; Neto, J.G.O. (UFMA) ; Reis, I.F.S. (UFMA) ; Santos, C.C. (UFMA) ; Menezes, A.S. (UFMA) ; Santos, A.O.S. (UFMA)
Resumo
O cristal Tris (glicinato) de cromo (III) monohidratado (Cr(C2H4NO2)3H2O) foi crescido pela técnica de evaporação lenta do solvente, por um período médio de 4 semanas e caracterizado pela técnica de Espectroscopia Raman. Segundo os resultados da Espectroscopia Raman foi possível a atribuição dos prováveis modos normais de vibração do cristal, inclusive os modos que comprovam a ocorrência da complexação. A partir do Raman em altas temperaturas foi possível observar que houve o desaparecimento de algumas bandas e o surgimento de outras, principalmente devido a saída da molécula de água. As medidas de Raman em baixa temperatura não mostram mudanças que caracterize uma transformação de fase, pois o material permanece com a mesma estrutura quando submetido à baixas temperaturas.
Palavras chaves
Glicina com cromo; Espectroscopia Raman; Transformação de fase
Introdução
A cristalização é um dos processos mais antigos e importantes da natureza, e se tornou ao longo dos anos uma das mais relevantes áreas de pesquisa científica. A maioria dos cátions metálicos presentes nos organismos vivos interagem com as proteínas, uma vez que os aminoácidos são os constituintes básicos das proteínas, o número de pesquisas sobre cristais de aminoácidos complexados com íons metálicos só vem aumentando (Bush, 2000; Baldez, 2016). Dentre os aminoácidos, a glicina é o exemplo mais simples e, por essa razão, se encaixa em regiões com muitas cadeias peptídicas, sendo utilizada na síntese de muitos compostos proteicos e não proteicos, além de ser um neurotransmissor. Apesar de ser o único aminoácido que não é opticamente ativo, (Bagavan, 2002) pode se apresentar em três formas cristalinas poliméricas, α, β e γ. Ambas as formas α e β cristalizam em grupo espacial centrossimétrico P21/c, enquanto a forma γ cristaliza em grupo espacial não centrossimétrico P31 (Pal et al, 2004). Um dos metais de transição ainda pouco explorado na síntese de complexos com aminoácidos, é o Cr3+. O Cr3+ é um mineral que se comporta como suplemento no tratamento da diabetes mellitus, pois tem um papel importante no metabolismo da glicose. A função biológica do cromo ainda não é totalmente conhecida. Alguns trabalhos sugerem que inicialmente o Cr3+ atua junto à insulina no metabolismo do açúcar que entra na célula, e facilita a interação da insulina com o seu receptor e com a superfície celular (Krejpcio, 2001; Vincent, 2007 ). O cromo aumenta a ligação da insulina às células, o número de receptores da insulina, ativa a cinase do receptor da insulina, e leva ao aumento da sensibilidade à insulina (Anderson, 2000). Entretanto, a pesquisa sobre a síntese de complexos de aminoácidos com cromo não está bem desenvolvida. Dentre os complexos se destaca o Tris(glicinato) de cromo (III) monohidratado [Cr(C2H4NO2)3.H2O] que é obtido a partir da complexação do aminoácido glicina com o íon metálico Cr3+. Alguns trabalhos cogitam a aplicação desse complexo in vivo como um suplemento hipoglicêmico. Um dos procedimentos mais comumente citados para a síntese desse complexo é o de Bryan et al (1971). No entanto, Wallace e Hoggard (1982) relataram que os métodos de síntese não são facilmente reprodutíveis. São necessários muitos ensaios para se obter um produto consistente a partir de determinado procedimento.(Wallace, 1982) Algumas dificuldades na síntese dos cristais de glicina e cromo são as diferenças nas condições de reação (Guindy et al, 2000) possibilidade de muitos produtos (Rasuljan et al, 1989; Calafat et al, 1990) e a formação de isômeros geométricos (Park et al, 1999; Subramaniamet al, 1989). Dessa forma, este trabalho tem como objetivo a síntese do cristal [Cr(C2H4NO2)3.H2O] pelo método de evaporação lenta do solvente e o estudo das suas propriedades vibracionais e estruturais por meio da técnica de Espectroscopia Raman.
Material e métodos
A molécula de glicina no complexo em estudo apresenta dois grupamentos doadores de par eletrônico (carboxilato e amino) se comportando como um ligante bidentado. Enquanto isso, o íon Cromo (III) em geral, apresenta coordenação 6. Assim, cada uma das três moléculas de glicina fazem duas ligações com esse íon metálico. Dessa forma, é necessário que se respeite a proporção 3:1 para que a complexação ocorra. A molécula da água existente no complexo não se liga diretamente ao centro metálico, uma vez que a glicina já completa todas as suas ligações. A reação é mostrada abaixo. 3(C2H5NO2) + (CrCl3).6H2O + 3(NaOH)→Cr(C2H4NO2)3.H2O + 3NaCl + 8H2O A solução cristalina foi preparada de acordo com o método descrito por Earnshaw et al (1961). Os cristais foram obtidos a 30º C a partir de uma solução aquosa (23,33 mL) de glicina (3,76g) e CrCl3.6H2O (4,43 g) na proporção 3:1. com elevação do pH a 8,9 pela adição de solução aquosa (6,66 mL) de hidróxido de sódio (2g). A solução foi filtrada e mantida na estufa a 30°C e após 4 semanas apareceram pequenos cristais avermelhados. As análises de Espectroscopia Raman foram realizadas em pó. Os espectros Raman à temperatura ambiente foram obtidos em um intervalo espectral de 70-1800 cm-1 e 2600-3500 cm-1. Os mesmos são oriundos de um sistema micro-Raman disposto na geometria de retroespalhamento composto por um espectrômetro triplo da Jobin- Yvon modelo T64000 equipado com detector CCD resfriado a ar. Um laser de estado sólido operando na linha 785 nm foi utilizado como fonte de excitação. Para a região de 70 – 1800 cm-1 foi utilizada uma grade de 1800 gr/mm e para a região de 2600 – 3500 cm-1 foi usado uma grade de 300 gr/mm. As fendas foram ajustadas a fim de se obter uma resolução espectral de 2 cm-1. A visualização da amostra deu-se mediante uso de um microscópico da marca Olympus modelo BX41, com câmera de vídeo acoplada. Os espectros Raman em função da temperatura foram obtidos em um forno resistivo acoplado ao espectrômetro descrito acima. As medidas em baixa temperatura foram realizadas no intervalo de 10 a 300 K, e as medidas em alta temperatura foram realizadas em um intervalo de 303 a 423 K. As medidas foram realizadas no Laboratório de Espectroscopia Vibracional e Impedância na Universidade Federal do Maranhão (UFMA) em São Luís.
Resultado e discussão
A fim de se estudar o comportamento do cristal [Cr(C2H4NO2)3.H2O] em baixas
temperaturas, os espectros Raman foram coletados na faixa de temperatura de 10
K à 300 K na região de 70 à 3500 cm−1. Um comportamento detalhado de alguns
modos pode ser visto na Figura 1. No geral, com a diminuição da temperatura os
espectros sofrem leves mudanças, como deslocamento dos modos pra maiores
frequencias, ganho de intensidade e o aparecimento de modos antes ocultos à
temperatura ambiente. Esses modos ocultos aparecem em diferentes temperaturas.
Por exemplo o modo em torno de 71 cm-1 surge na tempertura de 100 K e é
atribuído a vibração τ(COCrN) como visto em Diniz et al (2018). Os modos em 122
e 138 cm-1 surgem somente na temperatura de 70 K e de acordo com Maia et al
(2013) são referentes as vibrações do tipo v(CrN) e δ(CNCr) respectivamente. Já
os modos em 216, 259 e 284 cm-1 aparecem respectivamente nas temperaturas de
130, 100 e 70 K e são todos atribuídos a deformações e torsões da ligação C-C.
O modo em 77 cm-1 sofre um deslocamento significativo para maior energia com a
diminuição da temperatura. De forma diferente ocorreu com o modo em 80 cm-1 que
se manteve quase constante até a temperatura de 30 K quando se deslocou
consideravelmente para menor número de onda e voltou a se deslocar para maior
número de onda na temperatura mais baixa de 10 K, de acordo com os cálculos PED
esse modo se refere a vibração τ(COCrN) + τ(CCOCr). O modo em 83 cm-1 se
desloca para maiores frequências até a temperatura de 70 K, posterior a essa
temperatura o modo sofre deslocamentos pra menores frequências. Já os modos
vizinhos em 90 e 94 cm-1 apresentam um comportamento semelhante. Ambos
apresentam maiores frequências com a diminuição da temperatura, porém sofrem um
mesmo evento em 160 K, a frequência nessa temperatura se mantém igual à da
temperatura anterior, porém na temperatura de 190 K os modos voltam a se
deslocar para maiores números de onda. Os modos em 101 e 110 cm-1 que se
referem a ligações metal-ligante do tipo ν(CrN) apresentam up shift relevante
apenas na temperatura de 220 K. Os demais modos em 125 e 137 cm-1 apresentaram
um deslocamento de quase 5 cm-1 com a proporção que a temperatura foi
diminuída. Os modos em 206, 224, 253 e 262 cm-1 apresentaram um comportamento
semelhante, sofrendo deslocamentos consideráveis para maiores frequências
somente a partir da temperatura de 220 K. O modo em 403 cm-1 já mostrou um
comportamento quase constante, não havendo grandes variações. As principais
ligações dessa região apresentam a contribuição do íon Cr3+, por isso as
mudanças mais relevantes nos comportamentos dos modos que envolvem o íon
metálico juntamente com os átomos de oxigênio e nitrogênio são observados nessa
região. Com a diminuição da temperatura, a maioria dos números de onda mudam
para valores de energia mais elevados, como esperado, porque a constante de
força aumenta à medida que a distância intermolecular diminui. À temperatura de
300 K os modos localizados na faixa de 699 a 751 cm-1 apresentam baixa
intensidade, uma melhor visualização é fornecida com o decorrer da diminuição
de temperatura no qual os modos passam a ganhar intensidade. Existe uma banda
larga em cerca de 751 cm-1 mas a partir de 100 K já é possível ver a divisão em
dois modos diferentes. Na região de 2600 à 3500 cm−1 foram observados doze
modos com números de onda entre 2843 e 3402 cm-1, principalmente devido ao
estiramento dos grupos CH, CH2, NH e OH confirmada pelos cálculos e pela
literatura. Pode ser visto que não há divisão de modos, só há deslocamento dos
picos. Os modos em 2938, 2948 e 2978 cm-1 apresentaram o mesmo comportamento,
se deslocamento para menores frequências, o contrário do modo em 3014 cm-1 que
sofre deslocamento para maiores frequências. Em geral, todos os espectros Raman
apresentaram com a diminuição da temperatura aumento na intensidades dos modos,
diminuição da largura das bandas, deslocamentos, além da separação das bandas
que não são claramente distintas à temperatura ambiente, caracterizando
portanto, que o material permanece com a mesma estrutura em baixa temperatura.
Os espectros Raman na região de 70 à 3500 cm-1 são mostrados na Figura 2. Nessa
região do espectro a maioria das bandas observadas se referem aos modos de
rede, que são atribuídos aos movimentos coletivos das moléculas cristalinas, ou
seja, as vibrações das moléculas como um todo. Consequentemente, podemos
esperar que a posição de cada uma dessas bandas e a dependência de temperatura
estejam correlacionadas internamente com ligações de hidrogênio. Na temperatura
em torno de 373 K observa-se a transformação de fase do material devido o
surgimento e desaparecimento de alguns modos. A banda em 77 cm-1 apresenta um
comportamento contrário ao esperado pois ocorre down shift, já os modos
vibracionais em 83 e 90 cm-1 se deslocam inicialmente para menores frequências
e na temperatura de 300 K acontece um up shift considerável. Em 373 K ocorre o
desaparecimento de uma banda em 94 cm-1 atribuída a τ(CCOCr). Ocorre o
surgimento de dois novos modos na temperatura 373 K, o primeiro modo surge em
torno de 233 cm-1 e é atribuído a v(CrO) + v(CrOC) segundo Diniz (2018) que
observou esse modo em mesmo número de onda. O segundo novo modo aparece em 380
cm-1 e está associado a vibração δ(CCO) que de acordo com Sousa et al (2015)
surge em torno de 374 cm-1[109]. Os modos em 699, 708, 720 e 751 cm-1
apresentam baixa intensidade, dificultando a análise dos respectivos
comportamentos com o aumento da temperatura. Mas no geral, até a temperatura de
363 K esses modos apresentaram uma diminuição nas frequências de forma
gradativa, e somente a partir da temperatura de 373 K essa diminuição ocorre
bruscamente para frequências bem menores. Houve o surgimento de uma banda em
1011 cm-1 na temperatura de 373 K e se refere ao modo τ(HCCN). A banda em 1032
cm-1 referente ao estiramento τ(HNCC) segundo o PED não apresentou grandes
variações. Com o aumento de temperatura grande parte das demais bandas sofreram
deslocamentos consideráveis para maiores frequências a partir da temperatura de
373 K. Houve o desaparecimento de uma banda em 1430 cm-1 na temperatura de 563
K que Sjöberg e seus colaboradores atribuíram a vibração σ(CH2). Já as bandas
em 1434, 1634, 1651, 1657 e 1671 cm-1 se deslocaram para menores frequências
com o aumento da temperatura e são identificados como vibrações referentes as
ligações do aminoácido, como σ(CH2), ν(OC) e δ(NH2), sugeridos pelos cálculos
PED e por outros trabalhos da literatura. Ocorreu o desaparecimento de outra
banda em 1734 cm-1 na temperatura de 553 K que foi atribuída a deformação δ(NH)
como mostrado por Uddin et al (2017). Nessa região de maior energia do espectro
iremos observar as mudanças nas bandas atribuídas predominantemente a vibração
do tipo estiramento das unidades CH, CH2, NH e OH. Por motivos ainda
desconhecidos, o aumento da temperatura ocasionou uma saturação nos espectros,
tornando inviável as medidas nessa região. No intuito de não deixar de realizar
o estudo dos modos de vibração da região em questão, observou-se nas medidas
anteriores em outras regiões que o processo de transformação de fase se
finaliza em torno da temperatura de 393 K. Com isso, a amostra do cristal
[Cr(C2H4NO2)3.H2O] foi aquecida a 393 K por um período de 24 horas na estufa e
posteriormente medida. Apesar de já apresentar baixa intensidade no espectro em
temperatura ambiente, a banda referente ao ν(OH) em 3402 cm-1 perde mais
intensidade, desaparecendo completamente no espectro em alta temperatura,
confirmando assim a saída da água do material.
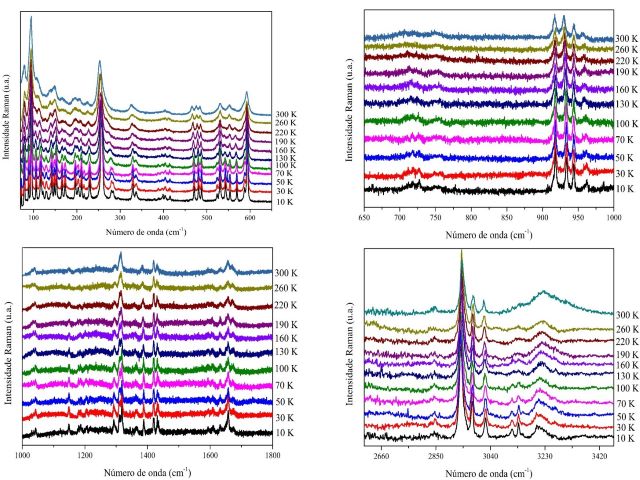
Espectros Raman em função da baixa temperatura

Espectros Raman em função da alta temperatura
Conclusões
Através do método de evaporação lenta do solvente foi possível crescer o monocristal [Cr(C2H4NO2)3.H2O] com boa qualidade cristalina, além de baixo custo operacional. Os resultados de Espectroscopia Raman obtidos pela primeira vez neste trabalho para o cristal [Cr(C2H4NO2)3.H2O], possibilitaram a identificação de vibrações correspondentes as ligações dos grupos funcionais do aminoácido e das ligações metal-ligante, confirmando a formação do complexo. Por outro lado, as medidas de Espectroscopia Raman em função da alta temperatura mostraram a transformação de fase do cristal após a saída da água em torno de 373 K. Já as medidas de Raman em baixa temperatura mostraram que o material não sofre qualquer tipo de transformação de fase.
Agradecimentos
Os autores agradecem a UFMA e a CAPES.
Referências
Bush, A. I. Metals and neuroscience. Current Opinion in Chemical Biology, 2000.
Baldez, T. S. Estudo estrutural, térmico e vibracional do cristal de bis(l-alaninato) de níquel (II) di-hidratado. 79 f. Dissertação (Mestrado em Ciência dos Materiais), Universidade Federal do Maranhão, Imperatriz, 2016.
Bagavan, N. V. Medical Biochemistry. Academic Press, 2002.
Pal, T.; Kar, T.; Bocelli, G.; Rigi, I. Morphology, Crystal Structure, and Thermal and Spectral Studies of Semiorganic Nonlinear Optical Crystal LAHClBr. Crystal growth & design, 4 (2004) 743-747.
Krejpcio, Z. Essentiality of Chromium for Human Nutrition and Health. Polish Journal of Environmental Studies, 10 (2001) 399-404.
Vincent , J. B. A history of Chromium Studies (1955–1995). The Nutritional Biochemistry of Chromium(III), Elsevier, 2007.
Anderson, R.A. Chromium and the Prevention and Control of Diabetes. Diabetes & Metabolism, 26 (2000) 22-27.
Bryan, R. F.; Greene, P. T.; Stokely, P. F.; Wilson Jr, E. W. The Crystal and Molecular Structure of Tris(glycinato)chromium(III) Monohydrate, Cr(C2H4NO2)3 H2O. Inorganic Chemistry,10, (1971) 1468–1473.
Wallace, W. M.; Hoggard, P. E. In Search of The Purple Isomer of Tris(glycinato)-Chromium (III). Inorg. Chim. Acta, 65 (1982) L3-L5.
Guindy, N. M.; AbouGamra, Z. M.; Abdel Messih, M. F. Kinetic Studies on the Complexation of Chromium(III) with some Amino Acids in Aqueous Acidic Medium. Monatshefte fur Chemie, 131 (2000) 857-866.
Rasuljan,M.; &Al.Rashid, H. Preparation And Infrared Studies of Hydroxyl Bridged Chromium (III) Complexes Of L Glutamic Acid. Jour. Chem, Soc. Pak, 11 (1989).
Calafat, A. M.; Fiol, J. J.; Terron, A.; Moreno, V.; Goodgame, D. M. L.; Hussain, I. Ternary Chromium (III) –Nucleotide-Amino Acid Complexes: l-Methionine, L-Serine and Glycine Derivatives. Inorg. Chim. Acta, 169 (1990) 133-139.
Park, S. J.; Choi Y. K.; Han S. S.; Lee, K.W. Sharp Line Electronic Spectroscopy And Ligand Analysis of Cr(III) Complexes With Amino Acid Ligands. Bull Korean Chem Soc., 20 (1999) 1475-1478.
[Subramaniam, V.; Hoggard, P. E. Meridional Coordination of Diethylenetriamine to Chromium(III). Inorg. Chim. Acta, 155 (1989)161-163.
Earnshaw, A.; Lewis, J. Polynuclear Compounds. Part I. Magnetic Properties of Some Binuclear Complexes. J. Chem. Soc., 396 (1961) 396 – 404.









