AVALIAÇÃO DO POTENCIA INIBITORIO DO COMPLEXO DE ZINCO COM ENZIMAS DE SCHISTOSOMA MANSONI
ISBN 978-85-85905-25-5
Área
Bioquímica e Biotecnologia
Autores
Faria, M.B. (UFMA) ; Bastos, R.S. (UFMA-CIENATEC) ; Silva, W.F. (UFMA) ; Faria, C.B. (UFMA) ; Sousa, M.B. (UFMA) ; Silva, S.T.P. (IFPA) ; Ribeiro, F.V.S. (IFPA) ; Barbosa, E.S. (UFPA) ; Rocha, J.A. (UFMA-CIENATEC) ; Lima, B.A.V. (UFMA-CIENATEC)
Resumo
A Schistosoma mansoni e um parasita causador de doenças infecciosas conhecida como esquistossomose famosa popularmente como barriga d’água ou doença dos caramujos. O processo de docagem interagiu com o complexo de zinco {Zn[CH3O(NO2)C6H3NNNC6H3(NO2)OCH3]2(C5H5N)2}, com o objetivo de estudar suas interações moleculares, através do software computacional AUTODOCK 1. 5. 6. Por meio do mesmo foi possível analisar as constantes de interação e suas energias de ligação, podendo observar os surgimentos de pontes de hidrogênio, assim dando ênfase na melhor interação da S. mansoni com relação ao ligante estudado, o melhor resultado foi da Thioredoxin glutathione reductase (TGR), assim obtendo resultados para comparação de melhor interação entre o ligante e o enzima.
Palavras chaves
Docagem Molecular; Schistosoma mansoni; Complexo de zinco
Introdução
A Schistosoma mansoni, e o parasita causador da esquistossomose, também conhecida como barriga dàgua ou "febre do caramujo", é uma doença parasitária causada pela infecção do verme do gênero Schistosoma, são comum em regiões tropicais e subtropicais, transmitidos através dos caramujos infectados de agua doce, que servem como intercessores entre os hospedeiros humanos (WHO 2017). A maior parte das infecções nos seres humanos acontece por falta de saneamento adequado e a higiene precária nas populações mais pobres (PHILIPPSEN & DEMARCO, 2019). Alguns das pessoas infectada por esses parasitas são, dores abdominais, diarreia e fezes sangrentas. Esse verme produz ovos que são excretados nas fezes humanas, e bastante preocupante, esse parasita é extremamente perigoso podendo levar uma pessoa a morte (ROCHA et al., 2018). Hoje o principal tratamento oferecido é feito com o praziquantel, um anti- helmíntico antiparasitário, que ja e usado para esquistossome por mais de 30 anos, existe uma grande preocupação com o aumento da resistência dos parasitos sobre a ação desse fármaco (SANCHEZ et al., 2019), a cada dia o controle se torna mais difícil, assim diminuindo o número de curas com essa resistência a droga não surge efeito, pois a mesma so tem efeito em adultos imaturos, assim faz necessário o estudo de novos fármacos anti-esquistossoma (EL-BESHBISHI et al., 2019). mesmo assim pouco se e invertido pelas indústrias farmacêuticas, afirma que nos últimos anos apenas 1% das novas drogas introduzidas foram 33 para aplicação em doenças negligenciadas (TROULIER et al., 2002). No ranque mundial de doenças negligenciadas a Esquistossomose ocupa o primeiro lugar com uma superioridade de 200 milhões de pessoas e aproximadamente 280.000 mortes anuais (NJOROGE et al., 2014).
Material e métodos
Este trabalho teve como principal objetivo a análise da interação do complexo {Zn[CH3O(NO2)C6H3NNNC6H3(NO2)OCH3]2(C5H5N)2}, com 7 alvos enzimáticos da esquistossomose, Arginase (ARG), Cathepsin B1 Isotype 1 (2CB1), Histone Deacetylase 8 (HDAC8), Methylthioadenosine Phosphorylase (MTAP), Puntative Uridine Phosphorylase (UP), Purine Nucleoside Phosphorylase (PNP), Thioredoxin Glutathione Reductase (TGR), de códigos respectivos 4Q3P, 3QSD, 4CQF, 4L5A, 4TXH, 1TCU, 2V6O, disponíveis no banco de dados Protein Data Bank (PDB) visando o estudo da sua atividade inibitória (ROCHA et al., 2018). O desenho da estrutura molecular do complexo {Zn[CH3O(NO2)C6H3NNNC6H3(NO2)OCH3]2(C5H5N)2} foi realizado com o auxílio do software gráfico GaussView5, os cálculos computacionais para a otimização foram feitos através do programa Gaussian 9w (Gaussian, 2009), o método empregado para esse procedimento foi o de Density Functional Theory (DFT), empregando o funcional hibrido B3LYP e 6-311++g(d,p) como conjunto de bases (ABDEL-LATIF, 2018; HE et al, 2018; MONDAL et al, 2018; CHAI et al, 2018) quântica empregado para o ajuste estrutural necessário, evitando erros nas ligações químicas (BIAN et al., 2019). O cálculo biológico do ligante-enzima ocorreu através do software AutoDockTools, preparando o ligante e a macromolécula para interação, foi ajustado o grid box 60x60x60 no sitio ativo de cada enzima estudada. O algoritmo atribuído foi o Lamarckian GA, os demais parâmetros foram realizados como o padrão, para realizar a análise da menor energia de ligação e a taxa de inibição do fármaco para cada enzima distinta (ROCHA et al., 2018; FERREIRA, 2015).
Resultado e discussão
O resultado do complexo de zinco na interação com o enzima S. Mansoni, teve
como melhor resultado a proteína Thioredoxin glutathione reductase (TGR) com
energia de ligação igual a -7,13 kcal mol-1 e uma constante de inibição 5,97µM,
apesar de um otimo valor de energia de ligação e uma constante inibitória muito
boa, ocorreu 5 formações de ponte de hidrogênio e um total de 10 interações
hidrofóbicas nos resíduos aminoácidos.
A enzima Methylthioadenosine 64 phusphorylase não formou pontes de hidrogênio,
mas teve 5 interações hidrofóbicas, seus parâmetros de interação foi de -5,59
kcal mol-1 de energia de ligação e 80,24µM de constante de ligação. A enzima 2CB1
formou 2 pontes de hidrogênio, seus parâmetros de interação foi de -4,98 kcal
mol-1 de energia de ligação e 223,1µM de constante de ligação, formando também 12
interações hidrofóbicas.
A enzima Purine nucleoside phosphorylase (PNP) formou 3 pontes de hidrogênio,
seus parâmetros de interação foi de -4,82 kcal mol-1 de energia de ligação e
295,1µM de constante de ligação, formando também 19 interações hidrofóbicas. A
enzima Histone deacetylase 8 (HDAC8) formou 4 pontes de hidrogênio, seus
parâmetros de interação foi de -0,64 kcal mol-1 de energia de ligação e
341.460,00 µM de constante de ligação, formando também 5 interações hidrofóbicas.
Para Putative uridine phosphorylase(UP) teve-se 8,82 kcal mol-1 de energia de
ligação, não houve constante de inibição, tendo 3 pontes de hidrogênio e formando
9 interações hidrofóbicas. A enzima arginase (ARG) obteve 662,05 kcal mol-l de
energia de ligação onde não teve constante de inibição, formou com 7 pontes de
hidrogênio e 14 interações hidrofóbicas.

Docagem Molecular com a TGR, A) Interação 2D, B) interação de Ribbons.
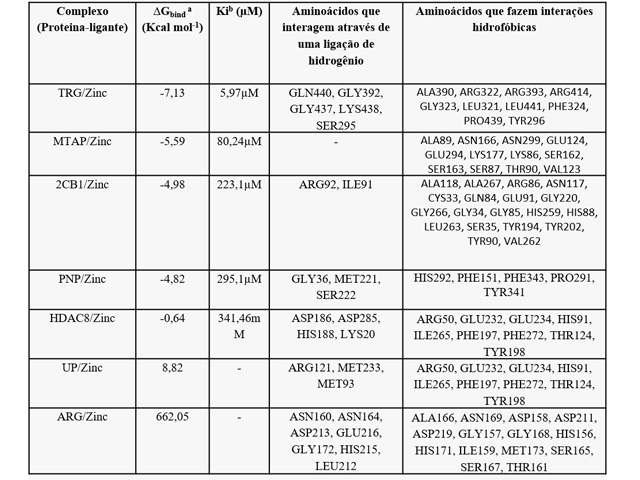
Parâmetros de docagem molecular
Conclusões
Foi notório a eficiência do processo de docagem nas sete enzimas com o ligante de zinco, no qual teve boas interações e obtendo várias pontes de hidrogênios e um excelente rendimento nas interações hidrofóbicas moleculares pôde ser observado. Assim por meio dos dados obtidos foi possível observar que a enzima extraída da Thioredoxin glutathione reductase (TGR), resultante do processo de simulação molecular, foi a que apresentou melhores resultados sob os parâmetros de interação previstos para esse estudo, proporcionando um grande potencial do ligante para inibição dessa doença.
Agradecimentos
Agradeço a Deus por estar sempre me proporcionando dias melhores, minha família, os assistentes técnicos da UFMA campus Grajaú e a minha filha ketly mirely por ser minha fonte de inspiração.
Referências
ABDEL-LATIF, Samir A.; MOHAMED, Adel A. Novel Zn (II) complexes of 1, 3-diphenyl-4-(arylazo) pyrazol-5-one derivatives: Synthesis, spectroscopic properties, DFT calculations and first order nonlinear optical properties. Journal of Molecular Structure, v. 1156, p. 712-725, 2018.
CHAI, Lan-Qin et al. Synthesis, structural characterization, spectroscopic, and DFT studies of two penta-coordinated zinc (II) complexes containing quinazoline and 1, 10-phenanthroline as mixed ligands. Journal of Luminescence, v. 203, p. 234-246, 2018.
PHILIPPSEN, Gisele S.; DEMARCO, Ricardo. Impact of transposable elements in the architecture of genes of the human parasite Schistosoma mansoni. Molecular and biochemical parasitology, v. 228, p. 27-31, 2019.
FERREIRA, Isabelle Mariane de Lima. Estudo por simulação molecular do sistema proteína quinase-inibidores NATAL, RN 2015. 2015. Trabalho de Conclusão de Curso. Universidade Federal do Rio Grande do Norte.
Frisch, M. J.; Trucks, G. W.; Schlegel, H. B.; Scuseria, G. E.; Robb, M. A.; Cheeseman, J. R.; Scalmani, G.; Barone, V.; Mennucci, B.; Petersson, G. A.; Nakatsuji, H.; Caricato, M.; Li, X.; Hratchian, H. P.; Izmaylov, A. F.; Bloino, J.; Zheng, G.; Sonnenberg, J. L.; Hada, M.; Ehara, M.; Toyota, K.; Fukuda, R.; Hasegawa, J.; Ishida, M.; Nakajima, T.; Honda, Y.; Kitao, O.; Nakai, H.; Vreven, T.; Montgomery, J. A., Jr.; Peralta, J. E.; Ogliaro, F.; Bearpark, M.; Heyd, J. J.; Brothers, E.; Kudin, K. N.; Staroverov, V. N.; Kobayashi, R.; Normand, J.; Raghavachari, K.; Rendell, A.; Burant, J. C.; Iyengar, S. S.; Tomasi, J.; Cossi, M.; Rega, N.; Millam, M. J.; Klene, M.; Knox, J. E.; Cross, J. B.; Bakken, V.; Adamo, C.; Jaramillo, J.; Gomperts, R.; Stratmann, R. E.; Yazyev, O.; Austin, A. J.; Cammi, R.; Pomelli, C.; Ochterski, J. W.; Martin, R. L.; Morokuma, K.; Zakrzewski, V. G.; Voth, G. A.; Salvador, P.; Dannenberg, J. J.; Dapprich, S.; Daniels, A. D.; Farkas, Ö.; Foresman, J. B.; Ortiz, J. V.; Cioslowski, J.; Fox, D. J. Gaussian 09, Revision D.01. Gaussian, Inc.: Wallingford CT, 2009.
HE, L. J. et al. Highly-efficient sensitizer with zinc porphyrin as building block: Insights from DFT calculations. Solar Energy. Elsevier. p. 283-290, 2018.
MONDAL, Apurba Sau et al. Synthesis of a zinc (II) complex with hexadentate N4S2 donor thioether ligand: X-ray structure, DNA binding study and DFT computation. Journal of Molecular Structure, v. 1164, p. 94-99, 2018.
MOTA, Alberto AR et al. Fotofísica Teórica (DFT) de Sondas Fluorescentes Benzotiadiazólicas. Revista Virtual de Química, v. 7, n. 1, p. 357-389, 2014.
ROCHA, Jefferson A. et al. Computational quantum chemistry, molecular docking, and ADMET predictions of imidazole alkaloids of Pilocarpusmicrophyllus with schistosomicidal properties. PloS one, v. 13, n. 6, p. e0198476, 2018.
STOLFA, D. A.; MAREK, M.; LANCELOT, J.; HAUSER, A. T.; WALTER, A.; LEPROULT, E.; MELESINA, J.; RUMPF, T.; WURTZ, J. M.; CAVARELLI, J.; SIPPL, W.; PIERCE, R. J.; ROMIER, C.; JUNG, M. Molecular Basis for the Antiparasitic Activity of a Mercaptoacetamide Derivative That Inhibits Histone Deacetylase 8 (HDAC8) from the Human Pathogen Schistosoma mansoni. Journal of Molecular Biology, v. 426, n. 20, p. 3442–345, 2014.
World Health Organization (WHO). Disponivel em: http://www.who.int/schistosomiasis/en/. Acesso em 06 de maio de 2019.









