POTENCIAL ANTILEISHMANIAL DE COMPLEXO DE CADMIO CONTRA LEISHMANIA AMAZONENSES E LEISHMANIA MAJOR
ISBN 978-85-85905-25-5
Área
Bioquímica e Biotecnologia
Autores
Bastos, R.S. (UFMA-CIENATEC) ; Araujo, J.L. (UFMA-CIENATEC) ; Sousa, M.B. (UFMA-CIENATEC) ; Silva, W.F. (UFMA) ; Faria, M.B. (UFMA) ; Ribeiro, F.V.S. (IFPA) ; Silva, S.T.P. (IFPA) ; Barbosa, E.S. (UFPA) ; Rocha, J.A. (UFMA-CIENATEC) ; Lima, B.A.V. (UFMA-CIENATEC)
Resumo
A Leishmania é um protozoário patogênico agente causador da leishmaniose, ocorre por picadas de flebotomíneos, presente em três formas cutânea, mucocutânea e visceral. objetivo deste estudo foi realizar as interações in sílico do complexo di-l-cloro- bis [cloro (4,7-dimetil-1, 10-fenantrolina) cádmio (II)] com dois alvos de leishmania 1LML e 5GO1. O melhor resultado da docagem molecular foi o alvo da L. major, com uma energia de ligação de -7,64 kcal mol-1, sua constante de inibição foi de 2,5 µM, demonstrando o potencial para o desenvolvimento de drogas contra esse parasita.
Palavras chaves
Docagem Molecular; Cádmio; Leishmania
Introdução
A Leishmania é um protozoário patogênico agente causador da leishmaniose (TVEDTEN, 2012), atualmente a terceira doença parasitaria mais importante, logo após a malária e a filariose linfática. A leishmaniose é responsável por 59.000 mortes por ano, presente de forma genérica em 88 países, presente na Europa nos países França, Itália, Grécia, Malta, Espanha e Portugal, contudo não é presente no sudeste asiático (BARRETT e STANBERRY, 2009). A transmissão da leishmania ocorre por picadas de flebotomíneos, presente em três formas cutânea, mucocutânea e visceral (KIM; WEISS; TANOWITZ, 2016). Estima-se um total de 14 milhões de pessoas infectadas por leishmania em todo mundo, o melhor habitat para os vetores são florestas tropicais presentes na América Latina (VEGA-LOPEZ e RITCHIE, 2014). O objetivo deste estudo foi realizar as interações in sílico do complexo di-l- cloro-bis [cloro (4,7-dimetil-1, 10-fenantrolina) cádmio (II)] (WARAD et al. 2012) com dois alvos de leishmania, LEISHMANOLYSIN (SCHLAGENHAUF; ETGES; METCALF, 1998) para a Leishmania major e para Leishmania amazonenses a proteína da Nucleoside diphosphate kinase (MISHRA et al., 2017), com códigos respectivos 1LML e 5GO1, disponíveis no banco de dados Protein Data Bank (BERMAN et al., 2000) visando o estudo da sua atividade inibitória por meio de docagem molecular.
Material e métodos
Foi feito a otimização molecular do complexo de cadmio através do programa Gaussian 9w (Gaussian, 2009), O método adotado foi o Density Functional Theory (STRATMANN et al., 1997), com funcional hibrido B3LYP (JAIN; AHUJA; SHARMA, 2004) e conjunto de base SDD (CAO e DOLG, 2002). Realizou-se as docagens através do software AutoDockTolls 1.5.6 (Morris et al., 2009), para o preparo do ligante e da macromolécula, adicionando os hidrogênios, realizando o cálculo parcial de cargas Gasteiger, mesclando os hidrogênios não polares. O grid foi selecionado nas coordenadas x, y e z do sitio ativo, do resíduo LYS 11 para a Nucleoside diphosphate kinase (5GO1) e HIS 264 para LEISHMANOLYSIN (1LML), utilizando uma caixa cúbica de 60 x 60 x 60 e um parâmetro metálico AD4. O algoritmo adotado no processo foi o Lamarckian GA. Durante a simulação ocorreu 100 corridas com 150 populações e evals long, por fim analisando as melhores conformações (ROCHA, 2018).
Resultado e discussão
O melhor resultado da docagem molecular foi o alvo da L. major, com uma energia
de ligação de -7,64 kcal mol-1, sua constante de inibição foi de 2,5 µM (Tabela
1), essa interação não gerou pontes de hidrogênio, porem formou 11 interações
hidrofóbicas. A 1LML é o principal componente da promastigota, sendo ativa na
superfície dos polipeptídicos, lipofosfoglicanos e glicoinositolfosfolipídeo,
possuindo papel de importância para injeção dos prosmatigotas na alimentação dos
flebotomíneos, gerando dessa forma infecção dos macrófagos (SCHLAGENHAUF; ETGES;
METCALF, 1998).
KEIGHOBADI et al. (2019) realizou estudo de reaproveitamento de antifúngicos
azólicos testando o potencial de atividade antileishmanial, o composto 4-cloro
TF-2 no processo de docagem do mesmo a energia de ligação foi de −7,63 kcal mol-1
semelhante ao resultado obtido em nosso trabalho, o autor afirma que esse
composto é candidato promissor para o desenvolvimento de agentes
antileishmanianos.
A 5GO1 desenha papel de relevância na reação de catalise do grupo γ-fosfato,
possui também importância fundamental para proliferação de metástase tumoral.
Essa enzima também é responsável pela manutenção das células do hospedeiro dando
ênfase no benefício do parasito (MISHRA et al., 2017). A L. amazonenses obteve
como parâmetros uma constante de inibição de 50,44 µM e energia de ligação de
-5,86 kcal mol-1 e 9 interações hidrofóbicas, não gerando nenhuma interação por
ponte de hidrogênio.
Em estudo de docagem com alvo da L. amazonenses, o composto 4 de fenil-hidrazidas
de DE LIMA et al. (2019) obteve uma energia de ligação -4,66 Kcal mol-1
demonstrando atividade contra promastigotas, sendo um potencial para compostos
antileishmanial, apesar disso sendo inferior aos -5,86 kcal mol-1 obtidos com o
complexo de cadmio.

Parâmetros de docagem molecular com alvos Leishmania
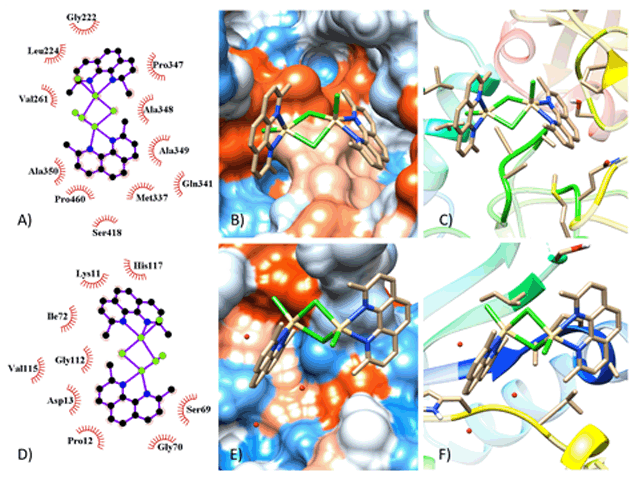
A)Interação em 2D (1LML) B)Estrutura em ribbons C)Superfície de Contato D)Interação em 2D (5GO1) E)Superfície de Contato F)Estrutura em ribbons
Conclusões
Através do estudo in silico desse complexo de cadmio di-l-cloro-bis [cloro (4,7- dimetil-1, 10-fenantrolina) cádmio (II)] com alvos de Leishmania amazonenses e Leishmania major, sendo estes ultimo o melhor resultado de −7,63 kcal mol-1 de energia de ligação e uma constante de inibição 2,5 µM, é possível verificar o potencial para o desenvolvimento de drogas contra esse parasita com base na estrutura do complexo de cadmio.
Agradecimentos
Agradeço aos técnicos da UFMA e a todos membros que trabalham com bioinformática no grupo CIENATEC.
Referências
BARRETT, Alan DT; STANBERRY, Lawrence R. Vaccines for biodefense and emerging and neglected diseases. Academic Press, 2009.
BERMAN, Helen M. et al. Th e protein data bank. Nucleic Acids Res, v. 28, p. 235-242, 2000.
CAO, Xiaoyan; DOLG, Michael. Segmented contraction scheme for small-core lanthanide pseudopotential basis sets. Journal of Molecular Structure: THEOCHEM, v. 581, n. 1-3, p. 139-147, 2002.
DE LIMA, Evanoel Crizanto et al. Phenylhydrazides as inhibitors of Leishmania amazonensis arginase and antileishmanial activity. Bioorganic & medicinal chemistry, v. 27, n. 17, p. 3853-3859, 2019.
Frisch, M. J.; Trucks, G. W.; Schlegel, H. B.; Scuseria, G. E.; Robb, M. A.; Cheeseman, J. R.; Scalmani, G.; Barone, V.; Mennucci, B.; Petersson, G. A.; Nakatsuji, H.; Caricato, M.; Li, X.; Hratchian, H. P.; Izmaylov, A. F.; Bloino, J.; Zheng, G.; Sonnenberg, J. L.; Hada, M.; Ehara, M.; Toyota, K.; Fukuda, R.; Hasegawa, J.; Ishida, M.; Nakajima, T.; Honda, Y.; Kitao, O.; Nakai, H.; Vreven, T.; Montgomery, J. A., Jr.; Peralta, J. E.; Ogliaro, F.; Bearpark, M.; Heyd, J. J.; Brothers, E.; Kudin, K. N.; Staroverov, V. N.; Kobayashi, R.; Normand, J.; Raghavachari, K.; Rendell, A.; Burant, J. C.; Iyengar, S. S.; Tomasi, J.; Cossi, M.; Rega, N.; Millam, M. J.; Klene, M.; Knox, J. E.; Cross, J. B.; Bakken, V.; Adamo, C.; Jaramillo, J.; Gomperts, R.; Stratmann, R. E.; Yazyev, O.; Austin, A. J.; Cammi, R.; Pomelli, C.; Ochterski, J. W.; Martin, R. L.; Morokuma, K.; Zakrzewski, V. G.; Voth, G. A.; Salvador, P.; Dannenberg, J. J.; Dapprich, S.; Daniels, A. D.; Farkas, Ö.; Foresman, J. B.; Ortiz, J. V.; Cioslowski, J.; Fox, D. J. Gaussian 09, Revision D.01. Gaussian, Inc.: Wallingford CT, 2009.
JAIN, R.; AHUJA, B. L.; SHARMA, B. K. Density-Functional Thermochemistry. III. The Role of Exact Exchange. Indian Journal of Pure & Applied Physics, v. 42, p. 43-48, 2004.
KEIGHOBADI, Masoud et al. Repurposing azole antifungals into antileishmanials: Novel 3-triazolylflavanones with promising in vitro antileishmanial activity against Leishmania major. Parasitology international, v. 69, p. 103-109, 2019.
KIM, Kami; WEISS, Louis M.; TANOWITZ, Herbert B. Parasitic infections. In: Murray and Nadel's Textbook of Respiratory Medicine. WB Saunders, 2016. p. 682-698. e8.
MISHRA, Arjun K. et al. Discovery of novel inhibitors for Leishmania nucleoside diphosphatase kinase (NDK) based on its structural and functional characterization. Journal of computer-aided molecular design, v. 31, n. 6, p. 547-562, 2017.
ROCHA, Jefferson A. et al. Computational quantum chemistry, molecular docking, and ADMET predictions of imidazole alkaloids of Pilocarpus microphyllus with schistosomicidal properties. PloS one, v. 13, n. 6, p. e0198476, 2018.
SCHLAGENHAUF, Edith; ETGES, Robert; METCALF, Peter. The crystal structure of the Leishmania major surface proteinase leishmanolysin (gp63). Structure, v. 6, n. 8, p. 1035-1046, 1998.
STRATMANN, R. Eric et al. Improving harmonic vibrational frequencies calculations in density functional theory. The Journal of chemical physics, v. 106, n. 24, p. 10175-10183, 1997.
TVEDTEN, Harold. Cytology of inflammatory or neoplastic masses. In: Small Animal Clinical Diagnosis by Laboratory Methods. WB Saunders, 2012. p. 337-363.
VEGA-LOPEZ, Francisco; RITCHIE, Sara. Dermatological problems. In: Manson's Tropical Infectious Diseases. WB Saunders, 2014. p. 995-1026. e1.
WARAD, Ismail et al. Novel di-μ-chloro-bis [chloro (4, 7-dimethyl-1, 10-phenanthroline) cadmium (II)] dimer complex: synthesis, spectral, thermal, and crystal structure studies. Research on Chemical Intermediates, v. 39, n. 6, p. 2451-2461, 2013.









