Avaliação térmica de micropartículas de Goma Arábica e Gelatina reticuladas com ácido tânico
ISBN 978-85-85905-25-5
Área
Bioquímica e Biotecnologia
Autores
Alexandre, J. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Barroso, T. (UNIVERSIDADE FEDERAL DO CEARÁ) ; Araújo, A.W. (UNIVERSIDADE FEDERAL DO CEARÁ) ; Romão, A.L. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Castelo, R. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Furtado, R. (EMBRAPA)
Resumo
A coacervação complexa se destaca dentre as técnicas de microencapsulamento pelo baixo custo e facilidade operacional. Contudo, muitas vezes requer processos de reticulação química para uma maior resistência das partículas frente a alterações de pH, força iônica e temperaturas no meio. Este trabalho teve o objetivo de produzir matriz de encapsulamento baseado em goma arábica e gelatina reticuladas com ácido tânico e avaliar o seu comportamento térmico. Soluções de 0,65% (m/v) dos biopolímeros foram usadas e as micropartículas resultantes submetidas à análise de TGA e DSC. As micropartículas reticuladas apresentaram aumento na temperatura de degradação. Verificou-se que a reticulação química favoreceu a estabilidade térmica das micropartículas.
Palavras chaves
Microencapsulação; Reticulação Química; Ácido tânico
Introdução
Proteínas e polissacarídeos podem ser excelente material de parede para o aprisionamento de substâncias de interesse. Entre as técnicas de microencapsulação, a coacervação complexa desperta interesse devido às condições operacionais e por apresentar boa eficiência de encapsulamento (SHADDEL et al., 2018). A técnica consiste na atração eletrostática entre biopolímeros de cargas opostas seguidos de separação de fases devido à neutralização de cargas, sendo fortemente influenciados pelo pH, razão biopolimérica, temperatura e força iônica (MUHOSA et al., 2019). A gelatina (GE), um dos biopolímeros mais aplicados como matriz no processo de coacervação complexa, é um material proteico biodegradável derivado da hidrólise parcial do colágeno e apresenta vantajosa solubilidade em água, capacidade emulsificante e espessante, além da alta atividade de reticulação devido à presença dos grupos aminos (PAULA et al., 2019). A goma arábica (GA), obtida de exsudado dos caules e ramos da Acacia senegal, possui cadeias polipeptídicas hidrofóbicas e hidrofílicas que lhe confere propriedades emulsificantes, sendo um ingrediente bastante utilizado nas indústrias de alimentos e farmacêuticas. Possui ainda solubilidade em água, baixa viscosidade, tem propriedade filmogênica, características de não- toxicidade e biodegradabilidade (SANCHEZ et al., 2018; AREPALLY et al., 2019). Apesar da técnica de coacervação complexa ser simples e de baixo custo, esta apresenta algumas desvantagens como a estabilidade do material coacervado frente a certas condições de pH, força iônica e temperaturas, fazendo-se necessário realizar o processo de reticulação química, que consiste em utilizar um agente reticulante para melhorar a resistência das micropartículas (TIMILSENA et al., 2017). O ácido tânico pertence ao grupo dos taninos, contém em sua estrutura abundantes grupos hidroxila, permitindo sua utilização como agente reticulante, sobretudo de moléculas proteicas, como a gelatina. A reticulação ocorre devida à formação da interação de ligações de hidrogênio entre os grupos carbonila da gelatina e os grupos hidroxila do ácido tânico (HU et al., 2016). Desta forma, este estudo teve como objetivo produzir micropartículas de GA/G reticuladas com ácido tânico e avaliar o seu comportamento térmico.
Material e métodos
Material A goma arábica (GA) foi adquirida da JB Química Indústria e Comercio Ltda, gelatina (GE) 225H tipo B foi proveniente da Rousselout® e o ácido tânico PA da marca Synth. Formação das micropartículas reticuladas de GA/GE A metodologia de preparo dos coacervados em solução de 0,65% (m/v) de biopolímeros seguiu procedimento descrito por Nascimento et al. (2016), sendo utilizada a proporção de 1:3 (m/m) (goma arábica:gelatina). Inicialmente foi preparada uma emulsão com volume de 200 mL. Posteriormente, foram adicionados 400 mL de água destilada. As etapas foram homogeneizadas em ultraturrax (IKA® T25) a 10.000 rpm por 15 minutos. Por fim, o pH da mistura foi ajustado com HCl (2M) e NaOH (2M) para 4,5 e a solução foi submetida a refrigeração a 4°C overnight. Após a formação dos coacervados, o material foi centrifugado a 10000 rpm, por 10 minutos, a 25°C. O precipitado foi recolhido para o processo de reticulação química. O processo de reticulação foi realizado, dissolvendo ácido tânico (AT) (6,9%, m/m) em 100 mL de água destilada e aquecendo a 40°C. Foi feita a adição dos coacervados a solução e agitação mecânica por 30 min, seguido de três centrifugações consecutivas com água destilada nas condições de 4.000 rpm por 3 min a 25°C. O produto final foi submetido ao processo de liofilização. Após secas, as micropartícula reticuladas (R) e não reticuladas (NR) foram submetidas às análises térmicas. Análise Termogravimétrica (TGA) A análise foi realizada em dispositivo STA 6000 da marca PerkinElmer. Para o procedimento, 5 a 10 mg das amostras foram colocadas em um prato aberto e tarado. Cada amostra foi aquecida sob atmosfera de nitrogênio a uma taxa de 10°C/min, tendo a temperatura variando de 25 a 600°C, com uma taxa de vazão do gás de 20 mL/ min. Análise de Calorimetria Exploratória Diferencial (DSC) A análise foi realizada em um equipamento do tipo DSC Q20 da marca TA Instruments. Cerca de 5mg das micropartículas foi colocada em uma panela de alumínio selada e o calor foi aplicado continuamente a partir de 25°C a 300°C, com uma taxa de aquecimento de 10°C/ min e taxa de vazão de nitrogênio de 20 mL /min.
Resultado e discussão
A análise termogravimétrica (TGA) é utilizada para investigar processos
relacionados a estabilidade térmica e decomposição, desidratação e oxidação
(XIAO et al., 2014). A TGA mede as variações da massa de uma amostra em
função da temperatura e do tempo durante o aquecimento (TENGKU-ROZAINA,
BIRCH, 2019). A figura 1 apresenta as curvas termogravimétricas diferenciais
(DTG) para as amostras de micropartículas não reticuladas (figura 1a) e
reticuladas (figura 2a). A partir das figuras é possível observar que ambas
apresentam eventos de decomposição em temperatura próxima a 100 °C,
indicando a perda de água livre ligadas à GA e GE (XIAO et al., 2014;
OLIVEIRA et al., 2018; SILVA et al., 2018). O pico máximo apresentado
refere-se à degradação da rede polimérica. As amostras não reticuladas
apresentaram menor temperatura de degradação (313 °C) quando comparadas as
reticuladas (322 °C), refletindo em cerca de 68 % de perda de massa em ambos
os casos. O aumento na temperatura de degradação indica que o processo de
reticulação proporcionou aumento na estabilidade térmica das
micropartículas. Xiao et al. (2018) ao produzirem micropartículas
de óleo de lavanda por coacervação complexa, tendo como materiais de parede
GA e GE observaram também um pico na DTG próximo a 313 °C.
A técnica DSC mede os fluxos de calor durante uma transição de fase da
amostra ou alterações térmicas durante as reações de oxidação em função do
tempo e da temperatura (TENGKU-ROZAINA, BIRCH, 2019). Os dados térmicos
obtidos por DSC são apresentados na figura 2. Não foi possível identificar a
temperatura de transição vítrea das amostras. Pode-se observar um pico em
cerca de 100 °C sendo este, provavelmente, referente à temperatura de fusão
da gelatina livre presente nas partículas, que é menor do que a temperatura
de fusão do complexo formado (abaixo de 150 °C). Oliveira et al. (2018) ao
realizarem uma triagem térmica, por meio do DSC, de gelatina e goma de
cajueiro e do filme formado por estes dois biopolímeros, encontraram a
temperatura de 98 °C para o processo de fusão da gelatina. O evento
endotérmico significativo a 150 °C indica a temperatura de fusão das
micropartículas.
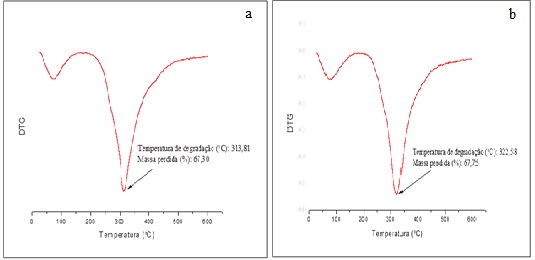
Análise termogravimétrica de Micropartículas não reticuladas (a) e reticuladas (b)

Curvas de DSC para micropartículas de GA/GE não reticuladas (a) e reticuladas (b)
Conclusões
A reticulação química com ácido tânico proporcionou melhoria na estabilidade térmica das micropartículas, aumentando a temperatura de degradação polimérica em 9ºC.
Agradecimentos
À CAPES (Coordenação de Aperfeiçoamento de Pessoal de Nível Superior) pela bolsa concedida e à EMBRAPA (Empresa Brasileira de Pesquisa Agropecuária) pela infraestrutura e suporte financeiro.
Referências
AREPALLY, D.; GOSWAMI, T.K. Effect of inlet air temperature and gum Arabic concentration on encapsulation of probiotics by spray drying. LWT, v. 99, 583-593, 2019.
HU, S.; WANG, T.; FERNANDEZ, M. L.; LUO, Y. Development of tannic acid cross-linked hollow zein nanoparticles as potential oral delivery vehicles for curcumin. Food Hydrocolloids, v. 61, 821-831, 2016.
MUHOZA, B.; XIA , S.; CAI, J.; ZHANG, X.; DUHORANIMANA, E.; SU, J. Gelatin and pectin complex coacervates as carriers for cinnamaldehyde: Effect of pectin esterification degree on coacervate formation, and enhanced thermal stability. Food Hydrocolloids, v. 87, 712-722, 2019.
NASCIMENTO, M. A.; DA SILVA, L. C.; FURTADO, R. F.; OLIVEIRA, M. A.; MENDES, L. G.; ALVES, C. R. Uso de goma de cajueiro e gelatina para a formação de microcápsulas de óleo de pequi por coacervação complexa. In: Congresso Brasileiro de Ciência e Tecnologia de Alimentos, 2016, Gramado. Anais do XXV Congresso Brasileiro de Ciência e Tecnologia de Alimentos. Gramado, Brasil, 2016.
OLIVEIRA, M.A.; FURTADO, R.F.; BASTOS, M.S.R.; LEITÃO, R.C.; BENEVIDES, S.D.; MUNIZ, C.R.; CHENG, H.N.; BISWAS, A. Performance evaluation of cashew gum and gelatin blend for food packaging. Food Packaging and Shelf Life, v.17, 57-64, 2018.
PAULA, D.A.; MARTINS, E.M.F.; COSTA, N.A.; OLIVEIRA, P.M.; OLIVEIRA, E.B.; RAMOS, A.M. Use of gelatin and gum arabic for microencapsulation of probiotic cells from Lactobacillus plantarum by a dual process combining double emulsification followed by complex coacervation. International Journal of Biological Macromolecules, v. 133, 722-731, 2019.
SANCHEZ, C.; NIGEN, M.; TAMAYO, V.M.; DOCO, T.; WILLIAMNS, P.; AMINA, C.; RENARD, D. Acacia gum: History of the future. Food Hydrocolloids, v. 78, 140-160, 2018.
SHADDEL, R.; HESARI, J.; AZADMARD-DAMIRCHI, S.; HAMISHEHKAR, H.; FATHI-ACHACHLOUEI, B.; HUANG, Q. Use of gelatin and gum Arabic for encapsulation of black raspberry anthocyanins by complex coacervation. International Journal of Biological Macromolecules, v. 107, 1800-1810, 2018.
SILVA, F.; TORRES, L.; SILVA, L.; FIGUEIREDO, R.; GARRUTI, D.; ARAÚJO, T.; DUARTE, A.; BRITO, D.; RICARDO, N. Cashew gum and maltrodextrin particles for green tea (Camellia sinensis var Assamica) extract encapsulation. Food Chemistry, v. 261, 169-175, 2018.
SOARES, B.S.; SIQUEIRA, R.P.; CARVALHO, M.G.; VICENTE, J.; GARCIA-ROJAS, W.W. Microencapsulation of sacha inchi oil (Plukenetia volubilis L.) using complex coacervation: Formation and structural characterization. Food Chemistry, v. 298, 125045, 2019.
TENGKU-ROZAINA, T.M.; BIRCH, E.J.; Thermal Analysis for Lipid Decomposition by DSC and TGA. Encyclopedia of food chemistry, v.2, 345-352, 2019.
TIMILSENA, Y. P.; WANG, B.; ADHIKARI, R.; ADHIKARI, B. Advances in microencapsulation of polyunsaturated fatty acids (PIFAs)-rich plant oils using compex coacervation: A review. Food Hydrocolloids, v. 69, 369-381, 2017.
XIAO, Z.; LIU, W.; ZHU, G.; ZHOU, R.; NIU, Y. Production and characterization of multinuclear microcapsules encapsulating lavender oil by complex coacervation. Flavour and Fragrance Journal, v.29, 166-172, 2014.









