Síntese enzimática e avaliação de atividade antioxidante do oleato de ascorbila
ISBN 978-85-85905-25-5
Área
Bioquímica e Biotecnologia
Autores
Costa, K.A.D. (URI-ERECHIM) ; Wlodarkievicz, M.E. (URI-ERECHIM) ; Denti, A.F. (URI-ERECHIM) ; Ostrowski, G.M. (URI-ERECHIM) ; Dallago, R.M. (URI-ERECHIM) ; Cansian, R.L. (URI-ERECHIM) ; Zeni, J. (URI-ERECHIM) ; Paroul, N. (URI-ERECHIM)
Resumo
O objetivo do estudo foi realizar a esterificação enzimática do ácido L- ascórbico com ácido oleico a fim de obter um antioxidante natural de baixa polaridade. Para determinar a temperatura e o tempo reacional foi realizado um ensaio cinético a 40°C, 55°C e 70°C em 1,5 h de reação. O oleato de ascorbila foi isolado por cromatografia em coluna e determinada a atividade antioxidante dos substratos e do produto obtido. O maior rendimento (50%) foi obtido à temperatura 70°C em 1h de reação. O ácido ascórbico apresentou maior atividade antioxidante (IC50 0,448μg/ml) seguido pelo oleato de ascorbila (IC50 36μg/ml), já o ácido oleico não apresentou atividade. Os resultados obtidos apontam o potencial de uso do oleato de ascorbila como antioxidante em sistemas lipossolúveis.
Palavras chaves
Ácido ascórbico; Esterificação enzimática; Atividade antioxidante
Introdução
O consumo de alimentos processados e congelados aumentou muito nos últimos anos devido às necessidades impostas pela vida moderna, onde o tempo de preparo doméstico dos alimentos é um fator limitante. A temperatura e o tempo necessários para produção e alimentos processados, além das condições de transporte e de armazenamento, são alguns dos fatores que podem contribuir para alterações químicas, muitas delas relacionadas à contaminação microbiana e a oxidação lipídica, causando não apenas perdas nutricionais de qualidade, mas também gerando compostos indesejáveis, e até mesmo potencialmente prejudiciais à saúde humana. Devido à tendência atual pela procura cada vez maior de produtos de origem natural pelos consumidores, causada pela crescente preocupação com saúde, torna-se necessário o estudo do uso de produtos naturais e seus derivados como antioxidantes em substituição aos conservantes convencionais. A vitamina C (ácido L-ascórbico) está entre os antioxidantes naturais mais abundantes utilizados nos campos alimentícios, farmacêuticos e cosméticos. Entretanto, a natureza polar do ácido ascórbico torna sua aplicação limitada (TORRES et al., 2007). Uma das formas de alterar sua solubilidade é através da esterificação com ácidos graxos, como o ácido oleico, formando oelato de ascorbila. Segundo Watanabe et al. (2001), os ascorbil ésteres são compostos anfifílicos que mantêm propriedades antioxidantes do ácido ascórbico, ou seja, quando incorporados em alimentos mantem a proteção (similar ao ácido ascórbico) contra os danos oxidativos causados por radicais livres (ROSS et al., 1999). A biocatálise aplicada na produção de ésteres de ácido ascórbico é uma alternativa ligada a Green chemistry, útil e promissora que foi eleita como uma das principais áreas de pesquisas emergentes para a manufatura sustentável (SÁ et al, 2017; SOUZA et al., 2017). Quando comparado à um processo químico tradicional, os processos enzimáticos são altamente eficientes e enantiosseletivos, geralmente reduzem o tempo de processo, o número de etapas e os resíduos gerados, além de ganhos energéticos já que as reações ocorrem as temperaturas bem mais amenas (WOHLGEMUTH, 2010; CHOI, HAN e KIM; 2015).As enzimas mais utilizadas na síntese orgânica são as lipases, sendo aplicadas em inúmeras preparações comerciais, devido a sua ampla especificidade e maior estabilidade (em comparação com outras enzimas) (KAPOOR; GUPTA, 2012). As lipases particularmente atuam na interfase água-óleo ou óleo-água, ocorrendo uma ativação interfacial da enzima, fazendo com que sua atividade catalítica dependa do estado de agregação e estrutura do substrato, das propriedades moleculares da enzima e dos fatores que afetam as ligações enzima-substrato. Esta ativação envolve um rearranjo da estrutura, deixando livre o sítio ativo da enzima para que aconteça uma mudança conformacional na presença de gotas de óleo em água (AKANBI; BARROW, 2015). Diante do exposto, o objetivo do trabalho foi realizar a síntese enzimática de oleato de ascorbila a fim de obter um antioxidante lipossolúvel.
Material e métodos
Avaliação do tempo reacional da produção enzimática de oleato de ascorbila em função da temperatura A escolha das condições reacionais foi baseada em dados descritos na literatura por Chang et al. (2009), Zhao et al. (2011) e Burham et al. (2009), sendo razão molar dos substratos (1:9 de ácido ascórbico:ácido oleico), concentração da enzima fixa em 30% (m/m substratos), 2% (m/m) de peneira molecular (4Å Sigma-Aldrich), agitação constante em Shaker de 125 rpm, com avaliação de três temperaturas 70, 55 e 40 ºC. Alíquotas de 0,5 mL foram removidas do meio reacional nos tempos de 10, 20, 30, 40, 50, 60 e 90 min. A produção de oleato de ascorbila em função do tempo foi determinado pelo consumo do reagente limitante (ácido ascórbico) mediante titulação com solução de iodo 0,01N até aparecimento de coloração azulada, persistente por quinze segundos (metodologia adaptada de Instituto Adolfo Lutz, 2008). Isolamento do oleato de ascorbila Para a condição de maior obtenção de oleato de ascorbila foi realizada a purificação do produto para posterior análise antioxidante. Após o término da reação a mistura reacional foi filtrada para separação da enzima e das peneiras moleculares. O ácido ascórbico residual foi separado por extração líquido-líquido com água destilada (3 vezes de 20 mL). O isolamento do produto foi realizado por cromatografia em coluna empacotada com sílica gel 60 usando uma mistura de solventes acetato de etila:n-hexano, 50:50 (v/v) como eluente. As frações coletadas foram acompanhadas por cromatografia de camada delgada (CCD) usando fase móvel formada por clorofórmio:metanol:ácido acético:água (81:9:8:2 v/v). Para revelação das cromatofolhas foi usada uma solução 5% de ácido sulfúrico em etanol, sendo a placa aquecida a 110 °C por 30 min segundo a metodologia descrita por Burham et al.(2009). Atividade antioxidante A atividade antioxidante do oleato de ascorbila e seus precursores foi determinada pelo método espectrofotométrico que se baseia na medida da extinção da absorção do radical 2,2-difenil-1-picril-hidrazil (DPPH) à 515 nm (VANIN et al., 2014). A determinação da atividade antioxidante consistiu na incubação, durante 30 minutos, de 500 µL de uma solução etanólica, contendo o composto diluído, com 500 µL de uma solução etanólica de DPPH 0,1mmol.L-1. O percentual de captação do radical DPPH foi calculado em termos de porcentagem de atividade antioxidante (AA%), conforme a Equação 1: AA%=100-{[(Abs.amostra-Abs.branco)×100]÷Abs. controle} (1) Onde: Abs.amostra: absorbância da amostra; Abs.branco:absorbância do branco; Abs.controle:absorbância do controle. A leitura espectrofotométrica foi realizada em espectrofotômetro UV-Visível, após a avaliação da faixa de concentração ideal, calculou-se a quantidade do composto necessária para capturar 50% do radical DPPH (IC50) por regressão linear.
Resultado e discussão
Avaliação cinética da produção enzimática de oleato de ascorbila
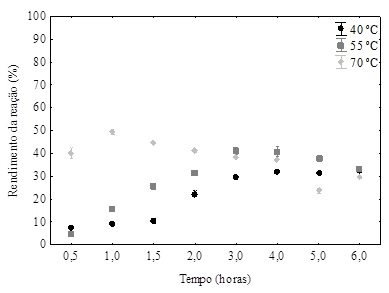
Para investigar o efeito da temperatura, as reações de esterificação foram
realizadas na faixa de temperaturas de 40°C, 55°C e 70 °C, mantendo razão
molar ácido ascórbico: ácido oleico 1:9, 30 % (m/m de substratos) de carga
enzimática e taxa de agitação 125 rpm (Figura 1).
Figura 1 – Efeito da temperatura sobre a conversão de oleato de ascorbila
usando a razão molar 1:9 (ácido ascórbico-ácido oleico), concentração da
enzima de 30% e agitação de 125 rpm em solvente terc-butanol.
Como pode ser observado na Figura 1, o amento da temperatura influencia na
produção de oleato de ascorbila (OA) já na fase inicial da reação. O maior
rendimento de OA foi obtido na maior temperatura (70 ºC) com conversão de 50
% em 1 h de reação. Em temperaturas mais altas, a taxa de reação aumenta
porque a energia cinética das moléculas também aumenta, o que facilita
colisões e interações efetivas entre as moléculas de substrato e o
catalisador (RODRIGUEZ-NOGALES; ROURA; CONTRERAS, 2005). No entanto, a 70 ºC
foi detectado conversão final menor que nas temperaturas de 55 e 40 ºC,
provavelmente devido a desativação térmica da lipase (YADAV; DHOOT,2009).
Além disso, percebe-se que depois de 1h da reação houve decréscimo gradual
do rendimento da reação por causa da hidrólise ou de oxidação do ácido
ascórbico exposto à temperatura mais elevada (AUSTRIA; SEMENZATO; BETTERO,
1997).
Isolamento de oleato de ascorbila
A amostra utilizada para a isolamento de produto foi obtida no tempo
reacional de 1 hora, razão molar de 1:9, 30% (m/m) enzima, 70 °C, 50 mL em
solvente terc-butanol a 125 rpm. Verificou-se que o cromatograma apresentou
três bandas (zonas), uma corresponde ao substrato ácido L-ascórbico, outra
ao ácido oleico e a outra se refere ao produto da reação. O ácido ascórbico,
não apresentou banda eluida (Rf = 0,088), pois em função da sua alta
polaridade e baixa afinidade com solventes não sai da linha de aplicação,
interagindo com a fase estacionária. Já o ácido oleico, por ser apolar,
possui grande afinidade pela fase móvel e elui juntamente com ela (Rf =
0,85), apresentando a sua banda na linha do solvente. O oleato de ascorbila
apresenta polaridade intermediária do ácido ascórbico e do ácido oleico e,
por isso, sua banda é revelada em um Rf diferente dos reagentes de 0,62,
demonstrando a formação do produto.
Antioxidante
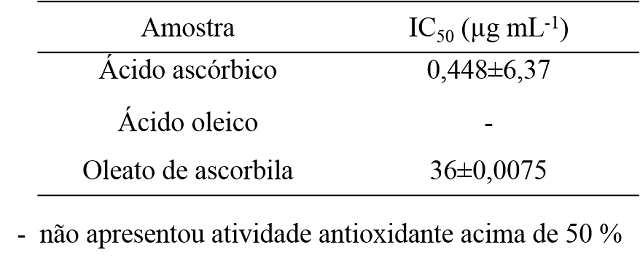
Na Tabela 1, estão apresentados os resultados das atividades antioxidantes
expressas em termos de IC50 dos substratos (ácido ascórbico e
ácido oleico) e do produto (oleato de ascorbila).
Tabela 1 - Resultados das atividades antioxidantes dos substratos ácido
ascórbico e ácido oleico e do produto oleato de ascorbila.
Observando IC50 dos substratos (ácido ascórbico e ácido oleico),
verificou-se que o ácido ascórbico apresenta potencial antioxidante com
IC50 de 0,448 µg mL-1, valor próximo encontrado por
Verruck (2012) e Negri, Possamai e Nakashima (2009) (0,25 e 0,44 µg
mL-1), respectivamente. Já o ácido oleico não apresentou
concentração capaz de inibir 50% da atividade do DPPH (IC50)
demonstrando não possuir propriedades antioxidantes. O Oleato de ascorbila
apresentou atividade antioxidante inferior em relação ao seu precursor
(ácido ascórbico), mas ainda é muito promissora.
Conclusões
A partir dos resultados obtidos pode-se observar a influência da temperatura no sistema reacional para a obtenção do oleato de ascorbila. O maior rendimento (50%) foi obtido à temperatura 70 ºC, razão molar ácido ascórbico:ácido oleico 1:9, concentração de enzima 30% (m/m) substratos. O método de purificação utilizado no estudo foi eficiente visto que o oleato de ascorbila apresentou um nível substancial de atividade antioxidante (36 µg/mL), destacando a sua possível utilização em alimentos lipossolúveis.
Agradecimentos
Os autores agradecem ao CNPq e URI pela concessão de bolsas e/ou apoio financeiro.
Referências
AKANBI, T. O.; BARROW, C. J. Incorporação catalisada por Lipase de EPA em óleo de emu: formação e caracterização de novos lipídios estruturados. Journal of Functional Foods, v. 19, p. 801-809, 2015.
AUSTRIA, R.; SEMENZATO, A.; BETTERO, A. Stability of vitamin C derivatives in solution and topical formulations. Journal of Pharmaceutical and Biomedical Analysis, v. 15, n. 6, p. 795–801, 1997.
BURHAM, H.; RASHEED, R.A.G.A.; NOOR, N.M.; BADRUDDIN, S.; SIDER, H. Enzymatic synthesis of palm-based ascorbyl esters. Journal of molecular catalysis B: enzymatic, v.58, p. 153-157, 2009.
CHANG, S.W.; YANG, C. J.; CHEN, F.Y.; AKOH, C. C.; SHIEH, C. J. Optimized synthesis of lipase-catalyzed l-ascorbyl laurate by Novozym® 435.Journalof Molecular Catalysis B: Enzymatic, v.56, n.1, p.7-12, 2009.
NEGRI, M. R. S.; POSSAMAI, J. C.; NAKASHIMA, T. Atividade antioxidante das folhas de espinheira-santa - Maytenusilicifolia Mart. secas em diferentes temperaturas. Brazilian Journal of Pharmacognosy, v. 19, p. 553-556, 2009.
RODRIGUEZ-NOGALES, J. M.; ROURA, E.; CONTRERAS, E. Biosynthesis of ethyl butyrate using immobilized lipase: a statistical approach. Process Biochemistry, v. 40, n. 1, p. 63–68, 2005.
ROSS, D.; MENDIRATTA, S.; QU, Z.-C.; COBB, C.E.; MAY, J. Ascorbate 6-palmitate protects human erythrocytes from oxidative damage. Free Radical Biology and Medicine, v. 26, p. 81-89, 1999.
SÁ, A. G. A.; MENESES, A. C.; ARAÚJO, P. H. H.; OLIVEIRA, D. A review on enzymatic synthesis of aromatic esters used as flavor ingredients for food, cosmetics and pharmaceuticals industries. Trends in Food Science e Technology, v. 69, p. 95-105, 2017.
SOUZA, S. P; ALMEIDA, R. A. D.; GARCIA, G. G.; LEÃO, R. A. C.; BASSUT, J.; SOUZA, R. O. M. A.; ITABAIANA JR, I. Immobilization of lipase B from Candida antarctica on epoxy‐functionalized silica: characterization and improving biocatalytic parameters. Chemical Technology an Biotechnology, v. 93, p. 105-111, 2017.
WOHLGEMUTH, R. Biocatalysis – key to sustainable industrial chemistry. Current Opinion in Biotechnology, v. 21, p. 713–24, 2010.
CHOI, J.-M.; HAN, S.-S.; KIM, H.-S. Industrial applications of enzyme biocatalysis: Current status and future aspects. BiotechnologyAdvances, v. 33, p. 1443-1454, 2015.
VANIN, A. B. Produção, propriedades biológicas, antioxidantes e toxicidade do bioaromatizante obtido via esterificação enzimática de óleo essencial do cravo-da-índia (Caryophyllusaromaticus). 2014. 139 fl. Tese (Doutorado em Engenharia de Alimentos) – Universidade Regional Integrada do Alto Uruguai e das Missões – Campus Erechim. Erechim, 2014.
TORRES, A. DE P.; PEÑALVER, P.; PÉREZ-VICTORIA, I.; RONDON, D.; MORALES, J.C. Synthesis of new phenolic fatty acid esters and their evaluation as lipophilic antioxidants in an oil matrix. FoodChemistry, v. 105, p. 657-665, 2007.
VERRUCK, S. Caracterização química, atividade antioxidante e antimicrobiana de três espécies de frutos do gênero Campomanesiasp. 2012. 75 f. Trabalho de conclusão de curso Tecnologia de alimentos, Concórdia, 2012.
WATANABE, Y.; ADACHI, S.; FUJII, T.; NAKANISHI, K.; MATSUNO, R. Surface Activityof 6-O-Hexanoyl, Octanoyl, DecanoylandDodecanoylAscorbates. Japan Journal of Food Engineering, v. 2, n. 2, p. 73-75, 2001.
YADAV, G. D.; DHOOT, S. B. Immobilized lipase-catalysed synthesis of cinnamyl laurate in non-aqueous media. Journal of Molecular Catalysis B: Enzymatic, v. 57, n. 1–4, p. 34–39, maio 2009.
ZHAO, H.; ZHANG, Y.; LU, F.; BIE, X.; LU, Z.; NING, H. Optimized enzymatic synthesis of ascorbyl esters from lard using Novozym 435 in co-solvent mixtures. Journal of Molecular Catalysis B: Enzymatic, v. 69, p. 107–111, 2011.









