APLICAÇÃO DE SISTEMAS AQUOSOS BIFÁSICOS PARA PURIFICAÇÃO DE PROTEASES DE ORA-PRO-NÓBIS (Pereskia aculeata Milli)
ISBN 978-85-85905-25-5
Área
Alimentos
Autores
Nolasco Alves, A. (UESB) ; da Costa Ilheu Fontan, R. (UESB) ; Nascimento Amaral, P. (UESB) ; Pereira Flores Santos, M. (UESB) ; Reinert Ramos Gandolfi, O. (UESB) ; Silva de Sousa, L. (UESB) ; Ferreira Bonomo, R.C. (UESB)
Resumo
As proteases são enzimas de grande importância na indústria pois são aplicadas em diversos setores como o alimentício, têxtil e farmacêutico. Objetivou-se neste trabalho estudar o comportamento de partição de proteases extraídas de ora-pro-nóbis (Pereskia aculeata Milli) em sistemas aquosos bifásicos formados por PEG 1500 g/mol+fosfato de sódio nas temperaturas de 10°C e 25°C. Verificou-se que para as temperaturas estudadas, o aumento na concentração de polímero e sal reduziram a recuperação da enzima e consequentemente a seletividade do sistema. O aumento da temperatura foi favorável a partição da protease, visto que os coeficientes de partição da proteína e da enzima foram distantes de um, o que resultou no aumento do índice de recuperação (79%) e da seletividade (11).
Palavras chaves
Enzima; Partição; Atividade
Introdução
As proteases são enzimas que atuam na hidrólise de ligações peptídicas das proteínas, convertendo-as em suas menores unidades, os peptídeos e aminoácidos e podem ser encontradas naturalmente em plantas, animais fungos e bactérias (DAMODARAN). Nos seres humanos elas possuem importante papel em mecanismos regulatórios e nutricionais, enquanto que nos vegetais, participam de processos de germinação e senescência (CHINNADURAI et al., 2018). As proteases são enzimas de grande interesse por parte da indústria pois são aplicadas em diversos setores como na produção de detergentes, indústria têxtil, produção de fármacos. Seu uso mais expressivo é na indústria de alimentos, onde são utilizadas principalmente na produção de queijos, como agente coagulante, além de serem usadas na texturização de carnes e modificação de propriedades funcionais de proteínas como a solubilidade, capacidade emulsificante e de formação de espuma (SUN et al., 2016). Mesmo podendo ser obtidas a partir de diversas fontes, as de origem microbiana ainda são usadas preferencialmente pela indústria. Apesar do seu uso ainda ser limitado em razão da pequena quantidade de enzima extraída de uma grande massa de vegetal, as enzimas de origem vegetal vêm despertando o interesse da indústria devido a vantagens como alta especificidade de substrato e estabilidade em ampla faixa de pH e temperatura (ALICI et al., 2018) Proteases já foram identificadas de diversas famílias de plantas, como a bromelina, papaína e ficsina. Em estudos recentes, plantas pertencentes à família das cactáceas se mostraram uma possível fonte para extração de proteases (SUN et al. 2016). A ora-pro-nóbis (Pereskia aculeta Milli), que pertence a essa família, é uma planta amplamente conhecida por seu alto valor nutracêutico associado ao seu conteúdo de cálcio, fibras, ferro e principalmente de proteínas que pode chegar a 28%. Mesmo com seu consumo cultural expressivo em localidades da região sudeste do país, a ora- pro-nóbis ainda é classificada como uma hortaliça não convencional pois suas técnicas de cultivo não foram exploradas, assim como seu potencial na suplementação da alimentação humana. Também não constam na literatura dados sobre o uso da ora-pro-nóbis como uma fonte para extração de proteases (SANTOS et al., 2012). A aplicação de enzimas na medicina, indústria alimentícia e farmacêutica requer alto grau de pureza. As estratégias de purificação, também chamadas de downstream processing, são tradicionalmente baseadas em procedimentos de precipitação, filtração por membrana e cromatografia. A aplicação dessas técnicas pode comprometer a estabilidade da biomolécula e nem sempre resultam em alto rendimento. Além disso, resultam no aumento do custo de produção correspondem a mais de 80% do custo total. Nesse contexto, se faz necessário o desenvolvimento de técnicas que permitam alto rendimento e que não comprometam a estrutura da biomolécula (BOM et al., 2008; LIMA et al., 2017). Os sistemas aquosos bifásicos (SAB) têm sido usados com sucesso em etapas de purificação e recuperação de muitos materiais biológicos como proteínas, enzimas, células, material genético entre outros (ASEJO et al., 2011). O SAB é formado pela mistura de dois líquidos imiscíveis ou parcialmente imiscíveis, como soluções aquosas de dois polímeros, um polímero e um sal, líquido iônico e sal, ou um álcool e um sal. A distribuição desigual da molécula entre as duas fases é resultado de um delicado balanço de interações entre a biomolécula e as outras espécies presentes nas fases. As vantagens dessa técnica incluem a operação continua, facilidade de integração de processos, baixa toxicidade dos constituintes do sistema, além da biocompatibilidade, pois são formados majoritariamente por água (BENAVIDES et al., 2008; ASEJO et al., 2011). Diante disso, o objetivo desse trabalho é estudar a partição de proteases extraídas de ora-pro-nóbis (Pereskia aculeta Milli) em sistemas aquosos bifásicos formados por PEG+fosfato de sódio, nas temperaturas de °C e 25°C.
Material e métodos
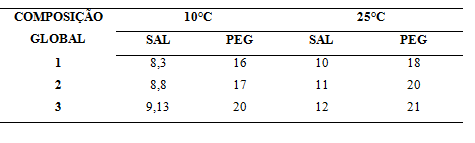
Obtenção do extrato: As folhas de ora-pro-nóbis utilizadas neste trabalho foram adquiridas no município de Itapeting-Ba. Após a seleção e lavagem das folhas, as mesmas foram secas até remoção total da umidade. Para a extração de proteases foi utilizado 14 mL/g de amostra de tampão fosfato de sódio 0,1M pH 7,0 por 90 minutos. Determinação de proteínas totais: A concentração de proteína foi determinada usando a metodologia descrita por Bradford (1976). Albumina de Soro Bovino (BSA) foi usada como padrão. Determinação da atividade enzimática: A atividade enzimática foi determinada pela hidrólise da caseína (1,0%) diluída em tampão fosfato de potássio 0,1M pH6,0 a 37°C (KUNITZ, 1947). Para parar a reação foi utilizado 1,0mL de ácido tricloroacético 10%. O precipitado foi removido por centrifugação a 3400 rpm por 15 min, e a absorbância do sobrenadante foi medida a 280nm. Uma unidade de atividade enzimática foi considerada como a quantidade de enzima que libera 1μmol/mL de tirosina por min. Os resultados foram expressos em atividade proteolítica específica (U/mg). Partição de proteases em SAB: Os estudos de partição foram realizados SAB formados por polímero+fosfato de sódio pH 7,0. As composições globais estão apresentadas na Tabela 1. Os sistemas foram formados com as quantidades adequadas de solução estoque de PEG, fosfato de sódio e água para uma massa total de 5g em tubos de centrífuga e mantidos em repouso até o equilíbrio em estufa B.O.D na temperatura de estudo. As fases foram coletadas com auxílio de seringas e agulhas e depois determinado o teor de proteínas e a atividade enzimática de cada fase. Para o cálculo da quantidade de solução salina para o preparo do sistema, foi considerada a porcentagem de sal presente na solução de fosfato de sódio usada na etapa de extração. DETERMINAÇÃO DOS PARÂMETROS DE PARTIÇÃO: O coeficiente de partição foi utilizado para avaliar a separação na extração. O coeficiente de partição para a atividade enzimática (Ke) foi obtido pela razão da atividade enzimática na fase superior pela inferior do sistema. O coeficiente de partição da partição da proteína(Kp), que determina a concentração de equilíbrio da proteína na fase superior e na fase inferior foi obtido pela razão entre concentração da proteína na fase superior e inferior. A seletividade (S) foi calculada pela relação entre coeficiente de partição da enzima e da proteína. Para selecionar o SAB com melhor capacidade de extração das proteínas estudadas, foi calculada a recuperação teórica (Y %) do sistema, utilizando-que leva em consideração a razão volumétrica entre as fases e o coeficiente de partição da enzima.
Resultado e discussão
Como mostrado na Tabela 2, a partição de proteases é altamente dependente da
composição e do sistema e da temperatura. Os parâmetros de partição não
foramavaliados na composição 3 a 10°C devido a cristalização do sistema.
Nesta temperatura, o Kp obtido de todos os sistemas foi inferior a 1,
indicando que a maioria das proteínas foram particionadas preferencialmente
para a fase inferior, permanecendo em maior concentração na fase superior
as enzimas com atividade proteolítica (Ke>1), e como resultado o alto índice
de recuperação do sistema (73,808%). Verifica-se também que o aumento na
diferença da composição dos sistemas não foi favorável a separação da enzima
pois este apresentou menor valor de Ke, o que indica que as proteases foram
particionadas para a fase inferior, reduzindo também a seletividade e
recuperação quando comparado com a composição 1.
O mesmo comportamento foi observado na temperatura de 25°. Em
sistemas formados por altas concentrações de seus componentes pode ser
observada a partição da biomolécula para a interface como resultado do
efeito combinado do volume de exclusão e salting out (BABU et al., 2008).
Comportamento semelhante também foi observado por Nandini et al.
(2008), que relatam a redução da recuperação e do fator de purificação na
partição de lipase com o aumento da concentração de sal e peg em sistemas
formados por PEG 6000 e fosfato de sódio pH 9,0 a 25°C.
Rawdkuen et al. (2010) estudaram o efeito da concentração de sal na
partição de proteases de Calotropis procera em SAB formados por diferentes
sais (sulfato de amônio, fosfato de potássio e sulfato de magnésio), em
diferentes concentrações (14% (w/w), 17% (w/w), 20% (w/w)) e relataram que
o aumento da concentração de sulfato de amônio e sulfato de magnésio
favoreceram o aumento da partição da protease para a fase salina, enquanto o
aumento na concentração de fosfato provocou a redução do coeficiente de
partição da enzima, assim como a redução da seletividade e recuperação.
Ao avaliar o efeito da temperatura verifica-se que o aumento da
temperatura favoreceu o processo de transferência de massa. Algumas
condições do sistema influenciam o efeito da temperatura na partição de
proteínas e enzimas, como a composição das fases e interações hidrofóbicas
(BARBOSA et al., 2011).
O aumento da temperatura provoca mudanças no comportamento do
diagrama de fases e consequentemente na partição de biomoléculas. Essa
alteração na curva de equilíbrio pode proporcionar uma maior diferença entre
as fases e consequentemente um coeficiente de partição mais distante de um
(ALBERTSSON, 1986).

Conclusões
É possível concluir com o presente estudo que variáveis como temperatura e a concentração dos constituinte dos sistema foram significativos na partição de proteases extraídas de ora-pro-nóbis em sistemas formados por PEG 1500 e fosfato de sódio. Verificou-se que o aumento da temperatura favoreceu a partição das proteases. Isso aconteceu devido a mudanças no equilíbrio de fases, o que faz com que a diferença de fases seja maior e consequentemente o coeficiente de partição seja mais distante da unidade, proporcionando assim uma partição com maior teor de recuperação. Quanto a composição do sistema, foi observado que aumento da concentração de PEG e sal é desfavorável a partição, o que pode ser resultado do efeito combinado do volume de exclusão e do efeito salting out.
Agradecimentos
A Universidade Estadual do Sudoeste da Bahia (UESB) e a CAPES pela concessão da bolsa.
Referências
ALICI, E. H; ARABACI, G. A novel serine protease from strawberry (Fragaria ananassa): Purification and biochemical characterization. International journal of biological macromolecules, v. 114, p. 1295-1304, 2018.
ALBERTSSON, P. A. Aqueous Polymer-phase Systems Partition of Cell Particles and Macromolecules, 3nd edition, Wiley, New York, 1986.
ASENJO, Juan A.; ANDREWS, Barbara A. Aqueous two-phase systems for protein separation: a perspective. Journal of Chromatography A, v. 1218, n. 49, p. 8826-8835, 2011.
BARBOSA, J. M. P., SOUZA, R. L., FRICKS, A. T., ZANIN, G. M., SOARES, C. M. F., & LIMA, Á. S.. Purification of lipase produced by a new source of Bacillus in submerged fermentation using an aqueous two-phase system. Journal of Chromatography B, v.879, p. 3853-3858, 2011.
BENAVIDES, J.; AGUILAR, O.; LAPIZCO-ENCINAS, B.H.; RITO-PALAMARES, M. Extraction and purification of bioproducts and nanoparticles using aqueous two-phase systems strategies. Chemical Engineering & Technology, v. 31, p.838–45. 2008.
BON, E.P.P.; ANTONIETA, M.; LUISA, M. Enzimas em Biotecnologia: Produção, Aplicações e Mercado, Interciência, Medicina e Saúde EDITION, 2008.
CHINNADURAI, GANDHI SHREE; KRISHNAN, SIVAKUMAR; PERUMAL, PALANI. Studies on detection and analysis of proteases in leaf extract of medicinally important plants. Phytomedicine, v. 40, p. 176-188, 2018.
DAMORAN, SRINIVASAN; PARKIN, KIRK L.; FENNEMA, OWEN R. Química de alimentos de Fennema. Tradução Adriano Brandelli, 4 ed., Porto Alegre: Artmed, 2010.
KUNITZ, M. Crystalline soybean trypsin inhibitor II. General properties. The Journal of General Physiology, 30, 291-310, 1947.
NANDINI, K. E.; RASTOGI, N. K. Liquid–liquid extraction of lipase using aqueous two-phase system. Food and bioprocess technology, v. 4, n. 2, p. 295-303, 2011.
RAWDKUEN, S.; PINTATHONG, P.; CHAIWUT, P.; BENJAKUL, S. The partitioning of protease from Calotropis procera latex by aqueous two-phase systems and its hydrolytic pattern on muscle proteins. Food and Bioproducts Processing, v. 89, n. 1, p. 73-80, 2011.
SANTOS, I. C.; PEDROSA, M. W.; CARVALHO, O. C.; GUIMARÃES, C. D. C.; SILVA, L. S. Ora-pro-nóbis: da cerca à mesa. Empresa de Pesquisa Agropecuária de Minas Gerais – EPAMIG. Circular Técnica, n.177, 2012.
SUN, Q., ZHANG, B., YAN, Q. J., & JIANG, Z. Q. Comparative analysis on the distribution of protease activities among fruits and vegetable resources. Food chemistry, 213, 708-713, 2016.









