EFEITO DA ADIÇÃO DE CERA DE CARNAÚBA EM REVESTIMENTOS BIOPOLIMÉRICOS NA VIDA DE PRATELEIRA DE ASPARGOS VERDES
ISBN 978-85-85905-25-5
Área
Alimentos
Autores
de Menezes, F.L.G. (UFERSA) ; Aroucha, E.M.M. (UFERSA) ; dos Santos, F.K.G. (UFERSA) ; Leite, R.H.L. (UFERSA) ; de Paiva, C.A. (UFERSA) ; de Almeida, J.G.L. (UFERSA)
Resumo
Este trabalho busca avaliar revestimentos biopoliméricos na manutenção da qualidade pós-colheita de aspargos. Para isto, foram aplicados revestimentos a base de Quitosana (1,5%), duas blendas de fécula de mandioca e Quitosana, respectivamente (1:1 e 2:1) e fécula 3%. Cera de carnaúba (2,5%) como material hidrofóbico. Filmes de Quitosana a blenda fécula-Quitosana (2:1) mostraram valores menores de permeabilidade a vapor de água (PVA) e valores de ângulo de contato acima de 65°, evidenciando seu caráter hidrofóbico. Como revestimentos mostraram indicadores positivos na conservação pós- colheita de aspargos verde, barrando a perda de massa e mantendo os parâmetros de cor por mais tempo, a composição blenda fécula-Quitosana (2:1), mostrou boa aparência até 16 dias de armazenamento a 10°C.
Palavras chaves
Revestimento; Biopolímero; Aspargo
Introdução
Aspargos verdes (Asparagus officinalis L.) é uma hortaliça nativo de países europeus, africanos e asiáticos. Ele contém muitos compostos bioativos, tais como saponinas, flavonóides, frutose e aminoácidos (PARK, 2016). Estudos realizados por Fanasca e colaboradores (2009) e Slatnar et al. (2018), relataram em aspargo o conteúdo de fenólicos, carotenóides e vitamina C, açúcares, ácidos orgânicos, antocianinas , flavonóis, flavonas e ácidos hidroxicinâmicos. Esse vegetal, têm uma vida útil pós-colheita curta, devido à sua alta taxa de respiração (60 mg CO2/kg/h a 5 ° C), e em geral é de 3 a 5 dias à temperatura ambiente e 14-15 dias em condições refrigeradas (KADER, 1992, SIMÓN & GONZALEZ-FANDOS, 2011). A alta perecibilidade do aspargo sugere que alguma tecnologia pós-colheita deve ser adotada para diminuir as perdas. Nesse sentido, o emprego de embalagens contribui para a manutenção das propriedades dos alimentos, no entanto, a maioria dos materiais utilizados são fabricados com polímeros sintéticos, que geram problemas ambientais, sendo a utilização de materiais biodegradável uma alternativa que pode reduzir as percas pós-colheita e os impactos ambientais (LUCHESE et al., 2015). A utilização de filmes e revestimentos biodegradáveis são opções viáveis para incremento de qualidade, segurança, estocagem e transporte de alimentos (MACHADO; BENELLI; TESSARO, 2017), em conjunto com o uso do frio reduz a atividade metabólica do vegetal. Trata-se de camadas finas de materiais comestíveis que podem ser aplicadas diretamente no alimento (OLIVEIRA et al., 2018; SANTOS et al., 2018 ), modificando a atmosfera interna do produto. Fuchs et al. (2008) e Qiu et al. (2013), verificaram que a utilização de revestimentos comestíveis foi positivo na conservação de aspargos frescos. Entre os polímeros naturais com ampla possibilidade de uso temos polissacarídeos como amido e Quitosana, estes tem natureza biodegradável e não tóxica. A Quitosana é um amino polissacarídeo natural solúvel em ácidos orgânicos, e pode ser usado como material de revestimento para preservar frutas, já o grupo amido tem sido considerado o candidato mais promissor, principalmente por combinar alta disponibilidade, baixo preço e bom desempenho (OLIVEIRA et al., 2018; SILVA et al., 2018). Nesses biopolímero, há a necessidade de adicionar lipídios, substâncias hidrofóbicas, capazes de reduzir a taxa de transmissão do vapor de água, dentre eles a cera de carnaúba que em revestimentos aumenta a resistência a vapor de água e reduz as perdas de peso, quando aplicados sobre frutos (CHIUMARELLI; HUBINGER, 2012). Assim, em virtude das fragilidades dos possíveis danos pós-colheita dos aspargos e de sua importância nutricional, este trabalho busca avaliar os potenciais efeitos dos revestimentos biopoliméricos a base de fécula de mandioca e Quitosana com cera de carnaúba como alternativa para manutenção da qualidade pós-colheita de aspargos.
Material e métodos
Os experimentos foram realizados no Laboratório de Tecnologia de Alimentos da Universidade Federal Rural do Semi-Árido-UFERSA. Este foi dividido em duas etapas: Primeiro foi obtido quatro biofilmes, um de Quitosana (1,5%), duas misturas com fécula de mandioca e Quitosana, respectivamente (1: 1 e 2: 1) e fécula 3%. Foi utilizado cera de carnaúba (2,5%), Tween 80 e glicerol, como material hidrofóbico, surfactante e plastificante respectivamente. Em seguida, foi selecionado os melhores filmes quanto a propriedade de barreira à água e utilizados como revestimento para aumentar a vida de prateleira de aspargos verdes. A Quitosana com 85% de desacetilação foi obtida da POLYMAR (Indústria e Com. Imp. e Exp. Ltda – Brasil). As soluções filmogênicas formadora de filme de Quitosana 2% foi preparada dissolvendo pó de Quitosana em solução de ácido acético a 1% até completa dissolução. As dispersões de fécula aquoso foi aquecidas a 70±5 °C e mantidos a esta temperatura por 30 min em agitação constante até gelatinização e em seguida foi obtido a solução filmogênica formadora de filme da blendas de fécula-Quitosana (1:1 e 2:1) e de fécula 3%. As soluções filmogênicas foram depositadas em placas de acrílico com dimensões de 15 cm e deixados para secar pela evaporação do solvente. Todos os filmes foram preparados em triplicata, condicionados à 23°C e 55% de humidade relativa e caracterizados. Um grupo de aspargos verdes foram previamente colhidos, na maturidade comercial, inspecionados para retirada de possíveis injúrias, posteriormente foram lavados em solução de hipoclorito de sódio (100 ppm) por 10 minutos e separados de acordo com a composição dos revestimentos. As lanças de aspargos foram imersas nas soluções filmogênicas cerca de 60s e secas à temperatura ambiente, colocadas em bandejas plásticas e submetidas a armazenamento refrigerado à 10°C. Aspargos não revestidos foram incluídos como controles e foram analisado para os cinco tempos de armazenamento (0, 4, 8, 12 e 16 dias). Os dados foram avaliados pela análise de variância e teste Tukey (p<0,05) com o auxílio do software SISVAR.
Resultado e discussão
Os filmes biopoliméricos foram obtidos, estes mostraram boa formação de
géis, boa aparência, miscibilidade e de fácil manuseio permitindo a remoção
dos mesmos das placas de acrílico.
Na figura 1 é mostrado as variações do ângulo de contato e da Permeabilidade
ao Vapor de água (PVA) dos filmes. Duas formulações tiveram maior caráter
hidrofóbico, a de Quitosana 1,5% a blenda fécula-Quitosana (2:1) ambas com
cera de carnaúba. A proporção 2:1 de fécula de mandioca e Quitosana,
respectivamente, mostrou maior caráter hidrofóbico, com PVA de 23,13 (±2,06)
(g.mm/h.Kpa.m²) e ângulo de contato de 67,43 (±1,51) em relação à relação
1:1, que apresentou um aumento de 23% e uma diminuição de 29% no WVP e no
ângulo de contato, respectivamente (Fig. 1).
O filme que tinha somente fécula apresentou um caráter hidrofílico com um
aumento de 31% e decréscimo de 22% na PVA e no ângulo de contato,
respectivamente.
O ângulo de contato representa o ângulo em que uma substância líquida forma
com a superfície, quando superiores a 65° o filme é caracterizado como
hidrofóbico, e inferiores como hidrofílicos (JARAMILO et al., 2015). Nesse
sentido, os filmes de Quitosana 1,5% a blenda fécula-Quitosana (2:1) ambas
com cera de carnaúba podem ser caracterizados como hidrofóbicos.
A perda de água provoca danos na qualidade e conservação dos alimentos
embalados, sendo, uma baixa permeabilidade ao vapor de água um critério
importante na escolha do filme para cobertura em frutos e hortaliças. As
propriedades relacionadas a barreira de água dependem da estrutura do filme,
da quantidade de material hidrofílico/hidrofóbico, da mobilidade da cadeia
polimérica devido à presença de plastificantes e da relação entre regiões
amorfas e cristalinas (AZEVEDO et al., 2017). O que sugere, o caráter mais
hidrofóbico dos filmes Quitosana 1,5% a blenda fécula-Quitosana (2:1) ser
decorrente da presença de cera de carnaúba que lhes traz um caráter
hidrofóbico (MATTOS et al., 2017), bem como, das interações entre Quitosana
e fécula que pode reduzir a disponibilidade de matrizes de Quitosana nos
grupos hidrofílicos (CHILLO et al., 2008).
Duas formulações foram selecionadas para serem aplicadas em aspargos verdes
(Quitosana 1,5% a blenda fécula-Quitosana, ambas com cera de carnaúba), com
intuito de avaliar características importantes que influenciam a percepção
da qualidade desse vegetal. Na figura 2 é mostrada perda de massa,
característica de cor e aparência das lanças de aspargos no primeiro tempo
de tratamento e com 16 dias.
Ocorreu um aumento progressivo de perda de massa ao longo do tempo de
armazenamento em todos vegetais, isso é atribuído em grande parte à perda de
água pela transpiração, devido à diferença na pressão do vapor de água entre
a atmosfera e a superfície dos aspargos. No entanto, os aspargos revestidos,
mostraram redução de perda de massa e manutenção da cor verde (fig. 2). A
perda de peso é considerada o principal determinante da vida de
armazenamento e da qualidade pós-colheita dos espargos (QIU et al., 2013).
Após 16 dias de armazenamento, os aspargos controle mostraram perda de massa
(9,5%) superior aos aspargos revestidos com Quitosana 1,5%+cera e blenda
fécula-Quitosana (2:1)+ cera (6,9% e 6,2% respectivamente).
O que sugere que os revestimentos comestíveis criaram uma barreira física
para a perda de umidade e, portanto, retardar a desidratação e o
encolhimento. Essa redução é importante, pois, está relacionada com a
manutenção da qualidade pós-colheita de aspargos, já que perda de massa e
redução da clorofila (aspargo verde) é um dos sintomas de deterioração
(RODRIGUES et al., 2004; SIOMOS et al., 2000). A perda de peso tem um forte
impacto na aparência dos aspargos, uma perda de massa acima de 8% faz com
que os aspargos não sejam comercializáveis (SIOMOS, 2003). Na figura 2
podemos observa esse comportamento bem evidente nos aspargos sem
revestimento com 16 dias de armazenamento, mostrando uma maior desidratação
e o enrugamento das lanças (fig. 2c).
Os aspargos sem revestimento mostraram uma redução nos valores de ângulo
hue, evidenciando um aparecimento da cor amarela, no decorrer dos 16 dias,
seguida pelos aspargos revestidos com Quitosana e posteriormente com blenda
(2:1) (fig. 2b), que apresentaram cor amarela-esverdeado. Indicando uma
coloração mais verde nos aspargos revestidos, o que é devido à predominância
de pigmentos de clorofila em comparação com o controle, que aumentou uma cor
mais amarela. Mattos et al. (2017) argumentam que a incorporação cera de
carnaúba, melhora as propriedades de barreira a gases (CO2 e O2 e vapor de
água,) em revestimentos, reduzindo a transpiração e assim prolonga a vida
útil dos produtos vegetais. A formação de blendas com dois polímeros de
natureza hidrofílica como a Quitosana e a fécula são geralmente utilizadas
para melhorar suas propriedades devido a formação de ligações diferentes que
pode ocorrer na mistura e que não ocorreriam em matrizes contendo apenas um
dos polímeros (BAHRAMI et al., 2017). O revestimento comestível exibiu um
impacto benéfico na qualidade dos aspargos, retardando a perda de massa e
mantendo a cor desejável nos aspargos por maior tempo.
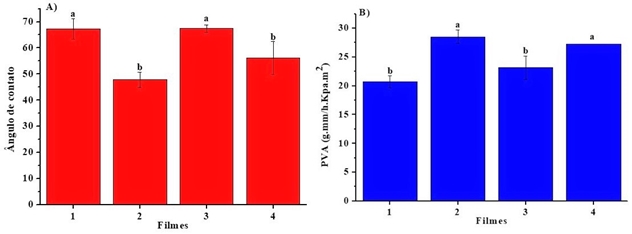
Variações do ângulo de contato (A) e PVA (B) em filmes à base de Quitosana (1,5%) (1) , blendas (1:1) (2) e (2:1) (3) e fécula 3% (4)
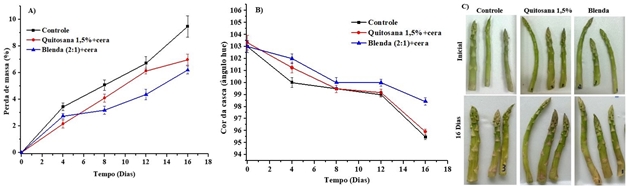
Perda de massa (A), ângulo hue (B), e aparência (C) dos aspargos revestidos com soluções filmogênicas.
Conclusões
Os filmes obtidos foram homogêneos, coesos e com boa aparência. Quanto a caracterização, duas formulações mostraram maior caráter hidrofóbico, a de Quitosana 1,5% a blenda fécula-Quitosana (2:1) ambas com cera de carnaúba, apresentando menores valores de PVA e ângulos de contatos superiores a 65°, dandos-lhe, um caracter hidrofóbico. A aplicação dessas formulações como revestimentos mostraram indicadores significantes quanto a conservação pós- colheita de lanças de aspargos verde na manutenção de perda de massa e dos parâmetros de cor, com destaque para composição blenda fécula-Quitosana (2:1), que mostrou perda de massa de 6,2% e uma boa aparência ao final de 16 dias. Garantindo grande relevância no desenvolvimento e uso de materiais sustentáveis para o futuro.
Agradecimentos
Universidade Federal Rural do Semi-Árido pelo suporte técnico
Referências
AZEVEDO, V. M.; BORGES, S. V.; MARCONCINI, J. M.; YOSHIDA, M. I.; NETO, A. R. S.; PEREIRA, T. C.; PEREIRA, C. F. G. Effect of replacement of corn starch by whey protein isolate in biodegradable film blends obtained by extrusion. Carbohydrate Polymers, v. 157, p. 971-980, 2017.
BAHRAMI, R.; LÖBLING, T. I.; SCHMALZ, H.; MÜLLER, A. H. E.; ALTSTÄDT, V. Synergistic effects of Janus particles and triblock terpolymers on toughness of immiscible polymer blends. Polymer, v. 109, p. 229-237, 2017.
CHILLO, S.; FLORES, S.; MASTROMATTEO, M.; CONTE, A.; GERSCHENSON, L.; DEL NOBILE, M. A. Influence of glycerol and chitosan on tapioca starch-based edible film properties. Journal of Food Engineering, v. 88, n. 2, p. 159-168, 2008.
CHIUMARELLI, M.; HUBINGER, M. D. Stability, solubility, mechanical and barrier properties of cassava starch – Carnauba wax edible coatings to preserve fresh-cut apples. Food Hydrocolloids, v. 28, n. 1, p.59-67, 2012.
FANASCA, S.; ROUPHAEL, Y.; VENNERIA E.; AZZINI, E.; DURAZZO A.; MAIANI, G. Antioxidant properties of raw and cooked spears of green asparagus cultivars. International Journal of Food Science and Technology, v. 44, p.1017-1023, 2009.
FUCHS, S. J.; SCOTT MATTINSON, D.; FELIMAN, J. K. Effect of edible coatings on postharvest quality of fresh green asparagus. Journal of Food Processing and reservation, v.32, p.951-971, 2008.
JARAMILLO, C. M.; SELIGRA, P. G.; GOYANES, S.; BERNAL, C.; FAMÁ, L. Biofilms based on cassava starch containing extract of yerba mate as antioxidant and plasticizer. Starch/Stärke. v.67, p.780-789, 2015.
KADER, A. A. Postharvest biology and technology: An overview. In Postharvest Technology of Horticultural Products, 2nd Ed., (A.A. Kader, ed.) pp. 15-20. Publication 3311. University of California, Division of Agriculture and Natural Resources. 1992.
LUCHESE, C. L.; FRICK, J. M.; PATZER, V. L.; SPADA, J. C.; TESSARO, I. C. Synthesis and characterization of biofilms using native and modified pinhão starch. Food Hydrocolloids, v.45, p.203-210, 2015.
MACHADO, C. M.; BENELLI, P.; TESSARO, I. C. Sesame cake incorporation on cassava starch foams for packaging use. Industrial Crops And Products, v.102, p.115-121, 2017.
MATTOS, D. G.; PAIVA, P. D. O.; NERY, F. C.; VALE, R. P.; SARTO, M. T.; LUZ, I. C. A. Water relations in post-harvested torch ginger affected by harvest point and carnauba wax. Postharvest Biology And Technology, v.127, p.35-43, 2017.
OLIVEIRA, V. R. L.; SANTOS, F. K. G.; LEITE, R. H. L.; AROUCHA, E. M. M.; SILVA, K. N. O. Use of biopolymeric coating hydrophobized with beeswax in post-harvest conservation of guavas. Food Chemistry, v.259, p.55-64 2018.
PARK, M. Sucrose delays senescence and preserves functional compounds in Asparagus officinalis L. Biochemical and Biophysical Research Communications, v. 480, p.241-247, 2016.
QIU, M.; JIANG, H.; REN, G.; HUANG, J.; WANG, X. Effect of chitosan coatings on postharvest green asparagus quality. Carbohydrate Polymers, v.92, p.2027-2032, 2013.
RODRÍGUEZ, R.; JARAMILLO, S.; HEREDIA, A.; GUILLÉN, R.; JIMÉNEZ, A.; FERNÁNDEZ-BOLAÑOS, J. Mechanical properties of white and green asparagus: Changes related to modifications of cell wall components. Journal of the Science of Food and Agriculture, v.84, n.12, p.1478-1486, 2004.
SANTOS, T. M.; SOUZA FILHO, M. D. S. M.; SILVA E. D. O.; SILVEIRA, M. R. S. D.; MIRANDA, M. R. A. D.; LOPES, M. M. A.; AZEREDO, H. M. C. Enhancing storage stability of guava with tannic acid-crosslinked zein coatings. Food Chemistry, v.257, p.252-258, 2018.
SILVA, W. B.; SILVA, G. M. C.; SANTANA, D. B.; SALVADOR, A. R.; MEDEIROS, D. B.; BELGHITH, I.; SILVA, N. M.; CORDEIRO, M. H. M.; MISOBUTSI, G. P. Chitosan delays ripening and ROS production in guava (Psidium guajavaL.) fruit. Food Chemistry, v.242, p.232-238, 2018.
SIMÓN, A.; GONZALEZ-FANDOS, E. Influence of modified atmosphere packaging and storage temperature on the sensory and microbiological quality of fresh peeled white asparagus. Food Control, v.22, p.369-374, 2011.
SIOMOS, A. S. Quality, handling and storage of white asparagus. DRIS, R.; NISKANEN, R. ; JAIN, S. M. (Eds.), Crop management and postharvest handling of horticultural products, Science Publishers, Inc., Enfield (NH), USA (2003), pp. 65-88.
SIOMOS, A. S.; SFAKIOTAKIS, E. M.; DOGRAS, C. C. Modified atmosphere packaging of hite asparagus spears: Composition, colour and textural quality responses to temperature and light. Scientia Horticulturae, v. 84, n.1-2, p.1-13, 2000.
SLATNAR, A.; MIKULIC-PETKOVSEK, M.; STAMPAR, F.; VEBERIC, R.; HORVAT, J.; JAKSE, M.; SIRCELJ, H. Game of tones: Sugars, organic acids, and phenolics in green and purple asparagus (Asparagus officinalis L.) cultivars. Turkish Journal of Agriculture and Forestry, v.42, p.55-66, 2018.
TZOUMAKI, M. V.; BILIADERIS, C. G.; VASILAKAKIS, M. Impact of edible coatings and packaging on quality of white asparagus(Asparagus officinalis, L.) during cold storage. Food Chemistry, v.117, p.55-63, 2009.









